红细胞-纳米载体递药系统研究进展
苏艳慧,张文丽,沈雁,郑春丽
(中国药科大学药剂系,江苏 南京 210009)
近年来,通过包封或吸附将药物整合于纳米合成材料中的纳米诊疗载体具有提高药物体内稳定性、延长药物作用时间、降低药物给药剂量、降低毒副反应、靶向递送药物等作用[1-3]。目前为止,已经有多种纳米载体,如脂质体[4]、聚合物纳米粒[5]、聚合物胶束[6]、脂质纳米粒[7]等被研究用于负载药物从而实现不同疾病的治疗与诊断。但是,当其通过静脉注射进入体内后,会迅速被体内网状内皮系统(reticuloendothelial system,RES)识别、捕获和吞噬,从而导致其在肝、脾等组织中的蓄积,并最终从血液中被清除,极大地降低了药物在靶组织的药量,从而影响了药物的治疗效果[8]。目前已经研究出多种方法降低RES对纳米载体的清除作用,最常见的策略是采用亲水性聚合物高分子材料聚乙二醇(Polyethylene glycol,PEG)表面修饰以延长纳米载体在体内的循环时间,解决纳米载体在体内的生物相容性问题[9]。然而,长期反复注射PEG修饰纳米载体会在体内产生特异性抗体从而激活人体补体系统,反而增强了肝脏库普弗细胞对纳米载体的吞噬作用,最终会加速纳米载体在机体的清除[10]。这种缺陷极大地限制了合成纳米载体在临床上的应用,因此,探索一种低免疫原性的新型药物递送系统具有重要的研究价值。
研究表明,红细胞膜表面分布的一种跨膜蛋白CD47可与单核-巨噬细胞表面信号调节蛋白-α(signal regulatory protein-alpha,SIRP-α)受体结合产生抑制信号,从而使其避免被RES吞噬清除[11]。因此将红细胞与纳米载体相结合能够降低纳米载体的血浆蛋白结合率、降低RES的清除作用从而延长其在体内的循环时间。且与合成纳米载体相比,红细胞具有易获得性、生物相容性好、循环周期长、体积与比表面积大与生物消除机制安全等优点[12-14]。将红细胞与纳米载体相结合构建红细胞-纳米载体递药系统不仅能够延长纳米载体的体内循环时间,还可提高纳米载体的靶向性,提高药物的生物利用度,因此具有良好的应用前景。根据红细胞与纳米载体的构建方式不同,可以分为以下3种方式:红细胞包埋纳米载体、红细胞表面结合纳米载体与红细胞膜包被纳米载体。本文主要就这3种构建方式介绍红细胞-纳米载体递药系统的最新研究进展。
1 红细胞包埋纳米载体递药系统
红细胞包埋纳米载体递药系统是指将纳米载体封装入红细胞内,使纳米载体与体循环血液环境基本隔绝,因此能够保护纳米载体不被RES清除从而延长纳米载体的循环时间[15]。将纳米载体包埋入红细胞内必须要穿过细胞膜。因此,在不破坏细胞膜的情况下,将其装载到红细胞中,是制备的关键环节,主要通过低渗预膨胀的方法实现[16]。低渗预膨胀法是将红细胞置于相对低渗的溶液环境中,使红细胞发生膨胀打开红细胞膜的紧密连接,在红细胞膜表面出现20~50 nm的瞬时孔洞,此时向溶液环境中加入纳米载体,纳米载体通过孔洞进入红细胞后再将溶液环境恢复为等渗状态,红细胞即恢复到正常状态,细胞膜表面的孔洞关闭,纳米载体被截留封装进红细胞内。这种方法通常将粒径较小的纳米载体如磁性无机纳米粒封装入红细胞,用于药物递送与体内成像等。缪婉琳[17]采用低渗透预膨胀方法,将磁性纳米粒Fe3O4@DMSA与化疗药物盐酸阿霉素封装入红细胞中,构建一种磁响应性红细胞递药系统。将其回输到小鼠体内后,通过外磁场的作用可将回输的红细胞载药体系聚集到肿瘤部位。与游离阿霉素相比,红细胞递药系统在抑制肿瘤生长、降低药物剂量与药物副作用等方面具有显著优势。Antonelli等[18-19]将经美国FDA批准上市的血管造影剂磁性纳米粒Ferucarbotran包埋在红细胞内,小鼠药代动力学与核磁共振成像实验结果显示,红细胞包埋Ferucarbotran的新型示踪剂能够显著延长其在血液中的循环时间并增强了在器官和脑血管的显像能力。Hamidi等[20]将负载抗癫痫药物丙戊酸钠的壳聚糖纳米凝胶包埋入红细胞内构建红细胞纳米载体递药递药系统,实验结果显示该递药递药系统能够延缓药物释放,从而达到延长药物作用时间的目的(见图1)。然而,通过低渗预膨胀的方法只能用于包封粒径较小的纳米载体,对于粒径较大的纳米载体并不适用。除此之外,通过电穿孔法、化学包埋法等其他包埋方法会对红细胞造成更大的损伤,降低红细胞的生物相容性。

图1 红细胞包埋纳米载体递药系统示意图[21]
2 红细胞表面结合纳米载体递药系统
早期对红细胞的研究多集中在将纳米载体包埋入红细胞内部,忽略了对红细胞膜的利用。红细胞表面积高达160 μm2,为纳米载体的表面结合提供了充足的空间,而且将纳米载体结合在红细胞膜表面不需要在红细胞膜表面打孔,一定程度上降低了对红细胞结构和功能的损伤。红细胞表面结合纳米载体的方式分为特异性结合与非特异性吸附两种方式。
2.1 红细胞与纳米载体的特异性结合红细胞表面含有各种丰富的多糖、氨基酸残基与抗原,使其能够与纳米载体通过化学共价键结合或配体-受体特异性结合。
2.1.1 化学共价键介导的特异性结合红细胞膜表面含有大量硫醇基团,可将其生物素功能化,从而与亲和素修饰的纳米载体偶联,与红细胞之间形成一种稳定的特异性结合作用。Wang等[22]制备了一种表面涂覆光敏剂二氢卟吩e6(chlorin e6,Ce6)与PEG的氧化铁磁性纳米粒,并进一步通过生物素-亲和素偶联作用将其结合到载有化疗药物的红细胞表面构建了载药红细胞-磁性纳米粒-Ce6磁响应药物递送系统(RBC-IONP-Ce6-PEG)(见图2)。体内成像结果表明,RBC-IONP-Ce6-PEG可显著延长纳米载体在体内的循环时间,当在肿瘤部位外加磁场,可实现纳米载体在肿瘤部位的靶向富集。体内药效结果进一步显示,载有化疗药物的红细胞与磁靶向的联合治疗能够以较低药物剂量达到抗肿瘤效果,且具有显著的协同效果。
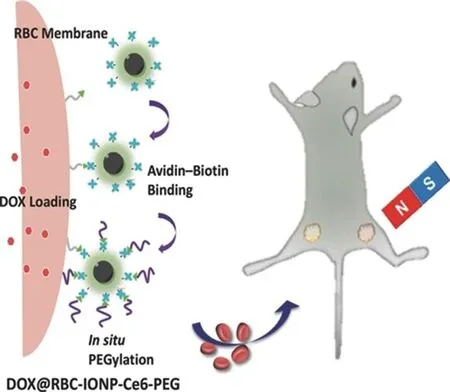
图2 化学共价键介导的红细胞与纳米载体特异性结合示意图
2.1.2 配体-受体介导的特异性结合红细胞与纳米载体特异性结合的另一种方式是配体-受体介导的特异性结合。近年来,通过噬菌体展示技术筛选了大型随机肽库,已发现多种与红细胞表面受体特异性结合的肽段配体,有助于纳米载体与红细胞的配体-受体偶联结合[23]。经与红细胞表面蛋白特异性结合的亲和配体(抗体、多肽片段等)修饰的纳米载体具有较高的红细胞表面结合率[24]。血型糖蛋白A(glycophorin A,GPA)是红细胞膜表面的一种具有受体功能的唾液酸糖蛋白,具有很高的亲和力与特异性,可用作配体结合的靶位点[25]。Sahoo等[26]研究发现,在载牛血清白蛋白的纳米粒表面修饰了对GPA具有高亲和性的12位氨基酸多(ERY1),可使纳米粒通过配体-受体特异性结合作用黏附在红细胞表面,延长载药纳米粒在体内的循环时间(见图3)。
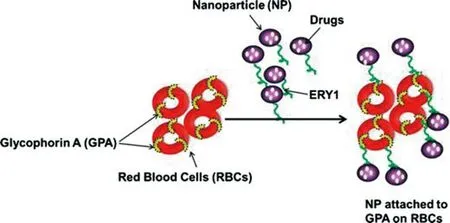
图3 配体-受体介导的红细胞与纳米载体特异性结合示意图
配体-受体介导的红细胞与纳米载体的特异性结合方式相对于共价连接的方式对红细胞的损伤较小。但也有缺点,比如纳米载体吸附过多会影响红细胞表面跨膜蛋白,导致其易被单核-巨噬细胞吞噬,红细胞的体内循环寿命降低。此外,由于体内多种细胞的表面有相同或相似受体,使纳米载体可能与体内其他非特异性细胞结合,影响药物的体内递送。
2.2 红细胞与纳米载体的非特异性吸附相比与红细胞与纳米载体特异性结合,红细胞与纳米载体结合的最简单的方法是将纳米载体非特异性物理吸附到红细胞表面,这种非特异性吸附又称“红细胞搭便车”技术(red blood cell-hitchhiking,RH)[27]。红细胞的质膜表面存在能与疏水纳米载体结合的相对疏水的结构域,这些疏水相互作用能使带正电荷和负电荷的疏水纳米粒均能与红细胞表面结合。红细胞膜中含有的羧酸、唾液酸和磷酸等带有负电性的基团使其表面带有负电荷,有利于带正电荷纳米载体的吸附[28]。Zelepukin等[29]考察了表面带有不同电荷的粒径不同的磁性纳米粒的红细胞吸附效率与小鼠体内循环时间,结果显示带正电荷的疏水性磁性纳米粒红细胞表面吸附效率较高且能在血液循环中保留较长时间。纳米载体可通过范德华力、静电吸附力、疏水相互作用、氢键等驱动力吸附在红细胞表面,这种非特异性吸附作用是可逆的,能够改变纳米载体的体内行为。
2.2.1 延长体内循环时间正常红细胞的在体内的寿命约为120 d,其体内循环时间远高于纳米载体,而将纳米载体以非特异性吸附的方式附着在红细胞表面,可以避免RES的巨噬细胞吞噬和清除作用,从而延长纳米载体在体内的循环时间。有研究表明,游离纳米载体在大鼠血液循环中的保留了5 min,而RH的纳米载体在血液环境中保留了10 h[30]。Wang等[31]将负载维生素K1的阳离子壳聚糖纳米粒与红细胞共同孵育,制备了红细胞表面吸附壳聚糖纳米粒,并对其进行药动学分析,结果显示与纳米粒和游离药物相比,负载维生素K1壳聚糖纳米粒的红细胞递药系统具有较好的缓释作用,并可实现体内长循环效果。
2.2.2 改变纳米载体生物分布除了降低RES的清除作用、延长纳米载体的循环时间外,RH还改变了纳米载体在生物体内的分布情况,表现为RH能够增加纳米颗粒的肺部蓄积,同时降低肝脏和脾脏的摄取和清除作用。
Anselmo等[30]将羧化聚苯乙烯纳米粒吸附到红细胞表面,然后通过静脉注射入小鼠体内,结果显示与游离纳米粒相比,红细胞表面吸附纳米粒在肺部蓄积高达7倍。Zhao等[32]采用“红细胞搭便车”技术,将载有阿霉素的PLGA纳米粒递送至肺部以治疗肺转移黑色素瘤。与游离纳米粒相比,RH纳米颗粒的肺组织药物蓄积达到的15倍以上,从而提高肺部治疗药物剂量,显著抑制肺转移瘤进展,改善肺癌的预后。RH可以与传统的抗体靶向相结合,通过协同作用提高药物在肺部的蓄积。Anselmo等[33]结合“红细胞搭便车”技术,纳米粒棒状结构和抗体靶向相结合构建ICAM-Rod-Hitchhike递送药物并探究其对于肺部炎症模型的协同作用。由于在肺部炎症模型肺组织内皮细胞高表达ICAM,利用ICAM单克隆抗体对纳米粒进行表面修饰。将ICAM单克隆抗体表面修饰,棒状结构与“红细胞搭便车”技术的纳米粒单独及联合应用进行对比,考察纳米粒的炎症肺部的蓄积作用(见图4)。结果显示,这3个方面的联合应用可以有效降低纳米粒在肝、脾中的浓度,同时显著增加了纳米粒在肺部的有效蓄积。Brenner等[34]研究发现RH除了将纳米载体靶向递送至肺组织外,还可通过改变RH注射部位将纳米载体选择性优先递送至注射部位下游的器官,当将RH注射入颈内动脉、肾动脉或颈总动脉时、RH表面搭载的纳米载体分别靶向递送至脑、肾或面部,为利用RH将表面搭载纳米载体进行不同器官的靶向递送提供了新的可能,并将其扩展于其他临床应用。
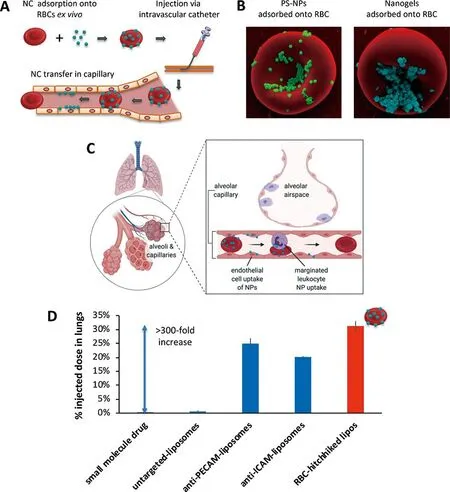
图4 “红细胞搭便车”的作用示意图
RH这种改变纳米载体生物分布的机制是由于体内RH流经下游器官致密毛细血管网络时,由于毛细血管直径远小于红细胞直径,因此红细胞表面吸附纳米粒在流经狭窄毛细血管高剪切应力环境时纳米粒从红细胞表面可逆脱落并转移至下游器官中。搭载在红细胞表面的纳米载体的大小和形状可能会影响它们在体内的药代动力学和生物分布,研究发现粒径较大的带正电荷疏水性纳米载体在红细胞表面吸附效率较高且能在体内循环时间较长,且与球形纳米粒相比,杆状颗粒在肝脏和脾脏中的分布较少,在肺部的分布较多。此外,通过增加非特异性吸附在红细胞上纳米载体的数量使载体红细胞质膜更坚硬和诱导瞬时膜损伤,这两种效应会导致产生肺部剪切诱导的纳米载体分离的抵抗力,使脾脏中纳米载体与免疫细胞之间的相互作用增加,最终导致纳米载递送到脾脏而不是肺部[35]。
3 红细胞膜包被纳米载体
红细胞膜包被纳米载体是将纳米粒内核和红细胞膜结合,能够提高纳米载体稳定性、延长纳米载体在血液中循环时间以及实现药物缓控释放,是一种已进入临床研究的极具发展前景的新型药物载体(总结如表1所示)。红细胞膜包被纳米载体的制备通常包括两个部分:红细胞衍生囊泡的提取与囊泡-纳米载体融合。红细胞衍生囊泡一般通过低渗透析挤压法获得,首先将红细胞置于低渗环境下使红细胞膜孔打开释出内容物,得到的红细胞膜经纳米膜挤压得到红细胞衍生囊泡,然后通过机械挤出将纳米载体与囊泡进行融合。自2011年,Hu等[36]首次设计了红细胞膜包被PLGA纳米粒用于开发长循环纳米递药系统。与传统的PEG修饰PLGA纳米粒15.8 h的半衰期相比,红细胞膜包被纳米粒的半衰期长达39.6 h。然而,红细胞膜包被纳米载体缺乏主动靶向能力限制了其在临床的应用,基于此,人们提出了将靶向配体与红细胞膜相结合的脂质插入策略。Su等[37]设计了嵌入肿瘤穿透肽iRGD的红细胞膜包被负载紫杉醇的杂化聚合物纳米粒核心的递药系统(RNPs),RNPs与游离纳米粒相比血液循环半衰期延长了5.8倍。此外,由于RNPs提高了肿瘤穿透能力,可显著抑制90%以上的肿瘤生长,并抑制95%的肺转移。然而,负载在红细胞膜包被的纳米载体中的药物释放过程通常是不受控的、基于自由扩散的机制释放[38]。因此,将药物可控释放与长循环相结合是精准给药的关键因素。针对这一问题,提出了刺激响应性红细胞膜包被纳米载体,以实现精准的药物递送与释放[39-40]。Pei等[41]制备了由活性氧响应性的紫杉醇二聚体前药(PTX2-TK)与光敏剂(5,10,15,20-四苯基氯,TPC)组成的聚合物纳米粒,并通过进一步红细胞膜包被获得红细胞膜包被纳米颗粒。该纳米颗粒在638 nm激光照射下,TPC可以产生ROS,并触发PTX2-TK裂解,破坏了红细胞膜,促进PTX在肿瘤组织内的快速释放。体内实验结果证实,红细胞膜表面涂层可延长纳米颗粒在血液环境中的循环时间,改善肿瘤药物蓄积。红细胞膜包被纳米载体已被广泛研究用于多种应用,包括药物递送、成像、光疗、纳米疫苗和纳米解毒剂等,并在癌症、细菌感染、心血管疾病、自身免疫性疾病等方面均具有极大的应用潜力。

表1 红细胞膜包被纳米载体临床应用研究
4 结语
红细胞作为新型药物递送载体具有生物相容性好、免疫原性低、循环时间长等特性,在药物递送方面有着较为广阔的发展前景。将红细胞与纳米载体相结合可以克服纳米载体在体内被RES系统迅速清除的局限性,在延长药物在体内的循环时间、提高药物稳定性与靶向性等方面与其他传统药物载体相比具有明显优势。但也存在若干不足,如红细胞包埋纳米载体仅用于包载粒径较小的磁性纳米粒或其他无机纳米载体,且需要穿透红细胞膜,容易导致细胞破裂,对红细胞的损伤较大。将纳米载体通过共价或配体-受体介导结合到红细胞表面相对于包埋对红细胞的损伤较小,而直接与红细胞结合的方法仍可能导致红细胞膜受损,从而使递药系统在体内快速清除。纳米载体在红细胞上的非特异性物理吸附被是对红细胞生物活性影响最小的表面结合方法,并且在纳米载体从红细胞表面解吸后对红细胞结构的影响也很小,是一种极具有应用前景的新型靶向药物递送系统。红细胞膜包被纳米载体能够实现药物的靶向递送与刺激响应性释放,然而在红细胞膜提取或与纳米颗粒融合过程中可能发生膜锚定片段的构象变化,导致其免疫原性增强激活体内免疫应答。红细胞-纳米载体递药系统仍处于初步研究阶段,仍存在一些问题有待深入研究:①红细胞来源于生物体,在提取、载药和储存过程中如何控制污染,减少对红细胞的损伤仍是亟待解决的问题;②目前研究仍局限于小动物水平,还有待于大动物的实验对其体内性能进行验证;③在人体临床应用时,需系统分析红细胞表型,选择与机体匹配的红细胞进行制备。随着对红细胞-纳米载体递药系统研究的不断深入,这种新型递药系统的临床应用前景会更加广阔。

