红景天苷对海马神经元自然衰老的影响和机制研究
徐新颖 朱 琳 刘姿杉 倪钦帅 于竹芹,3*
(1.济南市济阳区中医院ICU科,山东 济南,251400;2.青岛大学医学部中西医结合中心,山东 青岛,266021;3.青岛市第六人民医院内科,山东 青岛,266023)
机体发生衰老时会增加神经退行性疾病等多种疾病的发病风险[1]。海马神经元衰老与多种神经退行性疾病的发生密切相关[2]。研究表明,端粒酶缺乏的小鼠更容易发生衰老并伴随神经退行性变,出现海马神经元损伤,而重新提高端粒酶活性可以改善年龄相关的神经元损伤并延缓衰老[3]。《灵枢·天年》曰:人之寿,百岁而死。说明人若尽其天年可活到百岁,若能采取有效措施,可以延缓衰老的[4]。《本草纲目》中记载,红景天(rhodiolarosea)为“本经上品,祛邪恶气,补诸不足”,具有补气清肺、益智养心、理气养血等功效[5]。临床研究发现,红景天可以抗氧化、抗疲劳、抗肿瘤、抗衰老和肝保护等作用[6-7]。现代药理研究表明,红景天的主要活性成分红景天苷(salidroside,Sal)对多种神经退行性疾病具有神经保护作用[8-9],但其对神经元衰老的影响及作用机制尚不十分明确。本研究通过分离和培养大鼠原代海马神经元,使其自然衰老,旨在探讨红景天苷对海马神经元衰老的作用和作用机制,为临床应用提供新的思路[10],现报道如下。
1 材料与方法
1.1 主要试剂和仪器
红景天苷(生产企业:上海阿拉丁生化科技公司,Sal,S101157,C14H20O7,300.31 Da);环黄芪醇(生产企业:上海麦克林生化科技公司,CAG,C864810,C30H50O5,490.71 Da);胰蛋白酶(25200056)、胎牛血清(FBS,10099141)、DMEM /F12培养基(11320082)、Neurobasal-A培养基(10888022)(生产企业:美国Gibco公司);细胞计数试剂盒(生产企业:北京索莱宝科技公司,CCK-8,CA1210);衰SA-β-gal染色试剂盒(生产企业:上海碧云天生物技术公司,C0602);兔抗鼠TERT抗体(生产企业:Novus Biologicals公司,NB100-317);端粒酶PCR-ELISA试剂盒(生产企业:德国罗氏公司,1185666910);荧光显微镜(ECLIPSE Ti2)、PCR仪(T100TM)(生产企业:Bio-Rad公司);酶标仪(生产企业:Bio-Tek公司,SYNERGYH1)。
1.2 原代海马神经元的培养
取新生24 h内SD大鼠,用75%酒精浸泡消毒5 min,断头取脑,无菌操作,分离海马,剪碎,加0.125%胰蛋白酶,37 ℃消化15 min。加含血清培养基,机械轻柔吹打数次终止消化,用200目筛网过滤到离心管,1 000 rpm离心5 min,弃上清。用DMEM/F12培养基将沉淀细胞悬浮,接种到多聚赖氨酸包被培养板,5% CO2,37 ℃培养箱培养4 h后,更换为Neurobasal-A培养基,每隔2天半量换液。光镜(200倍)观察神经元生长状态。随机选取5个视野,计算平均细胞数。实验过程严格遵守动物伦理学要求(QDYXBWZLL20230606)。
1.3 原代海马神经元纯度鉴定
取培养7 d的原代海马神经元,用4%多聚甲醛室温固定20 min,PBS洗5 min×3次。加0.5% Triton X-100室温透化10 min,PBS洗5 min×3次。用10%正常山羊血清室温封闭30 min,然后加MAP2抗体(1:150),4 ℃孵育过夜,PBS洗5 min×3次,避光,加Alexa Fluor 488山羊抗兔二抗(1:200)室温避光孵育1 h,PBS洗5 min×3次,加DAPI染液,室温避光染色10 min,PBS洗5 min×3次。荧光显微镜(200倍)观察DAPI和MAP2表达情况,随机选取5个视野,计数绿色荧光细胞数,根据荧光细胞数目和细胞总数的比值计算神经元纯度。
1.4 原代海马神经元分组
原代海马神经元培养至第7天为ST培养(年轻神经元),第17天为LT培养(老年神经元)。将神经元分为ST组、LT组、红景天苷低浓度(Sal-L)、高浓度(Sal-H)组、环黄芪醇(CAG)组。神经元培养至第14天,分别用红景天苷(10 µM、20 µM)和CAG(5 µM)处理72 h。第17天收集各组神经元。显微镜(200倍)观察神经元生长情况。
1.5 细胞活力测定
原代海马神经元接种于96孔板,至第14天,加红景天苷(10 µM、20 µM)和CAG(5 µM)继续培养至第23天,每隔2天使用CCK-8法检测细胞活力。每孔加10 μL CCK-8溶液,37 ℃孵育3 h。酶标仪在450 nm处测定吸光度。
1.6 SA-β-gal染色
原代海马神经元接种于6孔板,按分组处理后SA-βgal染色。每孔加1 mL染色固定液,室温固定15 min,PBS洗3 min×3次,随后每孔加1 mL染色工作液,封口膜封住6孔板以防蒸发,37℃(无CO2)孵育过夜。光镜观察记录SA-β-gal阳性细胞(蓝染)数,计算阳性细胞率(阳性细胞数目/总细胞数目)。
1.7 流式细胞术
海马原代神经元经分组处理,经0.25%胰酶(无EDTA)消化,1 000 rpm、4 ℃离心5 min,弃上清,预冷PBS洗涤细胞2次,1 000 rpm、4 ℃离心5 min,弃上清。将细胞重悬于100 μL预冷Annexin V缓冲液,随后分别加5 μL的 Annexin V-FITC和PI,室温避光反应15 min,加400 μL预冷Annexin V缓冲液重悬细胞,流式细胞仪分析。
1.8 Western Blot分析
原代海马神经元按分组处理后,用RIPA裂解液裂解,12 000 rpm离心5 min,收集上清,使用BCA法检测总蛋白浓度。总蛋白(30 ug)经SDS-PAGE分离后,凝胶湿转到PVDF膜,用5%脱脂奶粉室温封闭2 h,TBST洗5 min×3次。加一抗(TERT 1:500,β-actin 1:15 000),4℃孵育过夜,TBST洗5 min×3次。加羊抗兔二抗(1:15 000)室温孵育1.5 h,TBST洗5 min×3次。随后ECL化学发光显色,凝胶成像系统采集图像,Image J软件分析蛋白条带灰度。目的蛋白与内参β-actin灰度比值为目的蛋白的相对表达量。
1.9 端粒酶活性测定
使用端粒酶PCR-ELISA试剂盒裂解液裂解神经元,取部分裂解产物95℃热灭活作为阴性对照,试剂盒提供的蛋白提取物作为阳性对照。随后加入含有端粒酶底物的反应混合物。将样品转移PCR仪扩增:25 ℃ 30 min,94 ℃ 5 min,94 ℃ 30 s 30个循环,50 ℃ 30 s,72 ℃ 90 s。用杂交缓冲液稀释PCR产物后,加到预涂有地高辛标记(含端粒重复特异性探针)的96孔板。经37 ℃变性杂交2 h,加入抗地高辛过氧化物酶偶联物和TMB底物ELISA测定,测定450 nm处的吸光度。根据阴性对照值,吸光度值大于0.25为端粒酶阳性。
1.10 统计学分析
2 结果
2.1 大鼠原代海马神经元长期培养
培养第7天,神经元胞体饱满,细胞折光性强,神经元突起密集,形成突触连接和神经网络。第11~15天,细胞胞体饱满且折光性更强,神经元突起发达,神经元网络最为密集,细胞数量较第7天无明显变化(P>0.05)。第17~19天,细胞边界不清,部分细胞开始退化,光晕减弱,突起断裂,细胞数量较第15天明显减少(P<0.01)。第21天,神经元退化,胞体萎缩,胞浆内出现颗粒变性,神经元突起断裂,细胞数量较第19天进一步减少(P<0.01)。海马神经元培养第7天,经MAP2免疫荧光鉴定,92%以上为阳性细胞,见图1、2。

图1 原代海马神经元在不同培养时间的形态和数目(n=5,200×)
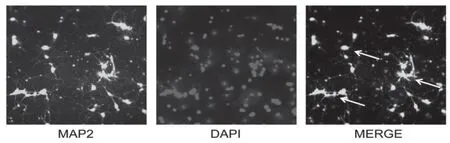
图2 免疫荧光染色鉴定原代海马神经元纯度(n=5,200×)
2.2 红景天苷对神经元存活率的影响
CCK-8结果显示,细胞培养至第15天,加红景天苷和CAG的神经元存活率与LT组相比无明显变化,差异有统计学意义(P>0.05)。至第17天、19天,Sal-L组、Sal-H组和CAG组的神经元存活率较LT组显著增加,差异有统计学意义(P<0.05)。至第21天、23天,Sal-L组、Sal-H组和CAG组神经元存活率较与LT组显著增加,差异有统计学意义(P<0.05),见图3。

图3 红景天苷对原代海马神经元的形态和细胞活性影响(n=5,200×)
2.3 红景天苷对海马神经元SA-β-gal表达的影响
SA-β-gal染色结果显示,LT组SA-β-gal阳性(蓝染)细胞率相较ST组明显增加,差异有统计学意义(P<0.01),说明随着海马神经元的长时间培养,细胞逐渐衰老。而与LT组相比,Sal-L组、Sal-H组和CAG组的SA-β-gal阳性细胞率明显降低,差异有统计学意义(P<0.05),见图4。
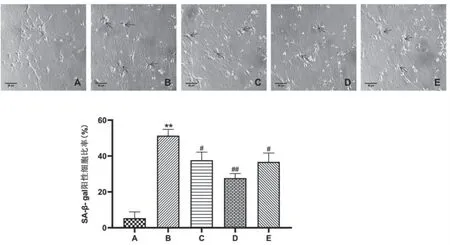
图4 红 景天苷对自然衰老神经元SA-β-gal表达的影响(n=5,200×)
2.4 红景天苷对神经元凋亡率的影响
流式细胞术结果显示,LT组凋亡细胞比率较与ST组明显增加(P<0.01)。给予红景天苷和环黄芪醇处理后,凋亡细胞数量逐渐减少,Sal-L、Sal-H和CAG组的凋亡细胞比率较LT组均显著降低,差异有统计学意义(P<0.05),见图5。
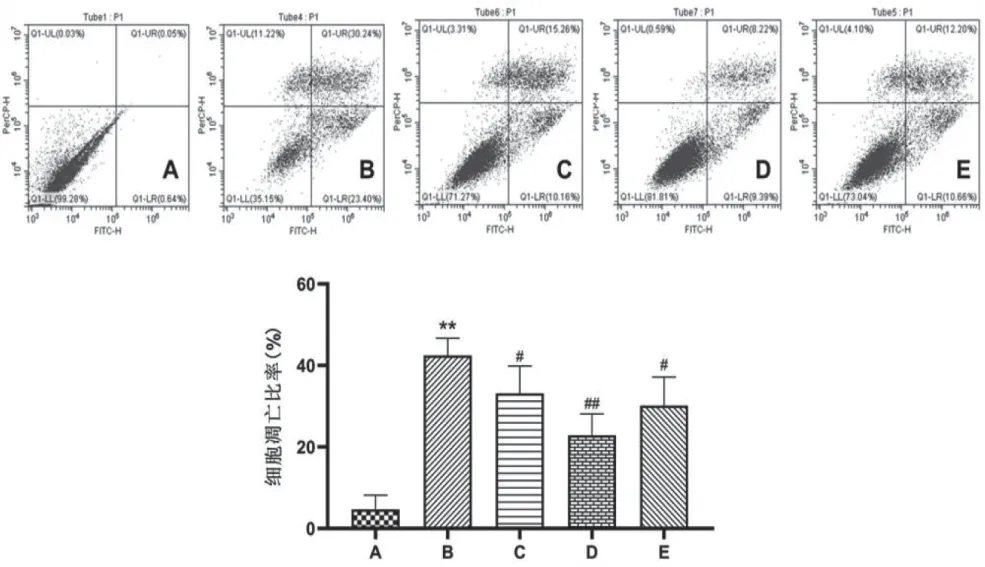
图5 红景天苷对自然衰老的海马神经元凋亡的影响(n=3,200×)
2.5 红景天苷对神经元端粒酶活性和TERT表达的影响
PCR-ELISA法显示,LT组海马神经元的端粒酶活性较ST组显著降低(P<0.0 1);经红景天苷和环黄芪醇处理后,神经元的端粒酶活性显著提高,差异有统计学意义(P<0.05)。Western blot检测结果表明,LT组神经元TERT表达较ST组显著下降(P<0.01),经红景天苷和环黄芪醇处理的神经元TERT表达较LT组显著升高,差异有统计学意义(P<0.05),见图6、表1。
表1 各组海马神经元端粒酶相对活性和TERT表达 ()
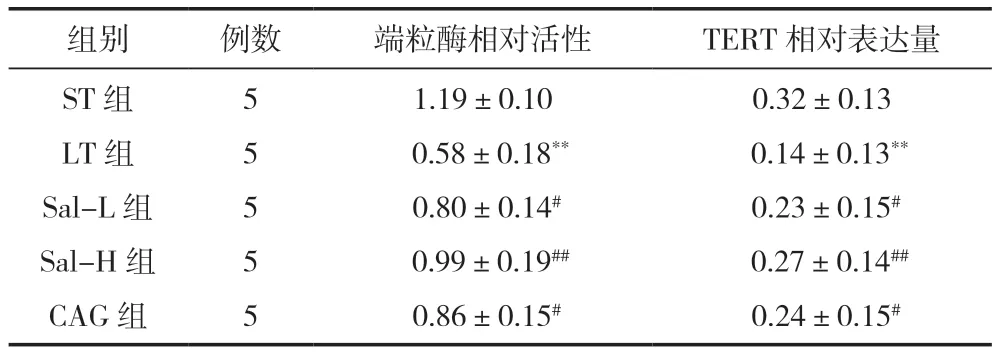
表1 各组海马神经元端粒酶相对活性和TERT表达 ()
注:**P<0.01 vs LT组;# P<0.01、##P<0.01 vs ST组。
0.32±0.13 0.14±0.13**0.23±0.15#0.27±0.14##0.24±0.15#组别例数端粒酶相对活性TERT相对表达量ST组LT组Sal-L组Sal-H组CAG组5 5 5 5 5 1.19±0.10 0.58±0.18**0.80±0.14#0.99±0.19##0.86±0.15#
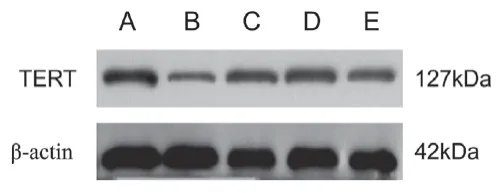
图6 各组小鼠海马组织中TER的蛋白表达
3 讨论
传统中药用药历史久远,《四部医典》中便言其“性平、味涩、善润肺、能补肾、理气养血”,《神农本草经》称服之可“轻身益气,不老延年”,具有益气活血、通脉平喘的功效。近年研究发现,红景天具有抗疲劳、抗炎、抗氧化、抗衰老等作用,其主要活性成分红景天苷可以有效缓解多种神经退行性疾病,对神经元具有保护作用,但其作用机制尚不十分明确[11-15]。
本实验长期培养大鼠原代海马神经元作为自然衰老模型,可以模拟在体海马神经元衰老的一些改变[16]。结果表明,培养第7~15天,神经元胞体饱满,具有典型的神经元结构和突起,神经元数目无明显改变。随着海马神经元培养时间的增加,大多数神经元开始退化,细胞胞体萎缩,神经元突起断裂,神经元数目明显减少,可见大量细胞碎片,与既往研究相一致。Mao等[17]研究发现,红景天苷可以降低人胚肺二倍体细胞(2BS)的SA-β-gal的表达,延缓2BS细胞的复制性衰老。Zhang等[18]研究发现,红景天苷可以剂量依赖地抑制MPP(+)诱导的PC12细胞凋亡。本实验研究结果显示,与短期培养的年轻神经元相比,长期培养的海马神经元细胞存活率明显下降,而SA-β-gal的阳性表达率明显增加,并且海马神经元凋亡率增加,说明长期培养的神经元衰老比例明显增多。给予不同浓度的红景天苷处理后,细胞存活率显著提高,SA-β-gal的阳性表达率和神经元凋亡率也明显下降,提示红景天苷可以延缓原代海马神经元的自然衰老,与抗衰老药物环黄芪醇的作用效果一致[19]。
染色体末端的端粒缩短可以激活DNA损伤反应,引发细胞周期停滞,加速细胞衰老和死亡[20]。端粒长度主要由端粒酶维持,端粒酶可以合成并添加端粒重复序列至染色体末端,以维持染色体末端的端粒长度, 从而防止细胞衰老。 端粒酶逆转录酶(TERT)是具有逆转录酶活性的催化亚基,也是端粒酶起作用的关键结构和主要调控亚单位。有研究发现,TERT基因敲除小鼠的海马组织中缺乏端粒酶,不仅导致海马神经元退化,组织局部功能丧失,还会产生衰老相关疾病,而端粒酶再激活可以逆转神经元退化,说明端粒在大脑衰老的过程中具有重要作用[21-22]。本研究证实,长期培养的海马神经元端粒酶活性明显低于短期培养的神经元,给予红景天苷处理可以有效减少端粒酶活性的下降,其作用效果与环黄芪醇的作用效果相似。说明红景天苷可以有效提高自然衰老的原代海马神经元的端粒酶活性。
综上所述,红景天苷可能通过降低衰老海马神经元的SA-β-gal表达和神经元凋亡,提高衰老海马神经元的端粒酶活性,从而延缓海马神经元自然衰老,提高原代海马神经元存活率。

