伴MELF生长方式的子宫内膜样癌临床病理特征及免疫表型的研究
韩 莉 谢玉汶
(新疆巴州人民医院病理科,新疆 巴州,841000)
子宫内膜样癌在女性生殖系统恶性肿瘤的发病率中长期位居前3,占女性生殖道恶性肿瘤的1/3左右,占女性恶性肿瘤总数的1/10左右[1-2]。尚不明确子宫内膜样癌的具体发病机制,病因包括遗传、环境、激素变化,雌激素的靶器官是子宫内膜,当体内性激素表达发生变化时,可导致子宫内膜样癌的发生[3-4]。低级别的内膜样癌预后总体好于高级别,但也有5.0%~18.0%低级别的子宫内膜样癌复发、转移[5-6]。伴MELF生长方式的子宫内膜样癌为子宫内膜样腺癌的一种浸润方式,表现为微囊性、伸长、碎片状等,多在低级别子宫内膜样癌中出现,患者预后相对比较差[7]。本文具体探讨与分析了伴MELF生长方式的子宫内膜样癌临床病理特征及免疫表型的特征,希望为明确伴MELF生长方式的子宫内膜样癌的发生机制提供参考,也为早期预防子宫内膜样癌发生提供参考,现报道如下。
1 资料与方法
1.1 一般资料
收集2013年9月—2019年1月于新疆巴州人民医院行子宫全切除+双侧附件切除+盆腔淋巴清扫术且随访成功的72例子宫内膜样癌患者作为研究对象。患者自愿参与本次课题研究;本研究得到了新疆巴州人民医院医学伦理委员会批准。
1.2 纳入与排除标准
纳入标准:①病理诊断为子宫内膜样癌(所有切片均经两位高年资病理医师确诊);②患者年龄30~75岁;③病理检查前未接受靶向治疗、放疗、化疗等的患者;④临床与随访资料完整。
排除标准:①合并高危传染性疾病者;②合并有凝血功能障碍的患者;③合并其他部位肿瘤者;④调查期间死亡者;⑤病理获取标本不合格者;⑥在检查过程中依从性不佳的患者;⑦妊娠与哺乳期妇女;⑧合并有先天性免疫功能障碍的患者;⑨合并有心脏、肝脏、肾脏异常的患者。
1.3 免疫组化检测
收集所有患者的病理组织标本,制成标准化的病理切片,免疫组织化学染色采用罗氏全自动免疫组织化学仪(Ventana Bench Mark XT),抗体包括孕激素受体(PR)、雌激素受体(ER)、P16、细胞角蛋白(cytokeratin,CK)、Ki-67等。
1.4 观察指标
(1)结果判读。阳性表达部位出现棕黄色颗粒为阳性表达,其中ER、PR、Ki-67定位于细胞核,CK定位于细胞质。(2)调查与记录所有患者的一般资料,包括性别、年龄、绝经状态等。同时调查与记录所有患者的病理特征,包括病理分级、淋巴脉管间质浸润、淋巴结转移等。(3)所有患者都进行随访,调查与记录患者的预后情况,包括有无出现肿瘤转移与肿瘤复发等。
1.5 统计学分析
采用SPSS 24.0分析数据,计量资料如受教育年限符合正态分布,以()表示,比较采用t检验;计数资料如免疫组化指标阳性率用[n(%)]表示,比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 伴MELF生长方式的子宫内膜样癌发生情况
在72例患者中,病理诊断为不伴MELF生长方式的子宫内膜样癌(不伴MELF浸润组)占83.3%(60/72);伴MELF生长方式的子宫内膜样癌(伴MELF浸润组)占16.7%(12/72)。
2.2 两组一般资料比较
在72例患者中,伴MELF浸润组的身体质量指数、受教育年限等与不伴MELF浸润组比较,差异无统计学意义(P>0.05);不伴MELF浸润组的年龄、绝经状态比较,差异有统计学意义(P<0.05),见表1。
表1 两组一般资料比较 [ n(%)/()]

表1 两组一般资料比较 [ n(%)/()]
一般资料不伴MELF浸润组(n=60)伴MELF浸润组(n=12)χ2/tP身体质量指数(kg/m2)20.17±0.6820.26±0.51 0.434 0.666受教育年限(年)15.79±1.1515.59±2.09 0.322 0.753年龄(岁)56.03±2.5867.44±3.5813.067<0.001绝经状态(绝经前/绝经后)29/312/10 4.090 0.043
2.3 两组病理特征比较
在72例患者中,伴MELF浸润组的病理分级、淋巴脉管间质浸润、淋巴结转移等与不伴MELF浸润组比较,差异有统计学意义(P<0.05),见表2。

表2 两组病理特征比较 (%)
2.4 镜下特征
MELF浸润灶位于紧邻肿瘤主体的组织或深肌层中(以碎片状腺体浸润、微囊型腺体、拉长腺体浸润为特点)。出现大量以中性粒细胞为主的炎症细胞,伴随有纤维黏液样基质反应(详细情况见图1),腺腔内可见脱落的上皮细胞,呈碎片状,伴随有胞质丰富(详细情况见图2),癌细胞排列成细长或者破碎成小簇状分布(详细情况见图3)。
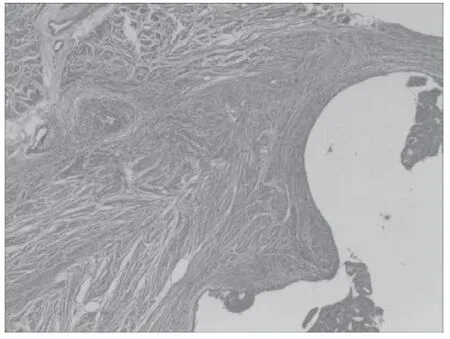
图1 40倍 MELF浸润灶远离肿瘤主体
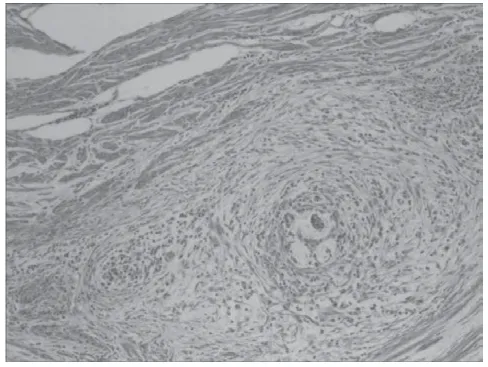
图2 100倍 碎片状腺体

图3 400倍 纤维黏液样基质反应
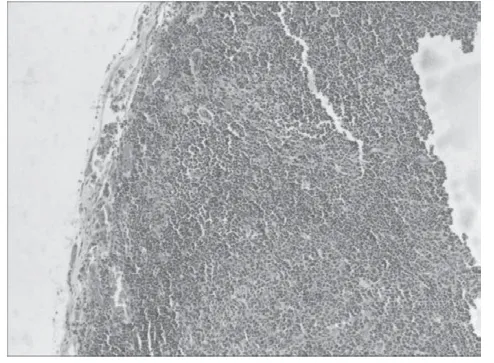
图4 100倍 淋巴结转移灶不明显
2.5 两组免疫组化表达阳性率比较
伴MELF浸润组中,ER(详细情况见图5)、PR、Ki-67、P16(详细情况见图6)阳性表达率分别为8.33%(1/12)、16.67%(2/12)、91.67%(11/12)、100.00%(12/12);CK呈弥漫性棕黄色强阳性表达(见图7),阳性表达率为100.00%(12/12)。
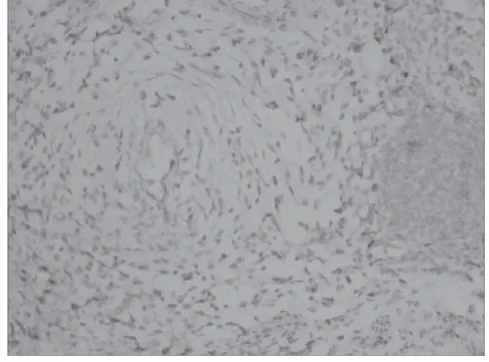
图5 ER阴性 400倍
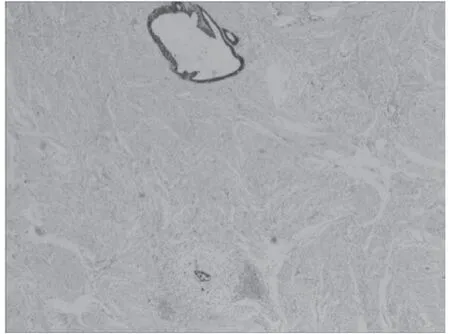
图6 P16阳性 40倍
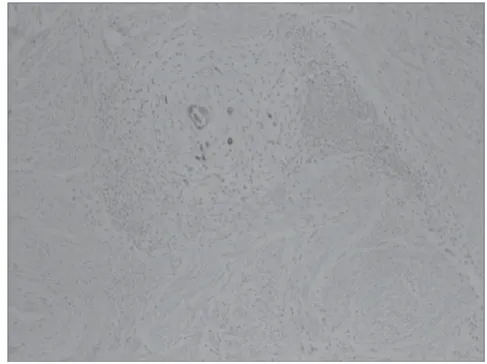
图7 CK阳性 100倍
不伴MELF浸润组中,ER、PR、Ki-67、P16、CK呈棕黄色强阳性表达,阳性表达率均为100.00%(60/60)。
在淋巴脉管间质浸润和淋巴结转移(详细情况见图8)组织中,CK也均呈棕黄色强阳性表达,阳性表达率均为100.00%,详细数据见表3。

图8 淋巴结中CK阳性 100倍
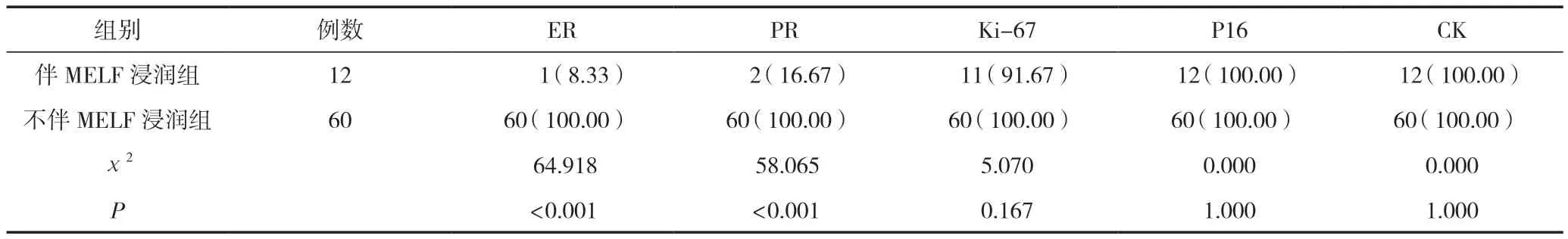
表3 两组免疫组化表达阳性率比较 [n(%)]
2.6 预后比较
对所有患者均进行随访,随访时间为9~60个月,平均随访时间为(31.40±4.02)个月,患者都生存且不带瘤,随访期内患者都无出现肿瘤转移与肿瘤复发情况。
3 讨论
伴MELF生长方式的子宫内膜样癌多出现于低级别子宫内膜样癌中,预后相对较差[8]。MELF这种浸润模式通常伴随纤维黏液样的间质反应及中性粒细胞浸润、嗜酸性粒细胞浸润等,癌成分中包含单个或成簇的肿瘤细胞,这些细胞常胞质丰富或具有嗜酸性[9-10]。本研究结果显示,在72例患者中,病理诊断为伴MELF生长方式的子宫内膜样癌12例,占16.7%(12/72);伴MELF浸润组的身体质量指数、受教育年限等与不伴MELF浸润组比较,差异无统计学意义(P>0.05),不伴MELF浸润组的年龄、绝经状态比较,差异有统计学意义(P<0.05),表明伴MELF生长方式的子宫内膜样癌占比较高,但是通过临床一般资料比较难以诊断鉴别。
子宫内膜癌容易发生淋巴结转移,低级别患者的淋巴结转移发生率较低,为5.0%~18.0%,而伴MELF生长方式患者盆腔淋巴结转移的发生率平均为24.2%[11]。淋巴脉管间隙浸润是经过组织学确认,两层血管内皮组织之间出现恶性细胞。原发癌灶形成后,肿瘤的脉管随之生成,脱落的肿瘤细胞进入脉管系统形成癌栓,随体循环与血液循环等播散至全身其他器官。淋巴脉管间隙浸润是影响子宫内膜癌患者预后的重要因素之一,存在MELF浸润模式的患者淋巴脉管间隙浸润的发生率较高[12]。有研究发现,伴MELF生长方式患者淋巴脉管间隙浸润的发生率为97.4%,不伴MELF生长方式为5.3%,可能的原因是MELF浸润多发生于深肌层,其中丰富的淋巴管及血管使之更易发生淋巴脉管间隙浸润[13-14]。本研究结果显示,在72例患者中,伴MELF浸润组的病理分级、淋巴脉管间质浸润、淋巴结转移等与不伴MELF浸润组比较,差异有统计学意义(P<0.05)。特别是在无MELF浸润的子宫内膜样腺癌中,淋巴结转移灶多呈现癌巢结构;在伴有MELF浸润的子宫内膜样腺癌中,淋巴结转移灶可出现于淋巴滤泡内,多呈为孤立细胞结果,容易与组织细胞混淆[15]。有研究显示,MELF浸润腺体经常浸润在子宫深肌层,其镜下形态与淋巴管及血管类似,易与淋巴管及血管异常形成的腔隙难以鉴别,容易出现漏诊情况[16-17]。
随着医学的发展,MELF浸润模式分析进展比较大,但是关于其浸润模式的生物学机制与信号传导途经还不明确。不过MELF浸润模式与免疫表型特征有相关性,比如MELF浸润模式多伴随有E-cadherin、雌孕激素受体、Ki-67表达缺失,而fascin、CK7、CKl9和P16表达上调,认为伴MELF生长方式可能代表了类似于上皮一间质转化(EMT)的活化模式[18]。本研究结果显示,伴MELF浸润组中,ER、PR、Ki-67、P16、CK阳性表达率分别为8.33%、16.67%、91.67%、100.00%、100.00%。伴MELF浸润组中,ER、PR、Ki-67、P16、CK呈棕黄色强阳性表达,阳性表达率均为100.00%。对所有患者均进行随访,随访时间为9~60个月,平均随访时间为(31.40±4.02)个月,患者都生存且不带瘤,随访期内患者都无出现肿瘤转移与肿瘤复发情况,可能与数量少、随访时间短有关。当前有研究发现,MELF浸润中P16阳性时,伴随有Ki-67阴性,可使得肿瘤细胞的生长发生阻滞,但是不影响患者的总生存率和无病生存率[19-20]。由于本次课题研究下拨的经费比较少,本次研究调查人数过少,分析指标比较少,也没有纳入健康人群与良性疾病人群进行比较分析,观察也有待延长,后续研究中将深入探讨。
综上所述,MELF浸润在子宫内膜样癌中比较常见,多伴随有淋巴脉管间质浸润、淋巴结转移,ER与PR表达阳性率显著降低,所以应该提高对伴MELF生长方式子宫内膜样腺癌浸润腺体的认识,工作中应仔细辨别是否存在MELF浸润,减少漏诊才能正确评估浸润深度及淋巴结转移情况。

