黄芪多糖调节HMGB1-RAGE信号通路对自身免疫性心肌炎大鼠心肌损伤的影响*
郑 俏,狄 岩,岳思恩,张雯雯
(北京中医药大学东直门医院,北京 100700)
心肌炎是一种心肌炎症,可由自身免疫性疾病、感染和心脏毒性药物诱发,往往伴随着快速进行性心律失常、心力衰竭及心脏性猝死,是年轻患者因心肌病导致死亡的主要原因[1]。据统计约1/3的自身免疫性心肌炎(experimental autoimmune myocarditis,EAM)病例最终可导致心力衰竭,但目前尚未研究出有效的治疗方法,因此寻找新的有效治疗药物势在必行[2]。黄芪多糖(astragalus polysaccharide,AP)是从中药黄芪中提取的有效成分,具有免疫调节、抗炎、促增殖等作用[3]。在病毒性心肌炎研究中,AP可通过抑制多种病理条件下炎症基因的表达改善小鼠心肌损伤[4]。据报道,高迁移率族蛋白Box-1(high mobility group protein,HMGB1)是炎症过程的重要细胞外介质,晚期糖基化终产物受体(receptor for advanced glycation endproducts,RAGE)是已知的HMGB1受体。两者结合可促进促炎性细胞因子的释放,参与炎症性疾病的发展[5],包括心肌炎[6]。本研究旨在探讨AP对EAM心肌损伤的影响及相关机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 50只SPF级SD大鼠,雄性,7周龄,250~270 g,购自北京华阜康生物科技股份有限公司,生产许可证号为SCXK(京)2019-0008,实验动物合格证号:SYXK(京)2020-0013。将大鼠置于动物房中,控制条件为(25±2)℃,相对湿度为(60±5)%,光照-黑暗周期为12/12 h,不禁水食。本研究通过动物伦理委员会批准(批号:2021-00920)。
1.1.2 主要实验试剂 注射用AP(批号:20220318,250 mg/瓶,天津赛诺制药有限公司);弗氏完全佐剂(批号:F-5881)、猪心肌肌球蛋白(批号:M0630)(美国Sigma公司);增强化学发光试剂(批号:P0018A)、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(批号:C0105)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒(批号:P0012S)(上海碧云天生物技术有限公司);重组高迁移率组蛋白B1(recombinant high mobility histone B1,rHMGB1)(批号:JN0259)(北京百奥莱博科技有限公司);白细胞介素-6(interleukin-6,IL-6)ELLSA试剂盒(批号:ml064292)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELLSA试剂盒(批号:ml002859)(上海酶联科技公司);放射免疫沉淀法(radio immunoprecipitation Assay,RIPA)裂解缓冲液(批号:R0020)、Masson′s染色试剂盒(批号:G1340-100)(北京索莱宝科技公司);HMGB1(批号:ab18256)、RAGE抗体(批号:ab216329)(美国Abcam公司)。
1.1.3 主要实验仪器 Sonos 5500超声仪(美国菲利普斯公司);BX51光学显微镜(日本奥林巴斯公司)。
1.2 方法
1.2.1 EAM大鼠模型的制备及干预 参照文献[7]进行制备EAM大鼠模型,首先制备抗原佐剂乳化液:将纯化的猪心肌肌球蛋白溶解在0.01 md/L磷酸缓冲盐溶液中,制备浓度为10 mg/mL的溶液,并用添加10 mg/mL结核分枝杆菌H37RA的等体积弗氏完全佐剂乳化,若猪心肌肌球蛋白完全乳化,则呈乳白色,将其滴入水平面后不会扩散。大鼠适应性喂养1周后,随机分为对照组、EAM组、AP组、rHMGB1组、AP+rHMGB1组,每组10只。对照组大鼠用磷酸缓冲盐溶液乳化的弗氏完全佐剂(0.1 mL)于实验第0天及第7天分别给予左、右后足垫皮下注射,同时每天给予大鼠腹腔及尾部注射生理盐水,连续3周;EAM组大鼠用上述抗原佐剂乳化液(0.1 mL)于实验第0天及第7天分别给予左、右后足垫皮下注射,同时每天给予大鼠腹腔及尾部注射生理盐水,连续3周;AP组大鼠用上述抗原佐剂乳化液(0.1 mL)于实验第0天及第7天分别给予左、右后足垫皮下注射,同时每天给予大鼠腹腔注射30 g/kg AP,并进行尾部注射生理盐水,连续3周[8];rHMGB1组大鼠用上述抗原佐剂乳化液(0.1 mL)于实验第0天及第7天分别给予左、右后足垫皮下注射,同时每天给予大鼠尾部注射rHMGB1,8 μg/kg,并进行腹腔注射生理盐水,连续3周[9];AP+rHMGB1组大鼠用上述抗原佐剂乳化液(0.1 mL)于实验第0天及第7天分别给予左、右后足垫皮下注射,同时每天给予大鼠尾部注射rHMGB1,8 μg/kg,并进行腹腔注射AP,30 g/kg,连续3周。
1.2.2 心肌功能检测 麻醉各组大鼠,将导管尖端通过右颈动脉引入左心室,使用Sonos 5500超声仪检测心率(heart rate,HR)、左心室射血分数(left ventricular ejection fraction,LVEF)和舒张末期内径(end-diastolic diameter,LVEDs)。
1.2.3 炎症因子水平检测 从大鼠股动脉采集血液并制备血清,按照ELISA试剂盒测量炎症因子(TNF-α、IL-6)水平。
1.2.4 心肌组织病理学检测 分离各组大鼠心脏,将左半部分心脏固定在4%中性多聚甲醛中,在逐渐增加的乙醇浓度(70%、96%和100%)中脱水,在二甲苯中清洗,浸入石蜡中,制备5 μm厚的连续切片,然后经HE染色,光学显微镜下观察组织变化,并对病理切片进行评分[10]:4分,切片病变区域≥50%横切面;3分,切片病变区域≥10%且<50%;2分,切片病变区域≥10%且<10%;0分,心肌组织正常。
1.2.5 心肌组织纤维化检测 取“1.2.4中”制备的组织切片,按照Masson′s试剂盒要求进行染色,随机选取5个视野于光学显微镜观察心肌组织纤维化。
1.2.6 Western blotting检测HMGB1、RAGE蛋白表达 使用放射免疫沉淀试验裂解缓冲液提取右半球部分心脏组织中总蛋白质,利用试剂盒对蛋白进行定量,使总蛋白通过煮沸变性,通过10% SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE)分离蛋白质并转移到膜上,在室温下封闭1h,将膜与以下一抗一起温育:HMGB1、RAGE(1:1 000),并在室温下加入山羊抗兔IgG或山羊抗鼠(1:2 000),持续孵育2 h,随后使用增强的化学发光试剂显色,使用ImageQuant LAS 4000检测化学发光发射的信号,并用ImageJ软件定量分析,结果以β-肌动蛋白(β-actin)为内部标准。
1.2.7 实时荧光定量PCR(qRT-PCR)检测心肌组织中HMGB1 mRNA、RAGE mRNA表达 将部分右半球心脏快速冷冻并储存在-80 ℃,将组织在总RNA抽提试剂(Trizol)中匀浆,用苯酚-氯仿提取3次,并将总RNA溶解在10 μL无RNA酶的水中,利用逆转录试剂盒制备cDNA。使用SYBR Green Master Mix进行实时qRT-PCR反应,结果以β-actin为内部参考并通过2-ΔΔCT法分析HMGB1 mRNA、RAGE mRNA表达。引物序列如下:β-actin上游引物为5'-TGACGTGGACATCCGCAAAG-3',下游引物为5'-CTGGAAG GTGGACAGCGAGG-3';HMGB-1上游引物为5'-GCAGATGACAAGCAGCCTTA-3',下游引物为5'-TTTGCTGCA TCAGGCTTTCC-3';RAGE 上游引物为5'-GACTCTTAGCTGGCACTTGGAT-3',下游引物为5'-GGACTTC ACAGGTCAGGG TTAC-3'。
1.3 统计学方法 采用SPSS 27.0软件分析实验数据,计量资料以“均数±标准差”(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 AP对各组大鼠心功能指标的影响 与对照组比较,EAM组HR、LVEDs显著增加,LVEF显著下降(P<0.05);与EAM组比较,AP组HR、LVEDs显著降低,LVEF显著增加(P<0.05),但rHMGB1组HR、LVEDs显著增加,LVEF显著下降(P<0.05);与AP组比较,AP+rHMGB1组HR、LVEDs显著增加,LVEF显著下降(P<0.05);与rHMGB1组比较,AP+rHMGB1组HR、LVEDs显著降低,LVEF显著增加(P<0.05),提示AP可改善EAM大鼠心功能指标。(见表1)
表1 各组大鼠HR、LVEF 和LVEDd 比较 (±s)

表1 各组大鼠HR、LVEF 和LVEDd 比较 (±s)
注:与对照组比较,aP<0.05;与EAM组比较,bP<0.05;与AP组比较,cP<0.05;与rHMGB1组比较,dP<0.05。
?
2.2 AP对各组大鼠血清炎症因子的影响 与对照组比较,EAM组TNF-α、IL-6水平显著增加(P<0.05);与EAM组比较,AP组TNF-α、IL-6水平显著降低(P<0.05),但rHMGB1组TNF-α、IL-6水平显著增加(P<0.05);与AP组比较,AP+rHMGB1组TNF-α、IL-6水平显著增加(P<0.05);与rHMGB1组比较,AP+rHMGB1组TNF-α、IL-6水平显著降低(P<0.05),提示AP可抑制EAM大鼠炎症反应的发展。(见表2)
表2 各组大鼠血清中TNF-α、IL-6 水平比较(±s,pg/mL)
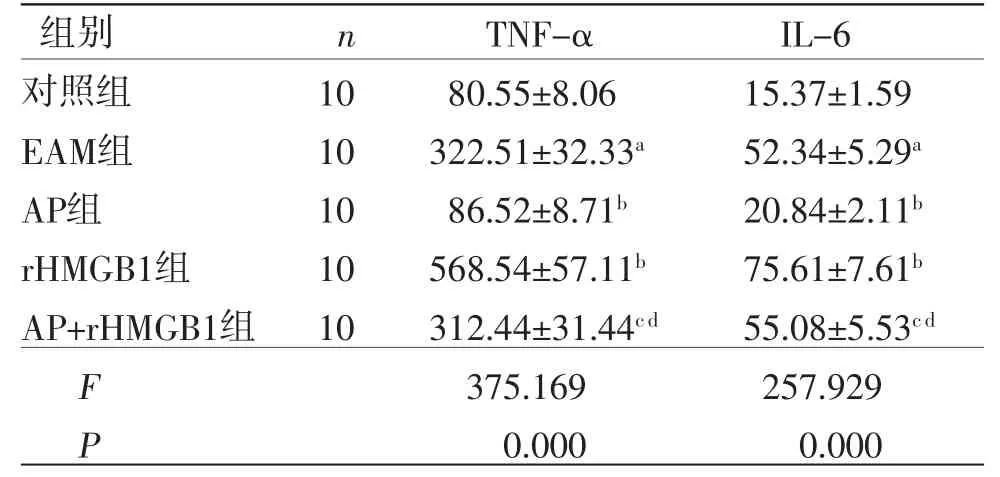
表2 各组大鼠血清中TNF-α、IL-6 水平比较(±s,pg/mL)
注:与对照组比较,aP<0.05;与EAM组比较,bP<0.05;与AP组比较,cP<0.05;与rHMGB1组比较,dP<0.05。
?
2.3 AP对各组大鼠心肌组织病理学的影响 对照组心肌结构完整,炎症细胞浸润较少,但EAM组心肌结构紊乱,炎症细胞浸润较为严重;AP干预后,炎症细胞浸润等病理损伤明显减少,rHMGB1干预后,病理损伤较EAM组进一步加重;但AP与rHMGB1联合干预,病理损伤较AP干预加重,但较rHMGB1干预减轻。(见图1)与对照组比较,EAM组病理评分显著增加(P<0.05);与EAM组比较,AP组病理评分显著降低(P<0.05),但rHMGB1组病理评分显著增加(P<0.05);与AP组比较,AP+rHMGB1组病理评分显著增加(P<0.05);与rHMGB1组比较,AP+rHMGB1组病理评分显著降低(P<0.05),提示AP可改善EAM大鼠心肌组织病理损伤。(见表3)

图1 HE 检测心肌组织病理学变化 (×200)
表3 各组大鼠病理评分比较 (±s,分)
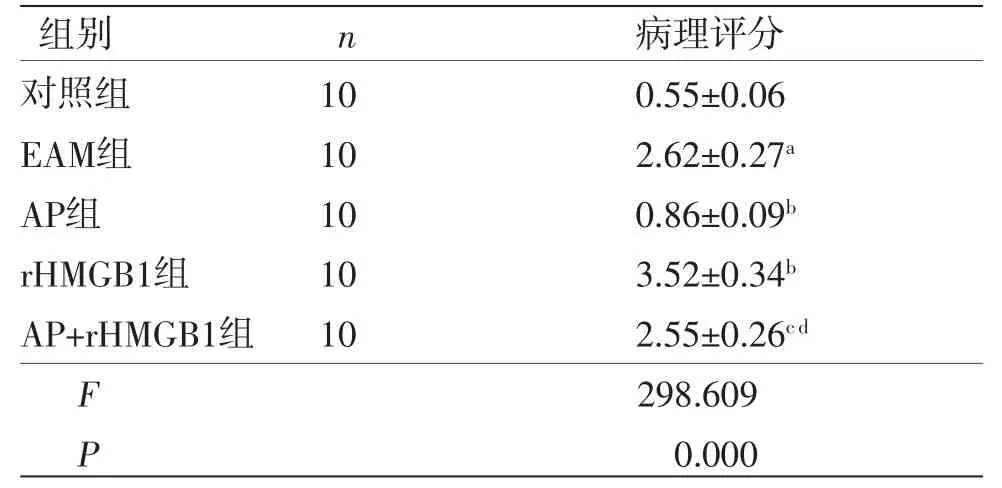
表3 各组大鼠病理评分比较 (±s,分)
注:与对照组比较,aP<0.05;与EAM组比较,bP<0.05;与AP组比较,cP<0.05;与rHMGB1组比较,dP<0.05。
?
2.4 AP对各组大鼠心肌纤维化的影响 对照组无显著纤维化变性;EAM组纤维化变性较为明显,有大量胶原纤维显现;AP组心肌纤维化得到改善,但rHMGB1组纤维化变性较EAM组严重,AP+rHMGB1组纤维化程度与EAM组无明显差异,提示AP可改善EAM大鼠心肌纤维化。(见图2)

图2 Masson′s 染色检测心肌组织纤维化 (×200)
2.5 AP对大鼠HMGB1、RAGE蛋白表达的影响 与对照组比较,EAM组HMGB1、RAGE蛋白表达显著增加(P<0.05);与EAM组比较,AP组HMGB1、RAGE蛋白表达显著降低(P<0.05),但rHMGB1组HMGB1、RAGE蛋白表达显著增加(P<0.05);与AP组比较,AP+rHMGB1组HMGB1、RAGE蛋白表达显著增加(P<0.05);与rHMGB1组比较,AP+rHMGB1组HMGB1、RAGE蛋白表达显著降低(P<0.05),提示AP通过抑制HMGB1、RAGE蛋白表达对EAM大鼠发挥保护作用。(见图3、表4)
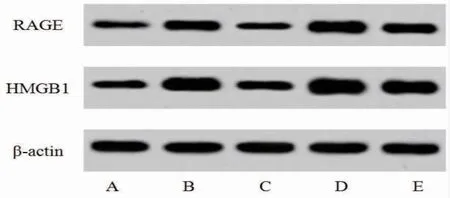
图3 心肌组织HMGB1、RAGE 蛋白表达Western blotting 图
表4 各组大鼠心肌组织中HMGB1、RAGE 蛋白表达的比较(±s)
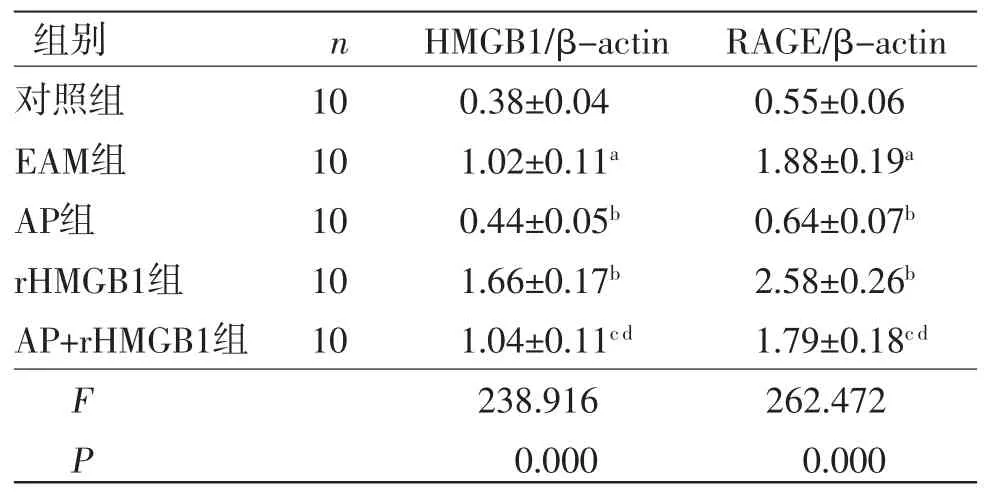
表4 各组大鼠心肌组织中HMGB1、RAGE 蛋白表达的比较(±s)
注:与对照组比较,aP<0.05;与EAM组比较,bP<0.05;与AP组比较,cP<0.05;与rHMGB1组比较,dP<0.05。
?
2.6 AP对大鼠心肌组织HMGB1 mRNA、RAGE mRNA表达的影响 与对照组比较,EAM组HMGB1 mRNA、RAGE mRNA表达显著增加(P<0.05);与EAM组比较,AP组HMGB1 mRNA、RAGE mRNA表达显著降低(P<0.05),但rHMGB1组HMGB1 mRNA、RAGE mRNA表达显著增加(P<0.05);与AP组比较,AP+rHMGB1组HMGB1 mRNA、RAGE mRNA表达显著增加(P<0.05);与rHMGB1 mRNA组比较,AP+rHMGB1组HMGB1 mRNA、RAGE mRNA表达显著降低(P<0.05),提示AP通过抑制HMGB1、RAGE表达对EAM大鼠发挥保护作用。(见表5)
表5 各组心肌组织中HMGB1、RAGE mRNA表达的比较 (±s)
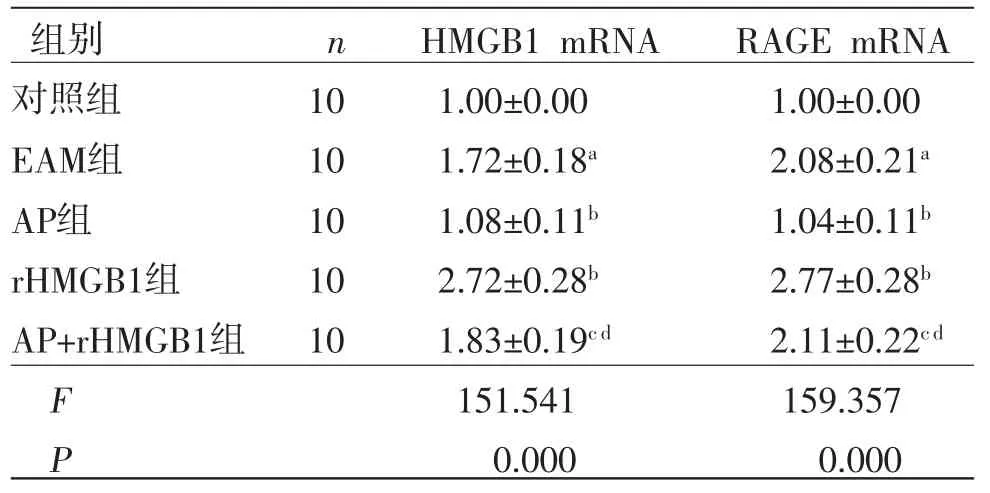
表5 各组心肌组织中HMGB1、RAGE mRNA表达的比较 (±s)
注:与对照组比较,aP<0.05;与EAM组比较,bP<0.05;与AP组比较,cP<0.05;与rHMGB1组比较,dP<0.05。
?
3 讨论
心肌炎是一种与自身免疫发展有关的心肌炎症性疾病,EAM发病病理及病理特征多与扩张型心肌炎、病毒性心肌炎类似,是研究心肌损伤机制的有效动物模型[10]。本研究通过后足垫皮下注射抗原佐剂乳化液方法建立EAM大鼠模型,结果发现大鼠LVEDs、HR明显升高,LVEF值下降,提示大鼠心功能恶化,EAM大鼠模型构建成功[11]。
天然产品由于其安全性、副作用小,在心血管疾病的治疗中越来越受欢迎[12]。AP是黄芪的提取物,具有抗氧化、抗病毒、抗应激、免疫平衡和抗炎等作用[13]。研究证明AP能显著降低糖尿病大鼠的血糖、游离脂肪酸,从而减轻心肌损伤[14]。LIU Y J等[15]研究证明AP可提高心肌抗氧化能力,减缓心肌纤维化发展,有望参与临床治疗扩张型心肌病。结合以往的研究结果,笔者推测AP在心肌炎治疗方面具有很大潜力。EAM属于免疫炎症性疾病,可激活肥大细胞及T细胞等分泌TNF-α、IL-6等炎症因子,引发心肌炎症损伤,造成心肌纤维化,损害心功能[16]。HE及Masson′s染色结果显示,EAM组心肌结构紊乱,炎症细胞浸润及纤维化较为严重。AP可改善EAM大鼠心肌病理损伤及纤维化。同时研究还发现AP可降低TNF-α、IL-6水平,提高心功能指标,提示AP可通过降低炎症反应,抑制EAM心肌病理损伤及纤维化,防止EAM病情加重。
HMGB1是一种进化上保守的染色质结合因子。在创伤或感染刺激时,细胞外环境中就会被动释放HMGB1,向周围细胞发出危险信号,激活细胞免疫功能,并促进组织修复[17]。RAGE是一种具有黏附分子结构特征的跨膜受体,参与由HMGB1介导的多种病理过程,该通路在多种病理条件下表现出有希望的药理学靶点[18]。本研究发现EAM大鼠心肌组织中,HMGB1、RAGE蛋白及mRNA表达显著增加,提示激活HMGB1-RAGE信号通路促进了EAM进展。CHEN Q F等[19]研究证明抑制HMGB1表达可改善冠状动脉微栓塞引发的心功能异常及心肌损伤。在EAM期间[20],阻断RAGE激活可减少炎症反应,改善心脏功能。本研究结果显示,AP干预后,HMGB1、RAGE蛋白及mRNA表达下调,改善了EAM大鼠心肌损伤。AP可能通过抑制HMGB1-RAGE信号通路发挥对EAM大鼠的心肌保护作用。为进一步验证实验推测,本研究以HMGB1激活剂-rHMGB1进行回复验证,结果发现rHMGB1逆转了AP对EAM大鼠的保护作用,表明AP可能通过抑制HMGB1-RAGE信号通路改善EAM大鼠心肌损伤。
综上所述,AP可抑制EAM大鼠炎症反应,改善心肌损伤,可能与抑制HMGB1-RAGE信号通路有关,但由于机制复杂,涉及上下游相关蛋白较多,后续将继续开展相关机制探索。

