基于网络药理学研究玉屏风颗粒调节IgA肾病模型小鼠Th1/Th2平衡的作用机制*
李雅静,杜 宇,白雅雯,王 烁,卜凤跃,孙丽宁,边春艳
(1.内蒙古医科大学中医学院,内蒙古 呼和浩特 010110;2.包头市第八医院,内蒙古 包头 014040;3.包头医学院第一附属医院,内蒙古 包头 014017;4.克什克腾旗蒙医中医医院,内蒙古 赤峰 025378)
IgA肾病(IgA nephropathy,IgAN)是最常见的原发性肾小球疾病,低糖基化IgA1沉积于肾小球系膜区为其病理特征,血尿、蛋白尿、高血压等为其主要临床表现。相关统计发现,50%的IgAN患者在20~25年内可进展至终末期肾病(endstage renal disease,ESRD)[1]。IgAN的治疗重点是优化支持治疗,包括严格控制血压、使用最大耐受剂量的肾素-血管紧张素系统抑制剂(renin-angiotensin system inhibitors,RASI)以及生活方式改变等来延缓疾病的进展[2]。
IgAN可归属于中医学“血尿”“水肿”“腰痛”等范畴。病位虽然在肾,但与肺脏关系十分密切。《灵枢·本输》云“肾上连肺”。肺主皮毛,外通玄府,上达咽喉。若肺主气无权,无力抗邪,外邪侵袭,从表入里或由上传下,皆可波及于肾;反之,若肺主气有权,玄府开阖有度,外邪则无从侵袭,故有学者认为治肾病必先求之于肺。玉屏风散是补肺固表、扶正固本的经典方剂。临床研究发现,玉屏风颗粒可提高肾病治疗总有效率和治愈率,减轻激素对人体肾功能的损伤,消退浮肿,改善尿蛋白,防止IgAN患者因外感而加重或复发[3-8]。然而目前其作用机制研究较少,本研究拟通过网络药理学方法预测玉屏风颗粒治疗IgAN的作用机制,并通过动物实验进行验证,阐述其可能的作用机制。
1 材料与方法
1.1 网络药理学
1.1.1 筛查玉屏风颗粒有效成分和作用靶点 活性化合物的筛选条件为口服生物利用度(oral bioavail-ability,OB)≥30%和类药性(drug-likeness,DL)≥0.18。在TCMSP数据库(https://tcmsp-e.com/)[9]中检索中药标准化名称“黄芪、白术、防风”的化学成分。获取标准化名称的有效成分,建立数据库,运用SwissTarget(http://www.swisstargetprediction.ch/)对缺少的靶点化合物进行补充[10]。运用Uniport数据库将其转换为统一的基因名称。
1.1.2 疾病靶点筛选 以“ IgA nephropathy”为关键词,在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org)、TTD(http://db.idrblab.net/ttd/)数据库中,检索IgAN靶点,进行合并去重,获得最终靶点。
1.1.3 构建“活性成分-交集靶点-疾病”网络图 将获得的玉屏风颗粒和IgAN的靶点分别导入Venny 2.1.0在线平台取两者交集靶点,绘制韦恩图。运用Cytoscape3.7.2软件构建“活性成分-交集靶点-疾病”网络关系图。
1.1.4 构建蛋白互作网络图 运用String数据库(https://cn.string-db.org/)[11],构建蛋白互作网络(PPI),通过Cytoscape 3.7.2软件获取核心靶点。
1.1.5 富集分析 运用DAVID数据库(https://david.ncifcrf.gov/)并设置阈值<0.05,进行GO功能和KEGG富集分析,利用微生信网站(http://www.bioinformatics.com.cn/)制作GO和KEGG富集气泡图。
1.2 分子对接 通过PDB数据库(https://www.rcsb.org/)获得核心靶蛋白3D结构PDB格式文件,去除配体和水分子。通过PubChem数据库(http://pubchem.ncbi.nlm.nih.gov)获得玉屏风颗粒主要活性成分3D结构文件,经Auto Dock Tool软件预处理后,运用Auto Dock Vina1.5.6软件进行分子对接。
1.3 动物实验 选取SPF级雄性昆明小鼠60只,体质量20~22 g,购买并饲养于内蒙古医科大学实验动物中心,动物许可证号:SCXK(蒙)2020-0001。饲养环境:室温20~24 ℃,相对湿度40%左右,12 h光照环境。所有小鼠均经尿蛋白试纸测试为阴性,适应性饲养7 d开始造模,动物实验经内蒙古医科大学伦理委员会批准(伦理审批号:YKD2014001)。
1.3.1 药物与试剂 24小时尿蛋白定量(24-hour urine protein,24 h-UTP)试剂盒(批号:CS8480)、血肌酐(serum creatinine,Scr)试剂盒(批号:CR6113)、尿素氮(serum urea nitrogen,SUN)试剂盒(批号:BU8121)均购自北京利德曼生化股份有限公司;脂多糖(批号:L8880)、牛血清白蛋白(批号:A8020)均购自美国sigma公司;苏木素(批号:G1140)、伊红(批号:G1100)、糖原染色液(批号:G1280)均购自北京索莱宝科技有限公司;荧光素标记的兔抗大鼠IgA抗体(批号:SC-373823)购自Santa Cruz Biotechnology;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)试剂盒(批号:JYM0218Mo)、干扰素γ(interferon-gamma,INF-γ)试剂盒(批号:JYM0540Mo)、白细胞介素-2(interleukin-2,IL-2)试剂盒(批号:JYM0010Mo)、白细胞介素-6(interleukin-6,IL-6)试剂盒(批号:JYM0012Mo)、白细胞介素-4(interleukin-4,IL-4)试剂盒(批号:JYM0011Mo)均购自武汉基因美生物科技有限公司。黄芪(批号:22002351)、白术(批号:22042181)、防风(批号:21029071)按比例(3:1:1)购自天津康仁堂药物有限责任公司;福辛普利钠片(国药准字号H19980197)购自中美上海施贵宝制药有限公司。
1.3.2 主要仪器 TBA-40FR全自动生化分析仪(北京利德曼生化股份有限公司);FlexA-200酶标定量测定仪(合肥吉象生物技术有限公司);KS41SF光学显微镜、NIKON ECLIPSE CI正置荧光显微镜(日本尼康)。
1.3.3 造模方法 60只SPF级雄性昆明小鼠,随机分为正常组10只,造模组50只。参照汤颖等[12-14]改进的“口服牛血清白蛋白(BSA)+尾静脉注射脂多糖(LPS)+皮下注射四氯化碳(CCl4)”建立IgAN小鼠实验模型,造模组大鼠采用0.1%BSA酸化水灌胃,剂量为0.4 mL/只,隔日1次;每周1次皮下注射体积分数为25%的CCl4溶液,0.4 mL/只。第6周、第8周尾静脉注射0.05mgLPS。正常组给予等量6 mmol/L酸化水、蓖麻油、生理盐水分别进行灌胃、皮下注射、尾静脉注射,持续到第8周末。8周末随机选取正常组和造模组小鼠各1只进行IgA免疫荧光染色以确定造模是否成功。
1.3.4 分组及给药 将49只造模成功小鼠随机分为模型组(9只)、西药对照组(10只)、玉屏风颗粒高剂量组(10只)、玉屏风颗粒中剂量组(10只)、玉屏风颗粒低剂量组(10只),给药剂量参考玉屏风颗粒及福辛普利钠片使用说明书分别为15 g/d、10 mg/d,按照体表面积换算法计算,玉屏风颗粒高剂量组剂量为78 mg/d,玉屏风颗粒中剂量组剂量为39 mg/d,玉屏风颗粒低剂量组剂量为19.5 mg/d,西药对照组给予福辛普利钠片(0.026 mg/d),模型组及正常组给予4 mL蒸馏水,给药8周。
1.3.5 观察指标
1.3.5.1 一般情况 观察、测量并记录小鼠的一般情况,包括尿量、尿液的颜色及体质量。
1.3.5.2 血液指标 给药结束后,小鼠采用异氟烷吸入性麻醉,沿腹正中线剪开,钝性逐层分离腹主动脉,使用一次性采血针采集小鼠腹主动脉血液,静置2 h,3 500 r/min(离心半径为4 cm),离心10 min,分离血清。ELISA法检测肾功能(24 h-UTP、BUN、Scr),血清中IgA、辅助性T细胞因子1(T helper cell 1,Th1)相关因子TNF-α、INF-γ、IL-2,以及辅助性T细胞因子2(T helper cell 2,Th2)相关因子IL-6、IL-4表达水平。
1.3.5.3 肾组织病理学变化 取肾脏,去除包膜,置于4%多聚甲醛组织液中固定48 h,流水冲洗24 h,常规脱水,石蜡包埋,制作成3 μm厚切片,用于IgA免疫荧光染色、HE染色、糖原染色,分别置于荧光显微镜、光学显微镜下观察肾组织病理学变化,拍照记录。
2 结果
2.1 网络药理学结果
2.1.1 玉屏风颗粒-IgAN交集靶点 通过TCMSP数据库,去重后得到玉屏风颗粒活性成分34个,作用靶点222个。通过GeneCards、OMIM、TTD数据库检索,删除重复后得到疾病靶点1 436个,输入Venny2.1.0在线平台,获得交集靶点102个,绘制韦恩图。(见图1)

图1 韦恩图
2.1.2 “活性成分-交集靶点-疾病”网络模型 使用Cytoscape3.7.2绘制“活性成分-交集靶点-疾病”相互作用网络图,网络中有140个节点,478条边。(见图2)通过拓扑学分析,度值排名靠前10的化合物有槲皮素(quercetin)、山柰酚(kaempferol)、汉黄芩素(wogonin)等。(见表1)通过String数据库构建蛋白互作网络图,使用Cytoscape3.7.2软件,根据度值构建核心靶点网络图,其中平均度值为37.54,最大值为83,最小值为1,大于平均度值靶点有51个,排名靠前的有TNF、IL-6、IL-4、IL-2等。(见图3、表2)

表1 核心化合物

表2 核心靶点
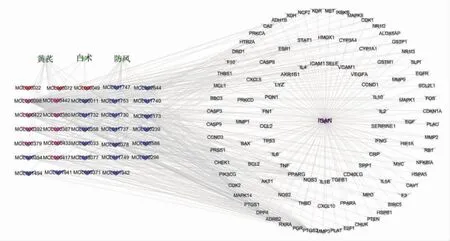
图2 活性成分-交集靶点-疾病网络图
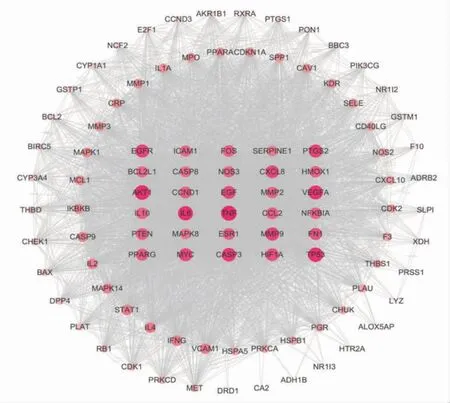
图3 核心靶点网络图
2.1.3 富集分析 通过DAVID数据库对交集靶点进行GO富集分析,以P<0.05为筛选条件,得到生物过程(BP)689条、细胞组分(CC)54条、分子功能(MF)115条,分别选取排名前10的结果绘制GO富集气泡图。(见图4)通过DAVID数据库进行KEGG富集分析,得到157条信号通路,选取最具代表性的前20条通路,作KEGG富集气泡图。(见图5)

图4 GO 富集气泡图
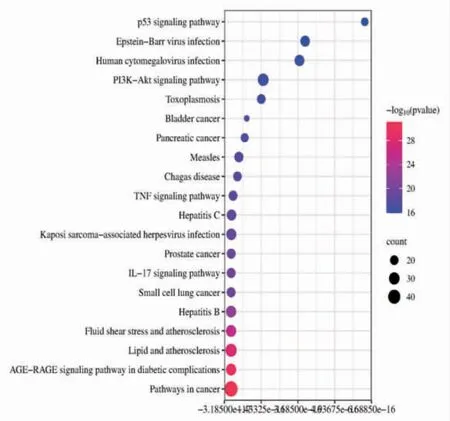
图5 KEGG 富集气泡图
2.2 分子对接结果 分子对接结果显示,主要化合物与关键靶点均有较好的结合活性,所有结合能均≤-6.0 kJ/mol。(见图6)结合作用最强的是槲皮素与IL-6,结合能为-10.4 kJ/mol。(见图7)其次是槲皮素与TNF,结合能为-9.3 kJ/mol。(见图8)

图6 分子对接热图

图7 槲皮素-IL-6

图8 槲皮素-TNF
2.3 动物实验结果
2.3.1 各组小鼠一般情况 造模8周后,造模组小鼠食欲差,体质量偏低,皮毛蓬垢,喜卧恶动,尿色深,尿味重;给药后,各治疗组小鼠一般状况均有不同程度改善。
2.3.2 各组小鼠肾组织IgA免疫荧光染色结果 正常组小鼠肾小球系膜区可见极少IgA沉积;模型组、西药对照组及玉屏风颗粒高、中、低剂量组均可见不同强度绿色荧光信号。其中模型组可见团块状强绿色荧光信号;西药对照组及玉屏风颗粒高、中、低剂量组荧光信号强度较模型组明显降低,呈散在颗粒状,其中玉屏风颗粒高剂量组降低程度最明显。(见图9)
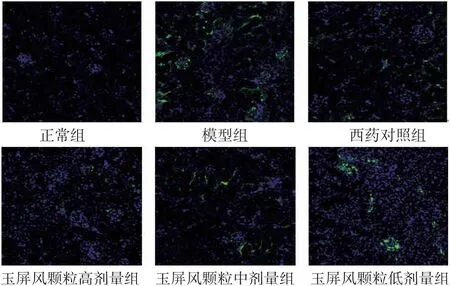
图9 各组小鼠肾组织IgA 免疫荧光染色病理图(免疫荧光染色,×200)
2.3.3 各组小鼠肾组织HE染色结果 正常组小鼠肾小球结构正常,肾小球系膜细胞、系膜基质未见增生,无纤维组织增生;模型组小鼠可见肾小球肿胀,系膜细胞和内皮细胞增生,细胞外基质增多,系膜区扩张。与模型组比较,西药对照组及玉屏风颗粒组高、中、低剂量组小鼠肾组织病变程度均有所改善,其中玉屏风颗粒高剂量组改善较为明显。(见图10)
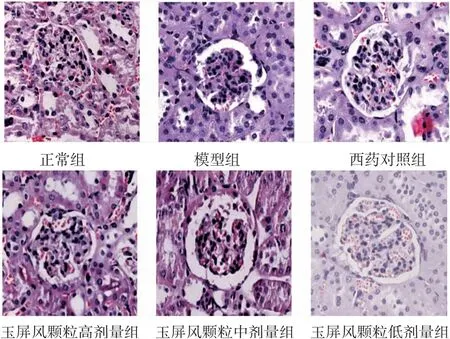
图10 各组小鼠肾组织HE 染色病理图 (HE 染色,×300)
2.3.4 各组小鼠肾组织PAS染色结果 正常组小鼠肾组织未见系膜细胞增生,细胞外基质增多;模型组小鼠肾组织可见中重度系膜细胞增生及细胞外基质增多,同时见间质炎症细胞浸润;西药对照组及玉屏风颗粒高、中、低剂量组可见系膜细胞增生程度均有所减轻,细胞外基质以轻中度增生为主,其中以玉屏风颗粒高剂量组减轻较为明显。(见图11)
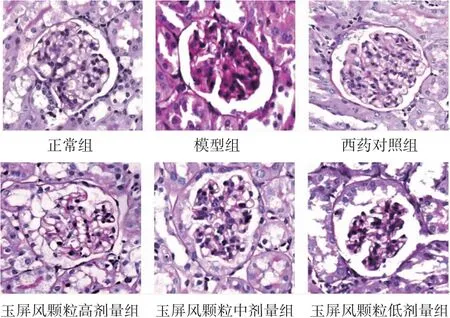
图11 各组小鼠肾组织PAS 染色病理图(PAS 深色,×400)
2.3.5 各组小鼠肾功能比较 与正常组比较,模型组小鼠24 h-UTP及血清中BUN、Scr水平明显升高(P<0.01);给药后,各治疗组小鼠肾功能均有不同程度改善,但不同干预药物及玉屏风颗粒组间比较,差异均无统计学意义(P>0.05)。(见表3)
表3 各组小鼠肾功能比较 (±s)
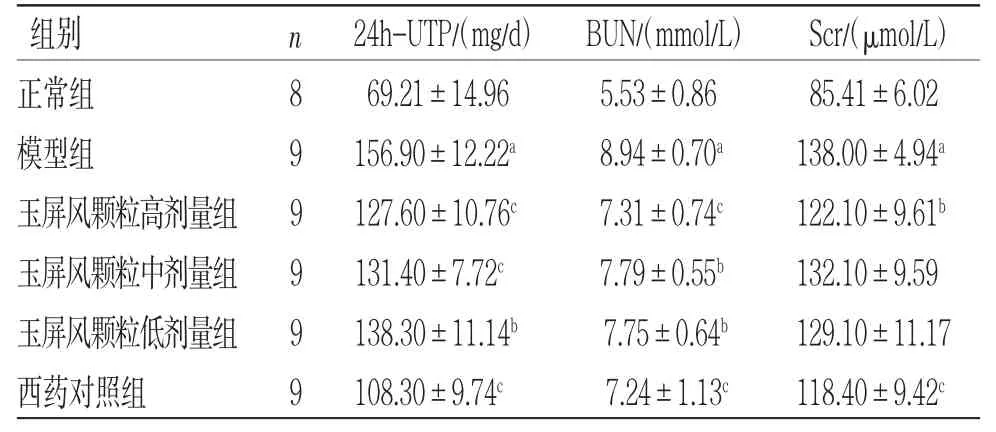
表3 各组小鼠肾功能比较 (±s)
注:与正常组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
?
2.3.6 各组小鼠血清中IgA、Th1/Th2比较 与正常组比较,模型组小鼠血清中IgA含量明显升高(P<0.05),使用药物治疗后,各治疗组小鼠血清中IgA含量均有所下降。其中,西药对照组及玉屏风颗粒高、中、低剂量组明显低于模型组(P<0.05);西药对照组与玉屏风颗粒高剂量组比较,差异无统计学意义(P>0.05);西药对照组与玉屏风颗粒中、低剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒高剂量组与玉屏风颗粒中、低剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒中、低剂量组组间比较,差异无统计学意义(P>0.05)。与正常组比较,模型组小鼠血清中Th1相关因子TNF-α、INF-γ、IL-2表达水平明显降低(P<0.05),使用药物治疗后,各治疗组小鼠血清中Th1相关因子TNF-α、INF-γ、IL-2均有所上调;西药对照组小鼠血清中TNF-α表达与玉屏风颗粒高、中、低剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒高剂量组与玉屏风颗粒低剂量组比较,差异有统计学意义(P<0.05);西药对照组及玉屏风颗粒高、中、低剂量组小鼠血清中INF-γ与模型组比较,差异有统计学意义(P<0.05);西药对照组与玉屏风颗粒高、中、低剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒组间比较,差异无统计学意义(P>0.05)。西药对照组及玉屏风颗粒高、中剂量组小鼠血清中IL-2与模型组比较,差异有统计学意义(P<0.05);西药对照组与玉屏风颗粒高剂量组比较,差异无统计学意义(P>0.05),与玉屏风颗粒中剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒高、中剂量组组间比较,差异有统计学意义(P<0.05);与正常组比较,模型组小鼠血清中Th2相关因子IL-4、IL-6表达水平明显升高(P<0.05);使用药物治疗后,各治疗组小鼠血清中Th2相关因子IL-4、IL-6表达水平均有所降低;西药对照组及玉屏风颗粒高、中、低剂量组小鼠血清中IL-4与模型组比较,差异有统计学意义(P<0.05);西药对照组与玉屏风颗粒高、中剂量组比较,差异无统计学意义(P>0.05),与玉屏风颗粒低剂量组比较,差异有统计学意义(P<0.01);玉屏风颗粒高剂量组与玉屏风颗粒低剂量组比较,差异有统计学意义(P<0.05)。与模型组比较,西药对照组及玉屏风颗粒高、中、低剂量组血清中IL-6均降低,差异有统计学意义(P<0.05);西药对照组与玉屏风颗粒高、中剂量组比较,差异无统计学意义(P>0.05),与玉屏风颗粒低剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒高剂量组与玉屏风颗粒低剂量组比较,差异有统计学意义(P<0.05)。与正常组比较,模型组小鼠血清Th1/Th2(INF-γ/IL-6)比值明显降低(P<0.05);使用药物治疗后,各治疗组小鼠血清中Th1/Th2(INF-γ/IL-6)比值明显升高(P<0.05);西药对照组与玉屏风颗粒高、中、低剂量组比较,差异有统计学意义(P<0.05);玉屏风颗粒高、中、低剂量组组间比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组小鼠血清中IgA、Th1 相关因子、Th2 相关因子、Th1/Th2 比较 (±s)

表4 各组小鼠血清中IgA、Th1 相关因子、Th2 相关因子、Th1/Th2 比较 (±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与西药对照组比较,cP<0.05;与玉屏风颗粒高剂量组比较,dP<0.05;与玉屏风颗粒中剂量组比较,eP<0.05;与玉屏风颗粒低剂量组比较,fP<0.05。
?
3 讨论
《诸病源候论》指出“风邪入于少阴,则尿血,是为风邪扰肾也”;《伤寒杂病论》记载“风为百病之长,中于项,则下太阳,甚则入肾”,说明风邪是IgAN的主要致病因素。周静威等[15]认为肾脏病的发生根于外风伤肾、内风动肾、风伏肾络、内外合风。郭立中在治疗肾炎尿蛋白时常用祛风、息风、搜风、御风等法[15]。《黄帝内经》云“风水相搏……,金为水母,母病及子,肺肾同病,而成风水是也”。这说明本病病位虽然在肾,但与肺脏关系密切。《素问·咳论篇》云“皮毛者,肺之合也”。肺通过宣散功能将卫气布散于皮毛,成为抵御外邪的第一道防线,如《医旨绪余·宗气营气卫气》所言,“卫气者,为言护卫周身……不使外邪侵犯也”。风邪侵袭,卫气奋起反抗,与邪气相互交争于肌表。肺气失于宣降,水液代谢障碍,壅塞于肌表而见水肿;若肺卫功能异常,无力抗邪,风邪循经入里,下移至肾,扰动肾脏,则见血尿;肾失封藏,精微物质外泄,则见蛋白尿。《素问·评热病论篇》云“邪之所凑,其气必虚”,故本病是肺卫亏虚,无力抗邪所致。玉屏风散是补肺固表、扶正固本的经典方剂,由黄芪、白术、防风组合而成。方中黄芪与白术君臣合用,补气固表,扶正固本,巩固人体的根本,防止体内精微物质外泄,以降低蛋白尿、减少血尿、保护肾功能,促进受损肾组织修复。黄芪得防风,固表而不留邪;防风得黄芪,祛邪不伤正。全方补中寓疏,散中寓补,重在提升人体的正气,巩固人体的根本,改善机体病理状态,恢复其生理功能,改善IgAN患者的临床症状,延缓病情的进展。黄芪具有双向调节免疫的作用,可改善肾脏微循环,提高肾小球滤过率,延缓肾纤维化,恢复肾小管重吸收与分泌功能,保护肾功能[6,16-18]。
现代医学研究发现,T淋巴细胞在肾脏病中具有免疫调节、免疫激活、免疫耐受的重要作用,尤其是CD4+T淋巴细胞在原发性肾小球疾病中的作用受到越来越多的国内外学者的关注[19]。活化的CD4+T细胞可以由Th0细胞分化Th1、Th2细胞。Th1细胞主要分泌INF-γ、TNF-α、IL-2等细胞因子参与细胞免疫,Th2细胞主要分泌IL-4、IL-6等细胞因子参与体液免疫[20-21]。INF-γ、IL-6作为Th1、Th2细胞分泌合成的特征性细胞因子[22],两者的比值即INF-γ/IL-6可反映Th1/Th2平衡状态。当机体免疫功能异常时,Th1/Th2则处于失衡状态[23]。研究发现,Th1/Th2失衡与IgAN的临床表现、病理分级显著相关,主要表现为Th1及其分泌的INF-γ、TNF-α、IL-2等细胞因子减少,细胞免疫受抑制,致使体内病原体不能及时清除,病原体反复持续刺激B细胞增殖产生IgA入血;Th2失去Th1制约,使Th0细胞向着Th2细胞方向极化,增多的Th2及其分泌的细胞因子IL-4、IL-6等进一步刺激B细胞增殖、活化,进而产生更多的IgA入血,加之半乳糖基化缺陷使得IgA糖基化异常,产生的Gd-IgA1沉积于肾小球系膜区导致IgAN的发生[24]。
本次网络药理学共筛选出玉屏风颗粒治疗IgAN的关键靶点有TNF、IL-6、IL-4、IL-2等。分子对接结果表明,槲皮素与TNF、IL-6、IL-4、IL-2具有较好的结合活性,这也体现出中药治疗的多靶点特点。本次动物实验表明,与正常组比较,模型组小鼠血清中Th1相关因子TNF-α、INF-γ、IL-2减少,Th2相关因子IL-4、IL-6增多,这说明IgAN模型小鼠中存在Th1/Th2失衡,向Th2漂移,同时伴血清IgA高表达。这与以往的研究结果一致。给予药物干预后,与模型组比较,玉屏风颗粒可下调Th2相关因子及IgA的表达水平,上调Th1相关因子,纠正Th1/Th2失衡,改善肾功能和肾脏组织病理学。该作用以玉屏风颗粒高剂量组作用最为明显。
综上所述,玉屏风颗粒治疗IgAN的机制可能是通过主要活性成分槲皮素、山柰酚、汉黄芩素等作用于TNF、IL-6、IL-4、IL-2等靶点来实现的。玉屏风颗粒对IgAN具有较好的治疗作用,其机制可能是通过调节Th1/Th2失衡,减轻体内免疫炎症反应,从而改善肾功能和肾脏组织病理情况。

