染色体G显带核型分析联合微阵列分析技术诊断罕见9p四体嵌合体1例
徐万洲,李锋,周方元,吴泽刚,吴青
(武汉大学人民医院检验科,武汉 430064)
9号染色体短臂四体综合征(tetrasomy 9p)是一种罕见的染色体异常,最先由Ghymers于1973年发现[1]。该病由9号染色体短臂存在4个拷贝引起,额外的2个拷贝形成1个由着丝粒连接的等臂染色体。这一等臂染色体是由于减数分裂Ⅱ期不分离和随后的重排,导致9号染色体短臂重复和长臂缺失而形成的[2]。9p等臂通常起源于母体[3]。
9p四体在产前诊断羊水穿刺中的检出率约为0.002%,其中约30%为嵌合体。该综合征的临床表现多样,包括宫内生长迟缓、发育延迟、脑室扩大、Dandy-Walker畸形、特殊面容(球形或钩鼻)、小颌畸形、耳畸形、眼距过宽、唇腭裂、先天性心脏病、指甲和手指发育不全、关节脱位、泌尿生殖器异常等。临床症状的严重程度与等臂染色体的大小、嵌合比例以及组织嵌合性相关[4]。
细胞遗传学是确诊染色体病的“金标准”[5]。近年来,染色体微阵列分析技术(chromosomal microarray analysis,CMA)在临床上得到广泛应用[6-8]。我们遇到1例34周孕妇因胎儿宫内窘迫急诊剖宫产,产前超声提示四肢偏短和发育迟缓,错失了最佳产前诊断时机,产后通过细胞遗传学G显带分析和染色体微阵列分析技术共同确诊为9p四体嵌合体,现将个案报道如下。
1 资料与方法
1.1病历资料 病例为1名新生男婴,其母孕34周因慢性胎儿宫内窘迫综合征行剖宫产分娩。男婴出生体重1 400克,身长40厘米,Apgar评分5分、8分、9分。低出生体重及自主呼吸弱,入住新生儿科治疗。面部特征无明显异常,但颅脑超声提示脑室后角增宽。患儿母亲孕30周期间,产前超声已显示胎儿四肢偏短及生长发育迟缓,但未进一步产前诊断。患儿母亲34岁,父亲42岁,无遗传病家族史。
为查明病因,进行了血液氨基酸和肉碱代谢物检测显示,精氨酸、鸟氨酸、酪氨酸、缬氨酸、肉豆蔻酰肉碱、葵烯酰肉碱、葵二烯酰肉碱、月桂酰肉碱及肉豆蔻酰肉碱等浓度异常。继而开展了细胞遗传学和CMA,以分析患儿的染色体状况。
1.2检测方法
1.2.1细胞遗传学检查 采集2 mL新生儿静脉血,按常规方法进行淋巴细胞培养、制片,并进行G显带分析。
1.2.2CMA 采集2 mL静脉血,采用CytoScan®750K芯片(Affymetrix公司)进行全基因组拷贝数变异(copy number variations,CNV)检测。该芯片包含75万个探针,覆盖全基因组28 897种 RefSeq基因,完全覆盖细胞遗传学芯片国际标准联合会(ISCA)规定的340种基因和52个已知癌症相关基因,以及2 192种人类孟德尔遗传学数据库(OMIM)遗传疾病基因。可检测杂合性缺失(LOH)及单亲同源二体(iso-UPD),能够发现>20%嵌合比例的染色体结构异常。检测报告原则:(1)缺失/重复片段≥200 Kb(标记≥50);(2)LOH≥10 Mb(常染色体隐性疾病基因基因区域);(3)UPD:印记染色体片段≥5 Mb,非印记染色体片段≥10 Mb。低于上述阈值但位于重要位点的变异,也将酌情报告。
2 结果
细胞遗传学G显带分析显示,约15%的分裂细胞中存在一条无法确认来源的异常染色体(在20个分裂像中,3个存在异常染色体)。该异常染色体形态学上类似于由两条9号染色体短臂通过单一着丝粒连接形成的等臂染色体,但无法确认。最终核型结果报告为:47,XY,1qh+,+mar[3]/46,XY,1qh+[17]。
细胞遗传学分析结果提示可能存在9p四体嵌合体,但需通过CMA进一步确认。异常核型示意图见图1。

注:A,47,XY,1qh+,+mar,+mar从形态上与2个9号染色体短臂通过着丝粒相连非常相似,比例为15%(3/20);B,46,XY,1qh+ 患者的正常核型,比例为85%(17/20)。
为确认异常标记染色体(+mar)的来源,CMA检测结果显示,核型为arr(1-22)x2,XY,无其他拷贝数变异。但在9号染色体发现arr[GRCh38] 9p24.3p11.2(208455_41008724)x3的40.8 Mb重复,拷贝数为3,即整个9号染色体短臂存在重复。
全基因组视图(WGV)和9号染色体详细视图见图2。CMA结果证实+mar为由9号染色体短臂重复形成的等臂染色体,从而最终诊断为9p四体嵌合体。
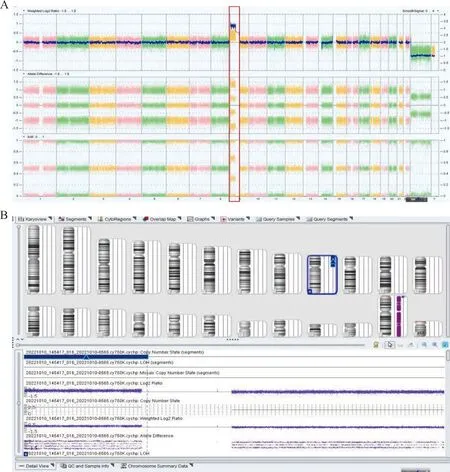
注:A,arr(1-22)x2,XY全基因组视图,可看出部分9号染色体拷贝数异常;B,arr[GRCh38] 9p24.3p11.2(208455_41008724)x3细节图,可看出9号染色体短臂(以着丝粒为分界)拷贝数为3,而长臂完全正常。
3 讨论
G显带染色体核型分析被视为产前诊断的“金标准”[9]。该技术通过培养人淋巴细胞、骨髓干细胞或羊水细胞,借助G显带对染色体的结构和数目进行形态学分析,可有效确定染色体数量和结构异常。但是,该方法存在检测周期长、分辨率低、人力消耗大的缺点。其结果也受制于经验较高的分析人员,存在一定主观性。对于某些特殊标记染色体,无法仅凭形态学确认其来源,可能导致漏诊或误诊[9]。
CMA是近10年来兴起的高分辨率、高通量基因组DNA拷贝数变异检测技术。CMA检测周期短,最小可检测50 kb的缺失或重复;对分析人员的经验要求较G显带分析低。但CMA的局限包括可能无法检出平衡易位和低水平嵌合体。近年CMA在产前诊断、发育迟缓、智力障碍等疾病诊断中应用广泛[7-8]。
本例G显带分析无法确认标记染色体+mar的来源,这与该技术的分辨率局限性有关。常规G显带分析采用300~400条带水平,对<10 Mb的染色体异常容易漏诊。即使采用同步化制备技术提高到500~550条带,也仅能检测到5 Mb以上的变化[10]。CMA技术虽准确检出了9p24.3-p11.2整个短臂约40.8 Mb重复,但仅依据拷贝数结果将诊断为9p三体是不准确的。结合G显带分析发现的等臂染色体形态,应纠正为9p四体,且嵌合比例约50%。G显带分析嵌合比例的失真可能源于淋巴细胞培养过程中正常/异常细胞的选择性增殖。羊水细胞同样存在这一现象,是9p四体嵌合体产前漏诊的主要原因之一。随着无需细胞培养的产前筛查和CMA技术应用,9p四体产前检出率逐渐提高[11-12]。
9p三体和四体是完全不同的病理类型。9p四体是由于减数分裂Ⅱ不分离和染色体重排导致9p短臂重复、长臂缺失形成的等臂染色体[13];而9p三体源于父母9号染色体与另一常染色体之间的相互易位,涉及9p部分或全部区段。9p三体除13、18、21三体外最常见,临床表现温和、症状相对一致。9p四体则临床表现与嵌合比例密切相关,有报道表现正常的病例[14]。
本例充分说明,G显带分析和CMA技术在诊断染色体疾病方面各有优劣。G显带分析直观显示染色体形态,但分辨率低、对未知来源难以确认、嵌合体失真。CMA分辨率高、嵌合检测准确,但无法显示染色体形态,50%嵌合时可能误诊。两种技术联合运用,既能得到准确核型,又能获知重复片段的来源、大小和嵌合程度,对临床诊断和遗传咨询意义重大。

