血性羊水细胞培养方法的改良与应用
黄道奇,涂华玉,童克婷,王朝红,朱健生
(安徽医科大学附属安徽省妇幼保健院遗传医学中心,合肥 230011)
自从首次报道将羊水细胞染色体核型分析应用于胎儿染色体疾病的产前诊断以来,这一技术一直是产前诊断胎儿染色体疾病的金标准和核心项目[1-2]。但实际工作中,血性羊水包括混有新鲜血细胞的红色羊水和以往有出血的褐色羊水中混有的血细胞会给胎儿脱落细胞的贴壁培养带来困难,尤其是单独的载玻片原位培养盒法(简称原位培养法)受影响更为明显。鉴于此,本实验室对于血性羊水采用塑料培养瓶和载玻片原位培养盒联合培养法(简称联合培养法),获得了很好的成功率。现总结分析如下。
1 资料和方法
1.1研究对象 收集2021年1月至2022年12月安徽省妇幼保健院遗传中心行产前诊断孕妇的31例血性羊水样本作为研究对象。产前诊断的指征包括35岁以上高龄孕妇、血清学产前筛查高风险、无创产前检测(noninvasive prenatal test,NIPT)高风险、夫妻双方中一方有染色体疾病、胎儿超声软指标异常及不良孕产史等。离心后肉眼可见鲜红色沉淀的血性样本为新鲜出血,褐色沉淀者为陈旧性出血。
1.2主要试剂与仪器 BIO AMF-2型羊水培养基(以色列BI公司)和15 mL无菌离心管(美国BD公司);CDS-5型染色体分散仪(美国Thermotron公司),Cytovision120型染色体核型分析工作站(德国Leica公司)。
1.3样本采集 在孕16~27+6周时,产前诊断医师在超声引导下行羊膜腔穿刺,弃去最初的5 mL,再抽取胎儿羊水20 mL分装于2个15 mL无菌离心管中。
1.4样本培养 将两管羊水580×g离心10 min,弃上清液后,留取约0.5 mL混悬细胞。血性羊水一管加入1 mL羊水培养基,吹打混匀后直接接种在原位载玻片上,编号1线;另一管加入4 mL羊水培养基,吹打混匀后接种至塑料培养瓶内,轻轻晃动使细胞悬液均匀平铺,编号2线。置于37 ℃、5% CO2培养箱培养。
1线培养2天后,轻轻加入新鲜37 ℃预热培养基3 mL,继续培养。1周后,倒置显微镜下观察细胞贴壁生长情况,镜下细胞集落中圆亮细胞较多时,超净工作台中吸出培养液,转移至另一塑料培养瓶再加入新鲜培养基1 mL继续传代培养备用。1线原载玻片培养盒中加入3 mL新鲜培养基,2线塑料培养瓶中加入5 mL新鲜培养基。换液后,1线放回37 ℃、5% CO2培养箱培养24 h后收获。2线血性羊水培养瓶倒置显微镜下标记细胞集落位置,超净工作台中将标记的细胞集落刮下,再转移到载玻片原位培养盒中,3日后观察、换液、收获。载玻片原位培养盒中加入2滴秋水仙素(终浓度0.25 μg/mL),轻轻晃动混匀,37 ℃培养箱温育30 min,倾斜培养盒,吸干培养液,加入37 ℃预热低渗液(1%柠檬酸钠)5 mL,37 ℃培养箱温育30 min。弃低渗液,加入新鲜配制的预固定液(5%冰乙酸)5 mL,室温7 min后弃掉,再加入新鲜配制的固定液(甲醇∶冰乙酸按体积比3∶1)5 mL,室温固定10 min。固定2次后分散仪中将玻片从培养盒中取出,玻片四边立在卫生纸上,吸干残留的固定液,玻片平铺于分散仪中,分散条件:温度21 ℃,湿度42%,分散15 min。再将玻片放入80 ℃烤箱2 h。烤片后玻片37 ℃胰酶消化15 s,生理盐水清洗终止胰酶反应,吉姆萨染液染色10 min。
徕卡Cytovision120分析系统扫描拍摄采集图像,以人类细胞遗传学国际命名体制(ISCN2016)G显带400条带水平为标准对染色体核型进行分析,计数原位载玻片中至少5个克隆,分析5个细胞,核型配对2个细胞。达到此标准视为细胞培养成功。达到400条带水平且各条染色体间无明显重叠计为有效核型。
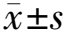
2 结果
2.1血性羊水标本类型 共纳入3 408例羊水中的31例血性羊水,其中新鲜出血3例(9.7%),陈旧性出血28例(90.3%)。
2.2两种培养方法成功率比较 新鲜出血羊水标本3例,使用原位培养法成功1例,失败2例,成功率33.3%;联合培养法3例均培养成功,成功率100%。
陈旧性出血羊水28例,运用原位培养法成功20例,失败8例,成功率71.4%;运用联合培养法的28例陈旧性出血羊水均培养成功,成功率100%。
31例血性羊水标本使用联合培养法均培养成功,成功率100%;使用原位培养成功21例,成功率67.7%。两种方法的培养成功率差异有统计学意义(P=0.001),联合培养法的成功率明显高于单独的原位培养法。
2.3两种培养方法有效核型数比较 新鲜出血羊水标本3例,原位培养法平均有效核型数为8;联合培养法的平均有效核型数为32。陈旧性出血羊水28例,原位培养法平均有效核型数为13;联合培养法的平均有效核型数为53。联合培养法的有效核型数明显高于原位培养法,且陈旧性出血羊水标本的有效核型数高于新鲜出血羊水标本。
2.431例血性羊水核型结果 31例血性羊水核型分析发现,2例陈旧性出血羊水样本核型结果为47,XXX,其余样本核型结果均正常。
3 讨论
羊水中胎儿脱落细胞贴壁培养及核型分析是产前诊断中的常规诊断方法,成功的羊水细胞培养是核型分析的基础和前提。正常羊水的性状是清亮、淡黄色,但在羊膜腔穿刺时偶尔会有血细胞混入羊水中,呈现鲜红色羊水或在羊水离心后可见红色沉淀。有学者曾统计新鲜出血羊水在羊水穿刺中的出现概率为2.76%[3],胎盘位置的影响、穿刺过程中胎儿突然的肢体动作、穿刺针碰到了脐带或胎儿、穿刺时反复进针导致母体血流入羊膜腔中等因素均可导致羊水中混有新鲜血液。除了新鲜出血,日常我们还会遇到褐色羊水或在离心后肉眼可见的褐色沉淀,此为陈旧性出血羊水,该性状的羊水与穿刺过程无关,此现象的出现原因是在羊膜腔穿刺前有过出血,但经过一段时间的吸收后,有血细胞碎片残留在羊水中从而呈现出褐色羊水。血性羊水中混有的红细胞和凝血因子的活性抑制胎儿脱落细胞的贴壁生长[4],而在离心收集沉淀过程中又无法将其分离,给细胞培养带来困难,尤其对我们常用的原位培养法干扰更为明显。
日常工作中我们发现原位培养法由于载玻片面积小,再受血细胞影响,克隆数较培养瓶法少许多,但收获步骤简单,无需转管,收获损失小;塑料培养瓶由于面积大,能够贴壁生长的克隆较多[5],倒置显微镜下观察发现培养瓶法血性羊水细胞贴壁的克隆数及细胞数明显多于原位培养法,但培养瓶法收获步骤繁琐,需多次转管,造成细胞的大量丢失耗损,最终有效核型数偏少[6]。鉴于此情况,我们结合两种方法的优点,对于难培养的血性羊水采用塑料培养瓶和载玻片原位培养盒联合培养。联合培养法增加了细胞刮取再培养的步骤,且原位培养法更易于真假嵌合的溯源与鉴别,所以本中心对血性羊水一线先使用培养瓶进行细胞接种,培养一周后显微镜下挑选克隆部位刮下细胞转接至载玻片原位培养盒中,这样可以在一定程度上将血细胞与羊水细胞分离,使接种到载玻片上的细胞更好地贴壁生长。而另一线我们仍采用原位培养法,也是考虑到原位培养法能够鉴别真假嵌合的优点[7-8],起到对照补充作用。
对本中心2021年1月至2022年12月3 408例羊水样本回顾性分析发现,淡黄色清亮羊水载玻片原位培养法成功率为100%,原位培养法既保证了成功率、简化了操作流程,又便于真假嵌合的鉴别,可以在正常性状羊水中常规使用。3例新鲜出血羊水原位培养法成功率仅为33.3%,28例陈旧性出血羊水原位培养法成功率71.4%;而联合培养法31例血性羊水均培养成功,成功率100%,且联合培养法获得的染色体分裂相可计数和可分析数均明显高于单独原位培养法,差异具有统计学意义(P<0.05)。所以对于血性羊水,我们推荐一线原位培养法,一线联合培养法,这样既可以提高培养成功率,又可以保障结果的可溯源性。另外,31例血性羊水核型分析发现, 2例陈旧性出血羊水样本核型结果为47,XXX。47,XXX综合征又称超雌综合征,是一种性染色体异常综合征,据报道47,XXX综合征的发生率约为6.5/1 000[9],在28例陈旧性出血羊水中47,XXX占7.14%,高于该综合征的发生率,目前还不能明确血性羊水与超雌综合征的相关性,未来将增加样本数量,进一步确定两者是否有相关性。

