TIGIT与相关皮肤疾病的研究进展
王万丝 沈嘉庆 刘 毅
北京协和医学院中国医学科学院皮肤病医院皮肤病研究所,江苏南京,210042
TIGIT(T cell immunoreceptor with Ig and ITIM domains,TIGIT)是一种由免疫球蛋白和免疫受体酪氨酸抑制基序组成的共抑制受体,主要在活化T细胞及先天免疫淋巴细胞表面表达。本文根据国内外研究现状,对TIGIT及其在相关皮肤病中的研究进展进行综述。
1 TIGIT的结构和表达
TIGIT于2009年首次被鉴定为调节T细胞功能的抑制性受体,属于免疫球蛋白(immunoglobulin,Ig)超家族。作为跨膜蛋白,TIGIT主要由三部分构成,即I型跨膜结构域、细胞外Ig可变(immunoglobulin variable,IgV)结构域、Ig尾酪氨酸(Ig tail-tyrosine,ITT)样基序与一个免疫受体酪氨酸抑制基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)[1]。IgV结构域中包含一个保守的亚基序,组成TIGIT与其配体脊髓灰质炎病毒受体(poliovirus receptor,PVR)结合时“锁钥”结构的一部分[1]。
TIGIT主要表达在活化的T细胞及先天免疫淋巴细胞表面,在效应T细胞及记忆T细胞表面也有较高的表达[2]。此外,TIGIT还可在调节性T(regulatory T cells,Treg)细胞、自然杀伤(natural killer cells,NK)细胞、NKT细胞及滤泡辅助T(follicular helper T cells,Tfh)细胞表面表达,并在激活的Treg细胞和NK细胞表面进一步表达增强[2]。高表达TIGIT的Treg细胞同时也高表达叉头框蛋白P3(Forkhead box P3,Foxp3)及糖皮质激素诱导的肿瘤坏死因子相关蛋白[3]。
2 TIGIT是TIGIT-CD226-PVR轴的核心成员
TIGIT-CD226-PVR轴的主要配体是PVR(CD155),主要受体是TIGIT和CD226(DNAM-1),其他重要受体还包括CD96、CD112R(PVRIG)等。TIGIT、CD226与CD96均可与PVR竞争性结合,TIGIT-CD226-PVR轴内各配体、受体间相互作用关系详见图1。
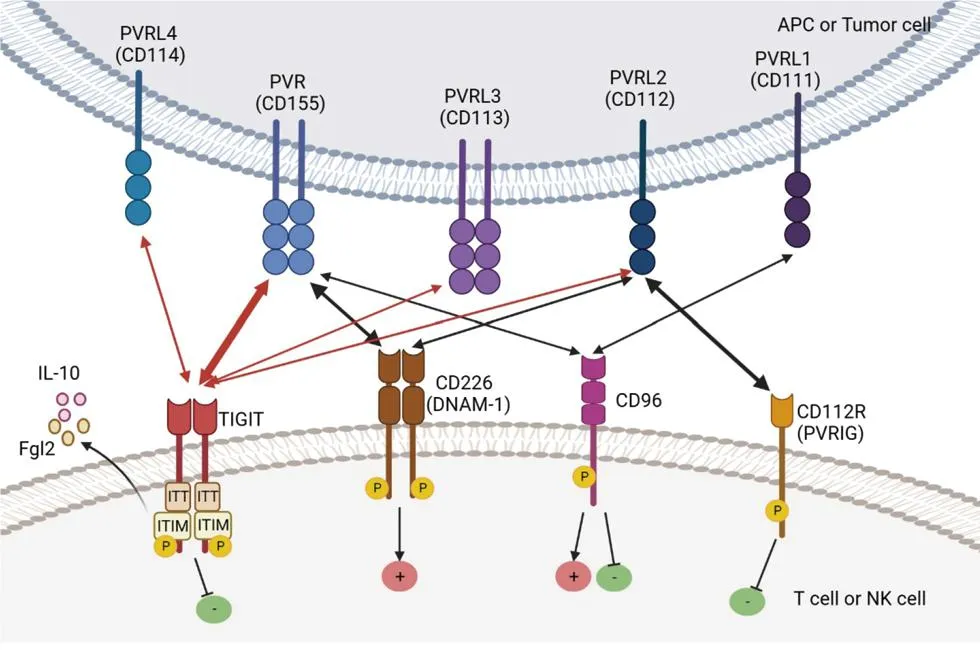
(1)受体TIGIT、CD226与CD96均可与配体PVR竞争性结合TIGIT对PVR具有最高亲和力,CD96次之,CD226最低。(2)TIGIT与CD112R为抑制性受体,CD226为激动性受体,CD96在NK细胞中为抑制性受体,但在T细胞中的激动/抑制效应尚不明确。(3)激活TIGIT可促Treg表达IL-10与Fgl2,抑制Th1与Th17细胞反应,CD226可通过与TIGIT竞争结合PVR直接下调TIGIT对Treg细胞的调节功能。(APC:抗原呈递细胞;ITT :Ig尾酪氨酸;ITIM:免疫受体酪氨酸抑制基序;P:磷酸化;PVR:脊髓灰质炎病毒受体;Fgl2:纤维蛋白原样蛋白2;IL-10:白介素-10;+:激动效应;-:抑制效应;双向箭头:受体与配体之间相互作用关系,箭头粗细代表亲和力大小)
2.1 TIGIT的四个主要配体 TIGIT主要与PVR和PVR的四个亚型结合,即PVR、PVRL1(CD111)、PVRL2(CD112)、PVRL3(CD113)、PVRL4(CD114),并与其他轴内刺激性或抑制性受体竞争相同配体。PVR是TIGIT最重要的配体,主要参与TIGIT-CD226-PVR轴内的免疫调节作用。晶体结构分析显示,TIGIT与PVR均为同源二聚体,在配体-受体相互作用后形成异源四聚体,且因为IgV结构域的保守序列,轴内其他受体也可通过“锁钥”结构与PVR形成类似的异源四聚体,与TIGIT竞争结合PVR,调节下游信号转导[1,2,4,5]。通过选择性剪接,PVR可产生4种不同亚型,包括2种跨膜亚型和2种可溶性亚型,但目前尚不清楚不同亚型的PVR是否对轴内不同受体具有不同的亲和力[1]。在小鼠体内,PVRL1主要与CD96结合,PVRL3也主要在小鼠中结合TIGIT,但在人体内尚无证据[6]。PVRL2主要表达在树突状细胞表面,同时也在其他组织如胰腺、骨髓、肾脏和肺中广泛表达,对TIGIT的亲和力弱于PVR[5]。PVRL4似乎是TIGIT的专一配体,目前尚未发现轴内其他受体能与之结合[7]。此外,具核梭杆菌的Fap2蛋白被鉴定为TIGIT的一种配体,并可抑制NK细胞与T细胞介导的抗肿瘤反应[8]。
2.2 TIGIT-CD226-PVR轴内其他受体 除TIGIT外,TIGIT-CD226-PVR轴内的其他重要受体还包括CD226(DNAM-1)、CD96、CD112R(PVRIG)等。TIGIT、CD226与CD96均可与PVR竞争结合,其中TIGIT对PVR具有最高亲和力,CD96次之,CD226最低[4,5]。CD226在T细胞与NK细胞表面作为共刺激分子存在,此外还可表达于NKT细胞、B细胞、单核细胞、血小板等细胞表面,激活CD226可通过促进细胞外调节蛋白激酶(ERK)与蛋白激酶B(AKT)的活化激活NK细胞,并进一步介导细胞毒作用[9]。CD96的功能尚不明确。在小鼠中,CD96可在NK细胞表面作为抑制性受体存在,减少NK细胞活化[10]。而在人体中,对CD96的功能研究存在相互矛盾的结果。通过对细胞转录组学分析,CD96与NK细胞功能衰竭相关,而另一研究则发现阻断CD96可增强NK细胞活性[11]。另有研究发现,阻断CD96对人原代T细胞分泌干扰素γ(IFN-γ)没有影响[12]。CD112R是PVRL2的同源配体,且与PVRL2的结合似乎并不受TIGIT影响,但CD226能与之竞争结合PVRL2[4,12]。目前研究表明,阻断CD112R可增强T细胞的抗肿瘤作用[4]。
2.3 TIGIT免疫调节作用机制 TIGIT的胞内结构域包括一个ITIM和一个ITT基序,故可直接介导胞内信号转导。ITIM基序对于人体内TIGIT信号转导必不可少,该基序突变将导致NK细胞介导的细胞毒作用的抑制机制丧失,在小鼠中,ITIM与ITT均可介导下游的抑制信号转导[2,13]。在人NK细胞中,与配体结合后,ITT样基序磷酸化可招募生长因子受体结合蛋白2(Grb2)与β-arrestin 2,进一步通过下游磷脂酰肌醇-3激酶(PI3K)通路与丝裂活化蛋白激酶(MAPK)通路抑制NK细胞的细胞毒作用[14]。另一研究表明,TIGIT也可通过减少ERK1/2及ZAP70/Syk的磷酸化直接抑制NK细胞[15]。在T细胞中,TIGIT的调节作用可能通过T细胞抗原受体(T cell receptor,TCR)来实现。激动TIGIT可直接抑制T细胞对CD3/CD28刺激的反应,并下调与TCR/CD28下游信号转导、T细胞活化及细胞周期相关的基因表达[16]。此外,TIGIT可能与PD-1具有协同作用,共同参与肿瘤的免疫逃逸[17]。
TIGIT与CD226对于Treg细胞功能的相反调节作用是理解TIGIT免疫调节作用的重要环节。阻断CD226可增强移植物抗宿主病和皮肤移植小鼠模型中Treg细胞的免疫抑制功能,激活TIGIT则可以增加白介素(IL)-10与纤维蛋白原样蛋白(Fgl)2表达,抑制辅助T细胞(Th)1与Th17细胞反应[18]。CD226可通过与TIGIT竞争结合PVR直接下调TIGIT对Treg细胞的调节功能,此过程不依赖CD226介导的下游信号转导,CD226缺陷可增加PVR与TIGIT结合,进一步抑制蛋白激酶B-哺乳动物雷帕霉素靶蛋白1复合物信号通路,上调Foxp3表达,增强Treg的免疫抑制功能[19]。
3 TIGIT与相关皮肤病
3.1 TIGIT是黑素瘤治疗的新靶点 黑素瘤是高度恶性的皮肤肿瘤,TIGIT被认为是目前黑素瘤免疫治疗中替代PD-1/CTLA-4的重要靶标之一。与PD-1和CTLA-4不同,TIGIT在TIL和肿瘤浸润NK细胞上均有较高的表达水平[20]。研究发现,与非复发小鼠相比,黑素瘤复发小鼠T细胞表面TIGIT表达增强[21],在患者肿瘤抗原特异性CD8+T细胞和CD8+肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TIL)上也观察到TIGIT高表达,且与患者较低的生存率明显相关[22,23]。黑素瘤患者外周血和肿瘤部位的Treg细胞具有较高的TIGIT和较低的CD226表达水平,TIGIT/CD226比值升高[24]。由于TIGIT和CD226分别能增强和破坏Treg细胞的抑制功能和稳定性,激活CD226或阻断TIGIT有助于减轻黑素瘤的Treg抑制[24]。而在黑素瘤小鼠模型中阻断TIGIT可逆转肿瘤浸润NK细胞的耗竭,显著增加小鼠的存活率[20]。
TIGIT与PD-1的表达在黑素瘤中显著正相关,两者共同调节黑素瘤患者抗原特异性CD8+T细胞和CD8+TIL的扩增和功能[23]。共表达PD-1 和 TIGIT 的淋巴细胞亚群比例则可用于预测 PD-1阻断剂的治疗效果[25]。目前研究更强调TIGIT与其他阻断剂的联合应用。在体外,同时阻断TIGIT和PD-1可增强肿瘤抗原特异性CD8+T细胞和CD8+TIL的增殖,提高TIL对自体黑色素瘤细胞的反应强度[23]。此外,同时阻断IL15和TIGIT也可逆转CD155介导的NK细胞抑制,阻碍黑素瘤转移[26]。
肿瘤微环境中TIGIT的高表达可能提示患者对共抑制受体阻断剂有更高的反应。对于接受免疫治疗的晚期黑素瘤患者,基线时TIGIT较高的表达量与更长的总生存期相关[27]。高TIGIT淋巴细胞浸润比例与抗PD-1免疫治疗下更长的无进展生存期相关,因此TIGIT 的DNA甲基化和表达被视为预测黑色素瘤免疫治疗疗效的生物标志物[28]。同时,黑素瘤患者前哨淋巴结组织中TIGIT表达增加也可能与无复发生存期改善有关,有助于对患者进行危险分层,从而指导辅助治疗[29]。
3.2 TIGIT高表达与皮肤T细胞淋巴瘤预后不良相关 蕈样肉芽肿(granuloma fungoides,MF)和Sézary综合征(Sézary syndrome,SS)是皮肤T细胞淋巴瘤最常见的两种亚型。在MF患者中,CD4+和CD8+TIL表面共表达TIGIT和PD-1,这种趋势在不同疾病分期中均一致[30]。另一研究也表明,在MF和SS患者外周血CD4+T细胞表面的TIGIT表达明显升高[31]。在部分SS患者外周血中可发现高TIGIT表达的CD4+T亚群,该亚群TIGIT与CD26-、TCRVβ+正相关,而这些患者多被诊断为B2晚期,故高表达TIGIT的CD4+T细胞常被定义为SS中的恶性细胞群,与疾病预后不良密切相关[31]。TIGIT也在随后多项研究中被用作恶性标记物。在低剂量全身皮肤电子束治疗后,SS患者外周血中包括TIGIT在内的免疫衰竭标志物较治疗前的基线水平显著降低[32]。在抗人CCR4抗体莫加珠单抗治疗后,TIGIT和PD-1共表达的CD4+T细胞数量随治疗而减少[33]。此外,在进展为皮肤T细胞淋巴瘤的淋巴细胞变异高嗜酸性粒细胞综合征的患者中也发现TIGIT基因过表达,提示其在肿瘤进展和转化中的潜在作用[34]。
3.3 TIGIT是系统性红斑狼疮潜在治疗靶点 TIGIT在系统性红斑狼疮(systemic lupus erythematosus,SLE)患者外周血CD4+T细胞上表达升高,在NK细胞上表达降低,并都与疾病的活动度相关。SLE患者外周血中表达TIGIT的NK细胞比例明显低于健康对照组,特别是疾病活动指数较高的患者。然而,该比例在常规治疗后可显著增加,提示NK细胞上TIGIT水平与疾病活动度和严重程度呈负相关[35]。TIGIT被认为是NK细胞的负性调节因子,低表达TIGIT的NK细胞具有相对高水平的细胞功能,在体外阻断TIGIT可恢复NK细胞分泌其活化标志物IFN-γ的功能[35]。相反,TIGIT在SLE患者外周血CD4+T细胞上高表达。SLE患者特异性的自身抗体(如抗dsDNA抗体、抗Sm抗体)滴度、疾病活动指数评分与表达TIGIT的CD4+T细胞比例呈正相关[36]。然而在有血液学和肾脏症状的SLE患者中,TIGIT+T细胞比例较其他SLE患者降低[37]。
SLE是一种T细胞依赖性的自身免疫性疾病,CD4+T细胞在SLE中发挥关键致病作用,过表达的TIGIT可抑制CD4+T细胞功能。在体外实验中,通过CD155激活TIGIT通路可显著减弱SLE患者CD4+T细胞的活性,在小鼠模型中,给予CD155可缓解红斑狼疮症状并延缓疾病发展[38]。TIGIT-Ig融合蛋白的应用可延迟狼疮小鼠蛋白尿发作时间,降低血清抗核抗体浓度,显著提高存活率[39]。进一步研究还发现,TIGIT-Ig治疗组中B细胞亚群(包括生发中心B细胞、浆母细胞和浆细胞)的比例降低,TIGIT-Ig可能通过B细胞中的SPI-B-PAX5-XBP1轴来降低体外抗体分泌细胞的分化和抗体的产生[40]。目前的研究结果表明TIGIT是SLE治疗中具有前景的潜在靶点。
3.4 TIGIT表达量与银屑病PASI评分呈负相关 共抑制受体在银屑病免疫发病机制中可能发挥一定的作用。与健康对照组相比,银屑病患者外周血CD4+T细胞中TIGIT的表达水平和mRNA水平明显降低,TIGIT表达量与银屑病皮损面积严重程度指数(PASI)呈负相关[41],患者全身炎症表现与T细胞表面TIGIT低表达有关[42]。
接受治疗后的银屑病患者外周血CD4+T细胞表面TIGIT表达增加。在接受阿维A治疗4个月后,患者外周血中表达TIGIT的CD4+T细胞显著增加,IFN-γ和IL-17A水平下降,IL-10升高[41],类似的现象也在英夫利昔单抗治疗后观察到[43]。此外,研究还发现患者TIGIT的基线表达量与英夫利昔单抗治疗第10周PASI 评分下降百分比呈负相关,这提示TIGIT的外周血表达水平或可作为生物制剂疗效的预测性标志物[43]。
研究发现,在TIGIT-CD226-PVR轴上,抗原呈递细胞上的PVR可与T细胞表面刺激性受体CD226或抑制性受体TIGIT相互作用,阻断CD226能抑制T细胞产生促炎细胞因子,阻断 TIGIT则促进T细胞增殖,这两种受体共同调控T细胞的炎症反应[42]。而激活TIGIT可显著抑制CD4+T细胞增殖,降低外周血中IFN-γ和IL-17A水平[41]。TIGIT对CD4+T细胞增殖的抑制作用可能参与银屑病的发病机制,激活TIGIT信号通路可能是潜在的治疗途径。
3.5 TIGIT在其他皮肤疾病中的异常表达 在皮肤鳞状细胞癌功能受损的NK细胞上,以TIGIT为主的耗竭标志物表达增加,表明TIGIT在NK细胞功能障碍中发挥重要作用[44]。Merkel细胞癌是一种侵袭性神经内分泌皮肤癌,在肿瘤组织中观察到TIGIT的异常表达以及CD155染色减弱,提示靶向TIGIT-CD155信号传导治疗Merkel细胞癌的潜在可行性[45]。共表达PD-1和TIGIT的淋巴细胞亚群水平似乎可预测 PD-1阻断剂对Merkel细胞癌的疗效[25]。
在其他炎症性皮肤疾病中也观察到TIGIT的异常表达。皮肌炎患者外周血中CD4+T细胞表面TIGIT表达增加,且与疾病活动度密切相关,治疗后可显著降低[46];轻度特应性皮炎患者中虽也有相似表达趋势,但重度患者外周血中CD4+T细胞TIGIT表达量反而减少,并与血清IgE水平呈负相关[47]。在麻风病变中,TIGIT在CD8+T细胞上高表达,提示麻风病变中CD8+T细胞可能受到耗竭[48]。
4 小结
本文总结TIGIT在皮肤疾病领域的研究进展,包括其结构、表达、作用机制以及在多种皮肤疾病中的研究现状,提示其可能参与多种皮肤疾病的发生发展,有望成为治疗黑素瘤、系统性红斑狼疮的潜在靶点,还可作为评估皮肤T细胞淋巴瘤、银屑病等疾病预后和治疗反应的预测性标志物。了解TIGIT在相关皮肤病中的研究进展,有助于进一步在皮肤科领域开发和利用该分子,并深入探究共抑制受体在相关皮肤病中的作用机制。

