基于荧光素的高选择性Hg2+荧光探针的合成及其光谱性质研究
*杨文生 杨菀 马亚军 马向荣
(榆林学院化学与化工学院 陕西 719000)
引言
汞离子(Hg2+)是环境中毒性最强的重金属离子之一[1-3],由于人类活动离不开汞的使用,导致在此过程中产生大量的含汞废水,当此类含汞废水排放到环境中后,很容易被土壤及水体吸附,进而通过根系吸收、灌溉等方式富集在作物体内,对作物的生长产生直接影响,作物进入食物链中,最终对人、畜、鱼等健康和生长造成危害。当人体摄入过量的汞时,会引起汞中毒现象,如机体功能失调、记忆力衰退、消化功能紊乱、痴呆等[4-5]。为了减少汞污染所造成的严重后果,需要严格控制水体中汞的含量,因此如何对水体中汞离子含量的定性、定量监测以及如何有效去除工业含汞废水中的汞离子均受到很多关注。
目前用于水体中汞离子的检测方法众多,诸如电感耦合等离子体质谱法[6]、原子吸收光谱法[7-8]、分光光度法[9]、电化学法[10]等,但上述方法的缺点有很多,比如测试仪器的成本高、价格贵,检测过程较为复杂,测样之前样品的预处理繁琐等。相比之下,荧光光谱法具有响应时间短、成本低等优点[11-13]。目前用于识别汞离子的探针合成较复杂[14-16], 本研究旨在制备方法简单的汞离子荧光探针,用于水体中汞离子检测的需要。
荧光探针的设计离不开性能优异的荧光团,在用作荧光团的常见荧光染料中,荧光素、BODIPY、香豆素、罗丹明等都具有很好的荧光性能,目前以此为基础合成的金属离子荧光探针已出现在大量文献中。其中荧光素染料近年来备受关注,重要因素之一是其分子结构为螺内酰胺结构,这种特殊的结构使得荧光素能够在特定的环境中发生“闭环-开环”的转化,致使释放荧光,这为探针设计提供了较好的基础。此外,荧光素还具有高荧光量子产率和消光系数,良好的生物相容性及可操作性,在紫外-可见光区的吸收范围比较宽等优点,使得荧光素成为生物分析中荧光探针设计经常用到的有机化合物。本研究以荧光素和费舍尔氏醛为基本原料制备的汞离子荧光探针,对汞离子有着很好的识别性能,并不受其他共存金属离子的影响,在生物和环境中汞离子的监测中具有潜在的应用价值。
1.实验部分
(1)荧光素水合肼的合成
首先准确称取1.50 g(4.5 mmol)荧光素,然后将其置入圆底烧瓶中,在此基础上加入50 mL 无水乙醇,搅拌均匀后,加入过量水合肼(80%)12 mL。对上述混合物加热回流10 h, 这时反应液将变为澄清,对其进一步冷却直至室温,并转移至200 mL 水中,这时反应产生大量沉淀,将其静置约3 h 后减压抽滤,所得沉淀用纯净水与无水乙醇进行洗涤。最后的粗产物使用无水乙醇进行重结晶,得到白色固体。
(2)探针L的合成
在圆底烧瓶中,依次加入费舍尔氏醛(1.0 mmol,0.20 g)和荧光素水合肼(1.0 mmol,0.35 g),再加入50 mL 无水乙醇,加热搅拌回流2 h,有沉淀析出,继续回流5 h,所得沉淀进行减压抽滤,并用甲醇重结晶,得到最终固体产物。产率65%,熔点192.2~193.4 ℃。如图1 所示。

图1 探针L 的合成路线
1H NMR(600MHz,DMSO-d6)δ9.89(d,J=8.8Hz,1H),9.80(s,2H),7.81~7.75(m,1H),7.53~7.46(m,2H),7.40(dd,J=7.4,1.2Hz,1H),7.27(td,J=7.7,1.3Hz,1H),7.08(d,J=7.9Hz,1H),7.06~6.97(m,2H),6.60(d,J=2.4Hz,2H),6.48~6.38(m,4H),5.29(d,J=8.8Hz,1H),4.38(s,2H),3.49~3.41(m,1H),3.24(s,3H),1.59(s,6H),1.06(t,J=7.0Hz,2H).13C NMR(151MHz,DMSO-d6)δ185.82,173.39,165.91,158.66,152.89,143.84,139.64,133.04,129.82,128.39,123.87,121.19,112.46,110.44,108.98,102.84,98.83,65.10,56.51,47.37,40.02,29.65,19.03.ESI-MS:m/z530.8[M+H]+。
2.结果与讨论
(1)探针L对金属离子的选择性
向探针溶液中依次加入过量金属离子,结果如图2 所示。发现Hg2+在515 nm 处出现很强的荧光发射峰,表明Hg2+对探针有很好的响应。同时,其他所有金属离子对探针均没有响应。由此可见,在所有测试的金属离子中,只有Hg2+对探针有积极的响应,说明探针对Hg2+有着很好的选择性。
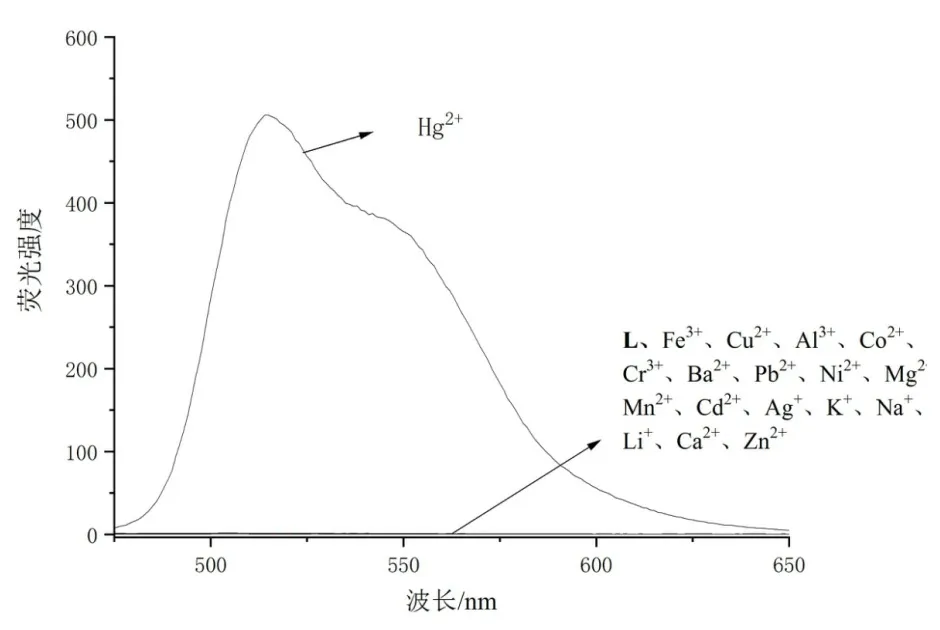
图2 探针(10μmol/L)在不同金属离子存在下的荧光发射光谱
(2)Hg2+浓度对探针荧光光谱的影响
向探针溶液中逐渐增加Hg2+,结果发现探针的荧光发射光谱强度逐渐增大,并最终达到饱和,如图3所示。其原因归属于Hg2+与探针识别基团中O、N 等杂原子配位后,造成荧光素分子螺内酰胺环产生了闭环到开环的过程转变,使得荧光出现了由弱到强的显著变化。

图3 随Hg2+浓度增加探针(10μmol/L)的荧光发射光谱
(3)不同金属离子的竞争性实验
为了分析在探针溶液中加入不同金属离子后的荧光强度的响应情况,进行了针对性实验。纵坐标表示所测荧光强度与探针自身荧光强度的比值,探针与金属离子的荧光强度和探针自身荧光强度的比值用红色条形图表示,绿色条形图表示探针、金属离子与汞离子的荧光强度和探针自身荧光强度的比值,得到所测不同金属离子的竞争结果,如图4 所示。由图可知,Hg2+在与其他共存金属离子所进行的竞争中,明显具有优势。因而探针识别Hg2+不会受到共存金属离子的干扰。
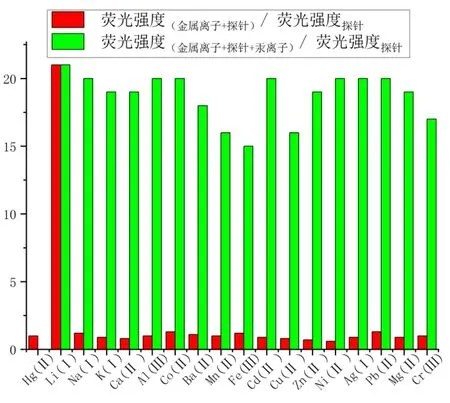
图4 测试中共存金属离子的竞争实验
(4)探针与Hg2+的反应机理
Hg2+未加入探针溶液中前,探针分子内荧光素分子螺内酰胺环为闭环状态,在紫外光下探针几乎没有释放荧光,如图5 左侧插图所示。当加入Hg2+后,由于分子内O、N 等与Hg2+的配位作用使得荧光素分子螺内酰胺环开环,从而致使探针分子释放强烈的黄色荧光,如图5 右侧插图所示。
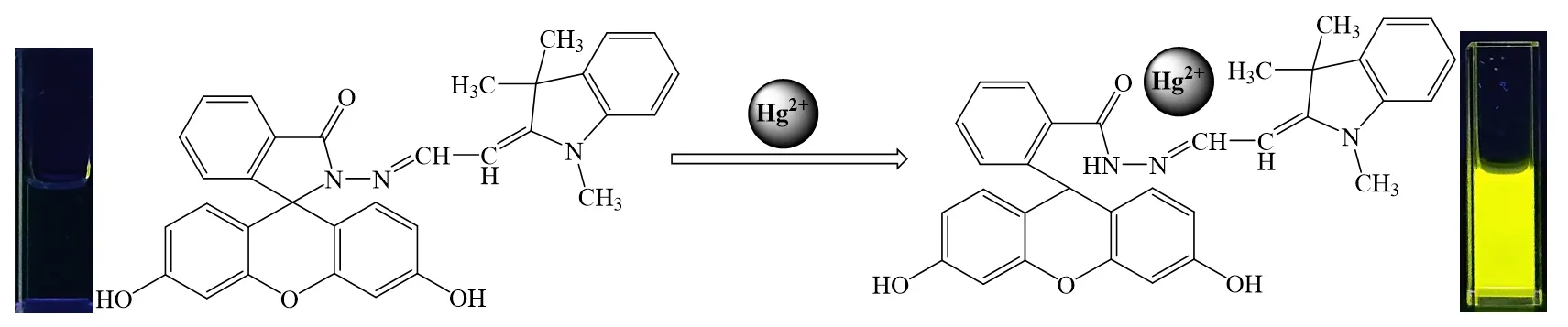
图5 探针识别Hg2+的机理图
3.结论
文中制备了一种新型的荧光素衍生物,对重金属离子Hg2+有着很好的选择性,在特异性识别Hg2+的同时,其他金属离子不构成干扰,可作为检测Hg2+的荧光探针。该探针对Hg2+的识别机理归因于分子内杂原子与Hg2+的结合致使荧光素分子螺内酰胺环开环,荧光得以释放。目前基于此机理的Hg2+探针在文献中并不多见,本研究所做工作对于此类研究能够提供有益的思路和借鉴,在生命科学及环境科学相关领域中关于金属离子Hg2+的实时监测有着潜在的应用价值。

