儿童难治性狼疮性肾炎1 例报告并文献复习
葛主辉,李玉峰,洪盼,葛红旵,陈斌斌,章惠彬
儿童系统性红斑狼疮(childhood-onset systemic lupus erythematosus,cSLE)是一种自身免疫功能紊乱导致多系统和多脏器损害的慢性炎症性疾病,病理机制包括免疫耐受降低、自身抗体产生、免疫复合物沉积及补体系统的激活[1-2]。大量研究表明,cSLE 的病因与遗传、免疫调节、种族和环境因素密切相关[1]。与成人系统性红斑狼疮相比,cSLE 具有起病急、疾病活动度高、脏器损伤进展快、致残和致死率更高等特点,60%~80%的cSLE早期表现出肾脏损害[3],约22%的患者进展至肾功能不全。狼疮性肾炎(lupus nephritis,LN)临床表现多样,可出现轻重不一的血尿、蛋白尿、肾炎综合征、肾病综合征或急进性肾小球肾炎,即使LN 患儿早期经标准化或多靶点治疗,部分仍不能达到临床缓解,表现为复发或难治性LN。本文报道了1 例贝利尤单抗联合多靶点方案治疗儿童活动性LN,以期为临床诊治提供有效的参考,现报道如下。
1 病例
患儿,女,9 岁。因“反复蛋白尿5 年余”于2021年1 月10 日就诊于宁海县第一医院。患儿5 年余前曾因肉眼血尿,双下肢浮肿就诊本院,尿常规提示白细胞58 个/l,红细胞6 600 个/l,24 h 尿蛋白2 850 mg,血清白蛋白23 g/L,尿素氮17.5 mmol/L,血肌酐347mol/L,估算肾小球滤过率(estimated glomerular filtration rate,eGFR)17 ml·min-1·1.73 m-2,补体C3 0.25 g/L,抗核抗体(ANA)阳性(+),ANA 滴度1∶3200,抗双链DNA 抗体(ds-DNA)(+)。2017 年6 月1 日外院肾脏病理穿刺提示弥漫增生性肾小球肾炎,LN病理分型Ⅳ-S(A/C)。诊断为“cSLE,LN,急性肾损伤”。予大剂量甲泼尼龙联合环磷酰胺冲击诱导缓解治疗,诱导缓解方案:甲泼尼龙20 mg/kg 隔日冲击,冲击3 次为1 疗程,间隔1 周重复1 个疗程;环磷酰胺静脉冲击8 ~12 mg·kg-1·d-1,每2 周1 次,累计剂量150 mg/kg。患儿环磷酰胺冲击联合激素治疗期间,血肌酐以及eGFR 恢复至正常,尿蛋白转阴,维持治疗采用泼尼松0.5 mg · kg-1· d-1、吗替麦考酚酸酯(MMF)20 mg·kg-1·d-1、羟氯喹5 mg·kg-1·d-1治疗。2019 年8 月27 日患儿出现发热、溶血性贫血、血小板下降,血管性血友病因子裂解酶(ADAMTS13)<5%,cSLE 复发合并血栓性血小板减少性紫癜(TTP),予大剂量甲泼尼龙冲击、静脉滴注免疫球蛋白以及连续血浆输注治疗,病情缓解,尿蛋白转阴;2019 年9 月10 日重复肾脏活检,病理提示局灶节段增生肾小球肾炎伴局灶节段肾小球轻度硬化,LN病理分型Ⅲ(A/C),泼尼松逐渐减量过程中尿蛋白有波动(1+~2+),24 h 尿蛋白1 301 mg;2020年7 月患儿出现发热,尿蛋白3+,考虑LN 复发,予泼尼松10 mg/d、MMF 20 mg·kg-1·d-1、他克莫司0.05 mg·kg-1·d-1多靶点方案治疗,尿蛋白转阴;2020 年10 月患儿泼尼松减量至7.5 mg 时出现尿蛋白波动(1+~2+),2021 年1 月10 日患儿就诊本院,尿蛋白再次升高。患儿出生史、既往史无殊。父母体健,非近亲结婚,否认有类似疾病以及遗传病史。
入院查体:体温36.5 ℃,呼吸20 次/min,脉搏90次/min,血压119/82 mmHg(1 mmHg≈0.133 kPa),体质量54 kg,体质量指数(body mass index,BMI)26.78 kg/m2。神志清楚,精神可,满月脸,局部有斑片状脱发,双重脸颊有散在红斑,口腔未见溃疡,躯干、四肢、手掌、足底及趾指末端未见红斑以及瘀点瘀斑,双侧腋下、腹股沟及腹壁可见紫纹,双侧眼睑以及四肢无浮肿,咽部稍充血,双肺呼吸音粗,未闻及干湿啰音,心率90 次/min,心音有力,律齐,各瓣膜区未闻及病理性杂音,未及心包摩擦音,腹部稍膨隆,无压痛,无反跳痛,无肌紧张,肝脾肋下未触及,双肾区无叩痛,四肢关节无肿胀及压痛,神经系统检查阴性。
入院后完善相关检查。血常规:白细胞计数6.53×109/L,血红蛋白126 g/L,血小板计数197×109/L。尿常规:尿蛋白(2+),红细胞40 ~50/HP,白细胞20 ~30/HP。自身抗体:ANA 核型均质性(+),ANA 阳性(滴度1∶3 200),ds-DNA(+),抗核小体抗体(+),抗组蛋白抗体(±),抗核糖体P 蛋白抗体(±)。24 h 尿蛋白:441.34 mg。凝血功能:凝血酶原时间10.8 s,活化部分凝血活酶时间31.0 s,D-二聚体1.06 mg/L。肝肾功能:谷氨酸氨基转氨酶38.7U/L,天门冬氨酸氨基转氨酶41.9 U/L,总蛋白63.5 g/L,白蛋白36.1 g/L,尿素氮5.5 mmol/L,肌酐58.4mol/L。免疫球蛋白:免疫球蛋白G7.82g/L,免疫球蛋白A2.52 g/L,免疫球蛋白M 0.71g/l,补体C30.81g/L,补体C4 0.14g/L。肝胆胰脾B 超:肝内脂质沉积。胸部CT:左肺下叶背段一直径约7 mm 囊性灶。泌尿系统B超、心电图、心彩超均未见明显异常。
根据cSLE 疾病活动度(SLEDAI 2000)评分为20 分(血尿4 分,蛋白尿4 分,脓尿4 分,脱发2 分,新发红斑2 分,ds-DNA 升高2 分,补体C3 2 分),该患儿疾病活动度评估为重度。患者监护人于2021年1 月26 日签署知情同意书后,进行以泼尼松片7.5 mg/d、MMF 20 mg·kg-1·d-1、他克莫司0.05 mg·kg-1·d-1、羟氯喹5 mg·kg-1·d-1为基础的多靶点疗法联合贝利尤单抗治疗。贝利尤单抗输注方案:患儿分别于第0、2 周及随后每4 周1 次输注10 mg/kg。输注贝利尤单抗2 周SLEDAI 2000 评分下降4 分,12 个月SLEDAI 2000 下降2 分,尿蛋白较前明显好转;2022 年8 月26 日患儿SLEDAI 2000 评估2 分,复查ANA 滴度好转,补体C3 恢复正常,24 小时尿蛋白尿83 mg,尿蛋白转阴。贝利尤单抗联合多靶点治疗随访19 个月,患儿体质量增加明显,体质量76 kg,BMI 33.78 kg/m2,满月脸,腹壁紫纹明显,无视力下降,无明显感染发生,无皮疹,无胸闷、气促,无头痛、头晕等不适反应,见表1。
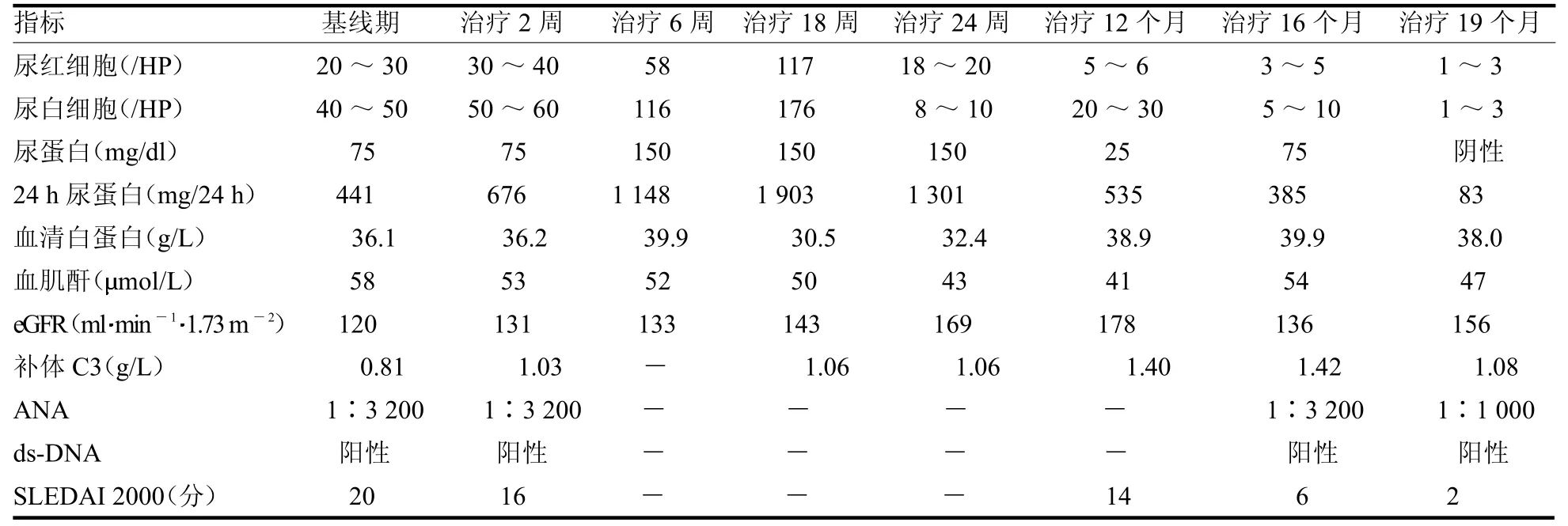
表1 贝利尤单抗联合多靶点治疗前后的患儿临床数据变化
本研究获得宁海县第一医院伦理委员会批准,研究对象由法定代理人同意参加并签署书面同意书。
2 讨论
LN 是cSLE 最严重并发症之一,免疫复合物沉积于肾小球毛细血管襻,通过激活补体导致肾小球病理损害,甚至进展至终末期肾病[1,3-5]。LN 一旦出现大量蛋白尿、红细胞管型和蜡样管型、持续性高血压(舒张压>90 mmHg 且时间>4 个月)、持续性氮质血症、急性肾损伤(血肌酐≥88.7mol/L,发病2个月内),eGFR 下降,意味着肾脏损伤重,预后差[1]。肾活检是LN 诊断的“金标准”,肾脏病理分型以及疾病活动度对LN 治疗方案的选择及预后的判断有重要意义[3-4]。本例患儿活动性LN 诊断明确,病程5年来,表现为大量蛋白尿、肉眼血尿、氮质血症、eGFR下降、抗核抗体阳性、补体持续低下以及合并TTP,病理提示弥漫增生性LN Ⅳ-S(A/C)型。该患儿经大剂量甲泼尼龙联合环磷酰胺冲击或多靶点方案诱导治疗,在临床缓解后进入维持治疗期间,患儿出现LN 复发,需警惕难治性LN 可能。
目前难治性LN国内外尚无统一明确的定义,难治性LN 意味着对诱导缓解的治疗反应不足或无反应,为优化LN 的管理,欧洲抗风湿病联盟以及欧洲肾脏病协会-欧洲透析移植协会联合倡议,若经治疗3 ~4 个月内未能改善,6 ~12 个月未达到部分缓解,2 年未达到完全缓解,那么需要考虑难治性LN[6]。结合本例患儿的诊治情况,符合难治性LN。2019 年该患儿在维持治疗期间出现cSLE复发合并TTP,根据2016 年指南[4],为评估肾脏病变活动性以及肾脏病理类型变化情况,重复肾活检提示LN病理分型Ⅲ(A/C),改用MMF以及联合他克莫司多靶点方案治疗,但在泼尼松减量过程中出现LN 复发,cSLE 病情SLEDAI 2000 评估为重度活动,根据2020 年指南,针对激素和免疫抑制剂治疗不耐受或复发的系统性红斑狼疮患者,建议选择生物制剂[7]。
2020 年美国食品药品监管管理局(FDA)获批的贝利尤单抗是一种人源化抗BAFF 特异性IgG1单克隆抗体,能阻止可溶性BLys 与B 细胞上的受体结合,从而抑制B 淋巴细胞增殖分化、减少B 淋巴细胞分泌抗体以及炎症因子,避免脏器的损伤[8-9]。同年,贝利尤单抗获得中国FDA 批准,用于高疾病活动性、自身抗体阳性且≥5 岁接受标准治疗的系统性红斑狼疮患儿[1,10]。本例患儿贝利尤单抗联合多靶点方案治疗长达19 个月,SLEDAI 评分下降,尿蛋白转阴。针对贝利尤单抗联合标准或多靶点疗法治疗24 周或6 个月仍无效的LN 患儿,评估并决策是否继续原方案治疗,关键在于贝利尤单抗长期使用的安全性以及不同个体疗效起效的时间。一项纳入93 例贝利尤单抗治疗cSLE 的随访、安慰剂对照的双盲研究,随访52 周,贝利尤单抗组与安慰组SRI4 应答率分别52.8%、43.6%,严重不良事件报告率分别是17.0%、35.0%[11]。2020 年一项纳入448 例贝利尤单抗治疗LN 患者的多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验,随访104 周,贝利尤单抗组的肾脏疗效反应优于安慰组;肾脏不良事件或死亡风险,贝利尤单抗组低于安慰组[12]。此外,国际上多项评估贝利尤单抗治疗系统性红斑狼疮患者长期安全性的研究显示,随访第8 年,87.7%患者评估SLICC/ACR损伤指数与基线相比没有变化,表明器官损伤发生率极低;随访第13 年,同样表现出良好疗效和耐受性,并提供长期疾病活动性控制[13-15]。
利益冲突 所有作者声明无利益冲突

