有氧运动对精神分裂症大鼠认知功能的改善作用及机制探究
叶乐,李颖芳,李阳
精神分裂症(schizophrenia,SCZ)是以脑组织认知功能损伤为主要特征的一种严重的精神病,具有较高的发病率及致残率,但其病因和发病机制还不明确。近来研究发现,微生物-肠-脑轴在SCZ 中的作用,越来越受到研究者的重视[1]。有氧运动对肠道微生物群具有有益影响,且其可改善SCZ患者及阿尔茨海默症小鼠认知功能,促进大脑神经营养因子表达[2-3]。核转录因子相关因子2(Nrf2)/抗氧化反应元件(ARE)通路激活,可诱导血红素加氧酶-1(HO-1)产生来发挥抗氧化应激作用。研究证实Nrf2/ARE/HO-1 抗氧化途径不仅在缓解神经元损伤、改善认知功能障碍中发挥作用[4],还在肠屏障损伤修复过程中发挥重要作用[5]。本研究建立大鼠SCZ模型,以期阐明SCZ 发生发展的可能机制,并为有氧运动在SCZ 领域的治疗提供新的思路,现报道如下。
1 材料与方法
1.1 实验动物 SPF 级健康SD 雄性大鼠82 只,7~8 周龄,200 ~220 g,大鼠自由饮水喂食,饲养在标准动物房中,温度20 ~26 ℃。所有大鼠购自中国医学科学院医学实验动物研究所,生产许可证号为SCXK (京) 2019-0011,合格证号:1103012 111038179 。本研究获得丽水市第二人民医院伦理委员会批准(批号20220302-02),符合3R 原则。
1.2 主要试剂与仪器 地卓西平马来酸盐(MK-801)(M15913,上海珞珐生化科技有限公司);Nrf2-ARE通路抑制剂-全反式维甲酸(ATRA)(上海联硕宝为生物科技有限公司);细菌内毒素-脂多糖(LPS)试剂盒(CS-10802E,上海莼试生物技术有限公司),神经递质-5-羟色胺(5-HT)试剂盒(IB-E11975,江西艾博因生物科技有限公司),多巴胺(DA)试剂盒(YT30237,上海韵泰信息科技有限公司),白细胞介素-6(IL-6)酶联免疫吸附法(ELISA)试剂盒(HL20064,上海哈灵生物科技有限公司),白细胞介素-1(IL-1 )ELISA 试剂盒(SEKR-0002,北京索莱宝科技有限公司),D-乳酸(D-Lac)试剂盒(KL15282,上海康朗生物科技有限公司),HE 染色试剂盒(HGR6210,青岛捷世康生物科技有限公司),尼氏染色试剂盒和TUNEL 染色试剂盒(YT8907、YT2205,北京伊塔生物科技有限公司),咬合蛋白(occludin)、带状闭合蛋白ZO 家族1(ZO-1)、Nrf2、HO-1、超氧化物歧化酶-2(SOD2)、白细胞介素-1(IL-1 )、白细胞介素-10(IL-10)等抗体(ab216327、ab221547、ab31163、ab52947、ab68155、ab254360、ab192271,美国abcam 公司)。
1.3 分组及处理 随机取62 只大鼠建立SCZ 模型,将造模成功的60 只大鼠,随机分为模型组、有氧运动组、有氧运动+ATRA 组,每组20 只。另取20只大鼠,作为对照组。
造模大鼠腹腔注射地卓西平马来酸盐(MK-801)0.5 mg·kg1·d1,连续14 d,建立SCZ 模型。采用旷场实验方法记录大鼠自主活动及排便状况,若大鼠在远离场壁的暴露中心区域活动增加,且排便减少,视为大鼠出现探索行为减少,抑郁样行为增加等SCZ 症状,认为造模成功,共60 只大鼠造模成功。
大鼠造模成功后,有氧运动组大鼠每天固定时间在中等强度跑台训练,每次20 min,连续进行6周,每周休息1 d,大鼠运动后还需腹腔注射相应剂量0.9%氯化钠注射液。有氧运动+ATRA 组大鼠有氧运动后腹腔注射相应剂量的Nrf2-ARE 通路阻断剂40 mg/kg,1 次/d。模型组及对照组大鼠腹腔注射给予等量0.9%氯化钠注射液。各组连续干预6 周后,收集大鼠最后1 d 粪便,并进行后续试验。
1.4 观察指标
1.4.1 行为学及认知功能 粪便检测后进行旷场实验:将大鼠分别放置在陌生平台区域(100 cm×100 cm×100 cm),自由探索6 min,用自动视频跟踪系统记录大鼠在5 min 于平台中心区域(平台内表面积的25%)和外围区域(中心外部)的自发活动距离。水迷宫试验探究其认知功能:将大鼠置于圆形水池(直径160 cm,高50 cm,水深25 cm),水温及室温(24±1)℃,水池分4 个象限,第1 象限据池壁35 cm设置直径12 cm、高22 cm,距水下3 cm 的圆形黑色逃生平台,将大鼠放置第3 象限内,用SMART 数字跟踪系统记录大鼠找到平台的时间,即逃避潜伏期,记录大鼠在60 s 内穿越原平台象限次数。
1.4.2 脑海马组织神经元 行为学实验结束后,随机取6 只大鼠处死后取小肠组织及海马组织,分别分成两部分,一部分置于 80 ℃冰箱保存备用,另一部分置于4%多聚甲醛溶液中固定24 h 后,脱水、石蜡包埋,切成5m 切片。海马组织石蜡切片,脱蜡水化后,分别按尼氏及TUNEL染色试剂盒说明书方法进行染色,并于光镜下观察神经元损伤及凋亡状况。TUNEL 染色切片,用Image-pro plus 软件测棕黄色染色细胞(凋亡细胞)数目,测神经元细胞凋亡率,细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.4.3 血浆LPS、血清炎症因子及神经递质水平取大鼠腹主动脉血2 ml,按ELISA 说明书方法检测血浆LPS水平;另取大鼠腹主动脉血2 ml,按ELISA说明书方法检测血清炎症因子IL-6、IL-1 水平,及神经递质5-HT、DA 水平。
1.4.4 肠屏障 小肠组织石蜡切片按HE 试剂盒说明书方法染色后,于光镜下观察小肠炎症和肠黏膜厚度变化,以评估肠道完整性。取相同部位石蜡切片,脱蜡及透化后,加入一抗(occludin、zonula,1∶200)4 ℃孵育24 h,二抗山羊抗兔免疫球蛋白-G(1∶500)室温孵育1 h,于显微镜下拍照观察,Image J软件分析肠管腔阳性染色情况,以评估肠黏膜屏障结构损伤状况。
1.4.5 肠屏障及血脑屏障通透性 各组大鼠随机取5 只,经尾静脉注射2%EB(3 ml/kg),1 h 后将大鼠处死,取脑皮质组织,均浆后取匀浆液,在620 nm 波长下测EB吸光度值,并计算EB含量,以评估血脑屏障通透性。再随机取5 只大鼠,取腹主动脉血,测D-Lac水平;将大鼠禁食禁水4 h 后,给予400 mg/kg FITCDextran 灌胃4h 后取血,3500r/min 条件下离心10min后,取血浆25l,在488nm 激发波长、525nm 发射光波长下,检测荧光强度,并计算FITC-Dextran 浓度,用D-Lac 及FITC-Dextran 水平,评估肠道通透性变化。
1.4.6 肠道菌群 处死各组剩余4 只大鼠,于无菌条件下摘取肠系膜淋巴结及脑组织,称取相同重量后用无菌0.9%氯化钠注射液冲洗干净,在无菌组织匀浆器中研磨,加入无菌0.9%氯化钠注射液制成1 ml匀浆液。取100l 匀浆液,接种于麦康凯培养基平板上,在恒温箱中培养24 h,用哥伦比亚血平板分离培养,用VT2 compact 鉴定,组织匀浆中培养出3 个或以上肠道菌落即为发生肠道菌移位,计数肠道及脑组织内发生肠道菌移位情况。
1.4.7 小肠及海马组织Nrf2、HO-1、SOD、IL-1 、IL-10 蛋白表达 取 80 ℃保存的小肠组织及海马组织,4℃解冻后,加入细胞裂解液均浆,蛋白提取试剂盒分别轴提细胞中总蛋白及细胞核中总蛋白,用BCA法测蛋白浓度,取25g蛋白样品行电泳、转膜反应,加入一抗Nrf2(检测细胞核中蛋白)、HO-1、SOD、IL-1 、IL-10 抗体(1∶1 000),内参抗体-actin(1∶1 000),4℃下孵育过夜;加入二抗(1∶2 000)室温孵育2 h。增强化学发光法显色,用化学发光成像分析仪拍照并分析灰度值,计算蛋白相对表达水平。
1.5 统计方法 用SPSS 24.0 及GraphPad Prism 8行统计学分析,计量资料用均数±标准差表示,多组比较采用方差分析,多重比较采用SNK-q 检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 4 组大鼠行为学及认知功能比较 4 组远离中心活动距离、穿越原平台象限次数、逃避潜伏期差异均有统计学意义(F≥102.321,均P <0.05)。与对照组相比,模型组大鼠在旷场中心区域活动增多,远离中心活动距离、穿越原平台象限次数降低(q≥20.759,均P <0.05),逃避潜伏期延长(q=29.269,P<0.05);与模型组相比,有氧运动组大鼠在旷场中心区域活动较少,远离中心活动距离、穿越原平台象限次数增加(q≥7.379,均P <0.05),逃避潜伏期缩短(q=17.806,P<0.05);与有氧运动组相比,有氧运动+ATRA组大鼠在旷场中心区域活动增加,远离中心活动距离、穿越原平台象限次数降低(q≥8.675,均P <0.05),逃避潜伏期延长(q=19.576,P <0.05),见图1。

图1 4 组大鼠行为学及认知功能比较
2.2 4 组大鼠海马神经元损伤及凋亡情况比较 尼氏染色可见,对照组大鼠海马神经元细胞形态正常,模型组大鼠海马神经元细胞肿胀,胞核浓缩且深染,神经元丢失和坏死严重;TUNEL染色可见模型组大鼠海马神经元细胞染色加深,凋亡严重。4 组海马神经元凋亡率差异有统计学意义(F=340.707,P <0.05)。与模型组相比,有氧运动组大鼠凋亡率降低(q=19.373,P <0.05);与有氧运动组相比,有氧运动+ATRA组大鼠凋亡率增加(q=18.075,P<0.05),见图2。
2.3 4 组大鼠血浆LPS、血清炎症因子及神经递质比较 4 组LPS、DA、5-HT、IL-6、IL-1 水平差异均有统计学意义(F≥39.976,均P <0.05)。与对照组相比,模型组LPS、DA、5-HT、IL-6、IL-1 水平均升高(q≥11.853,均P <0.05);与模型组相比,有氧运动组均降低(q≥8.768,均P <0.05);与有氧运动组相比,有氧运动+ATRA 组均升高(q≥9. 218,均P <0.05),见图3。
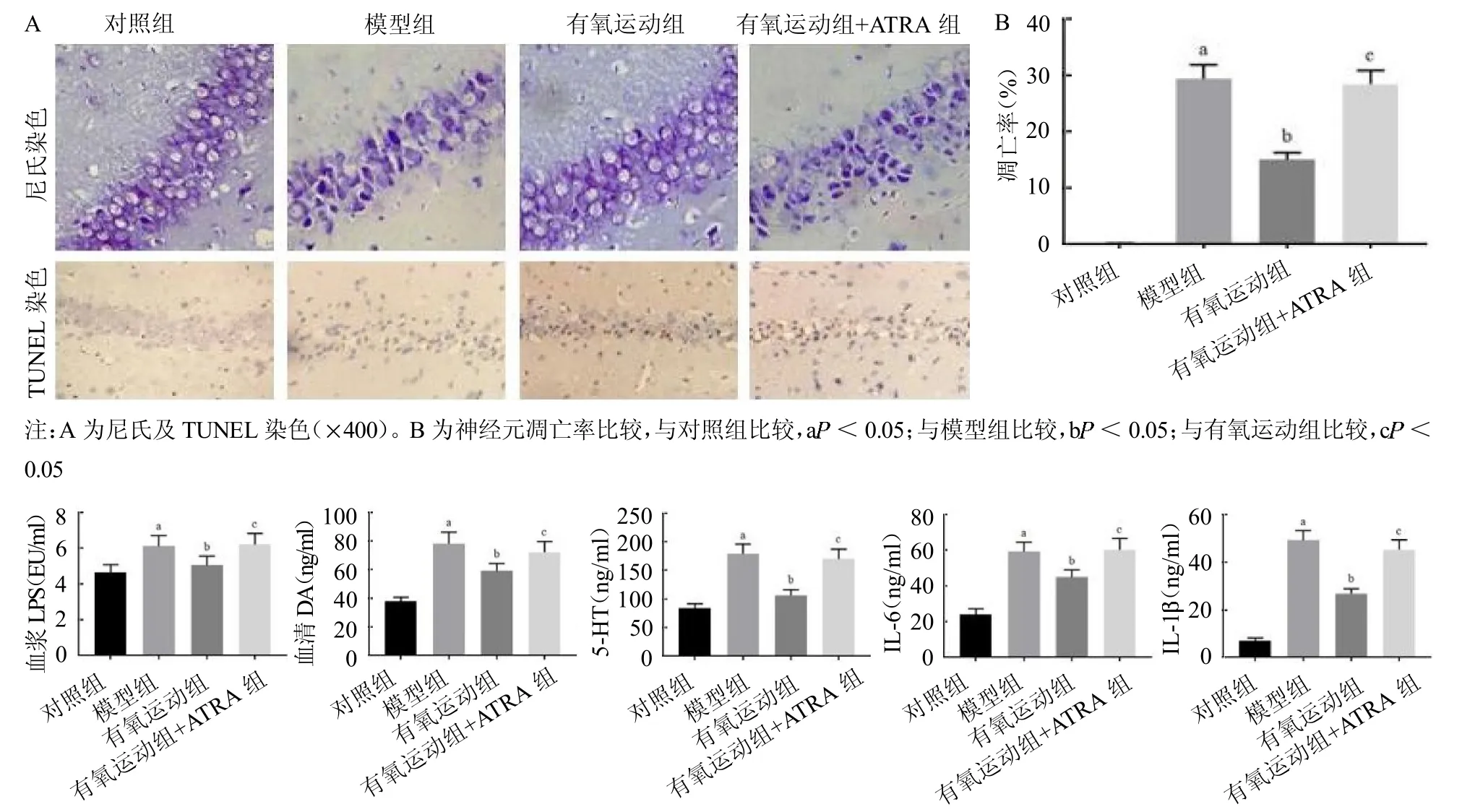
图3 4 组大鼠LPS、DA、5-HT、IL-6、IL-1 水平比较
2.4 4 组大鼠肠屏障损伤情况比较 对照组大鼠肠组织结构正常,肠道紧密连接相关蛋白ZO-1 及occludin蛋白可在细胞膜外及胞质内呈强阳性(棕黄色颗粒沿膜连续分布)表达;模型组大鼠可见肠绒毛萎缩、水肿及变形、肠隐窝加深及炎症细胞浸润等病理损伤严重,肠道棕黄色颗粒染色变浅且分布不连续,ZO-1 及occludin 呈弱阳性表达。4 组ZO-1、occludin阳性表达差异均有统计学意义(F≥209.570,均P <0.05)。与模型组相比,有氧运动组ZO-1 及occludin阳性表达升高(q≥12.318,均P <0.05);与有氧运动组相比,有氧运动+ATRA 组ZO-1 及occludin 阳性减弱(q≥11.438,均P <0.05),见图4。
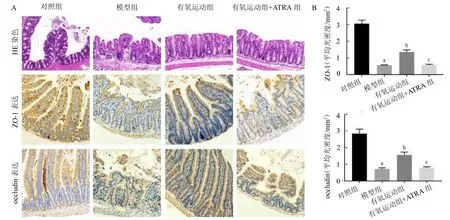
图4 4 组大鼠肠屏障损伤情况比较
2.5 4 组大鼠肠通透性及血脑屏障通透性比较 4组FITC-Dextran、D-Lac 及EB 水平差异均有统计学意义(F≥27.954,均P <0.05)。与对照组相比,模型组血浆FITC-Dextran 浓度及D-Lac 水平、脑组织EB 水平均升高(q≥11.083,均P <0.05);与模型组相比,有氧运动组均降低(q≥6.130,均P <0.05);与有氧运动组相比,有氧运动+ATRA 组均升高(q≥5.836,均P <0.05),见图5。
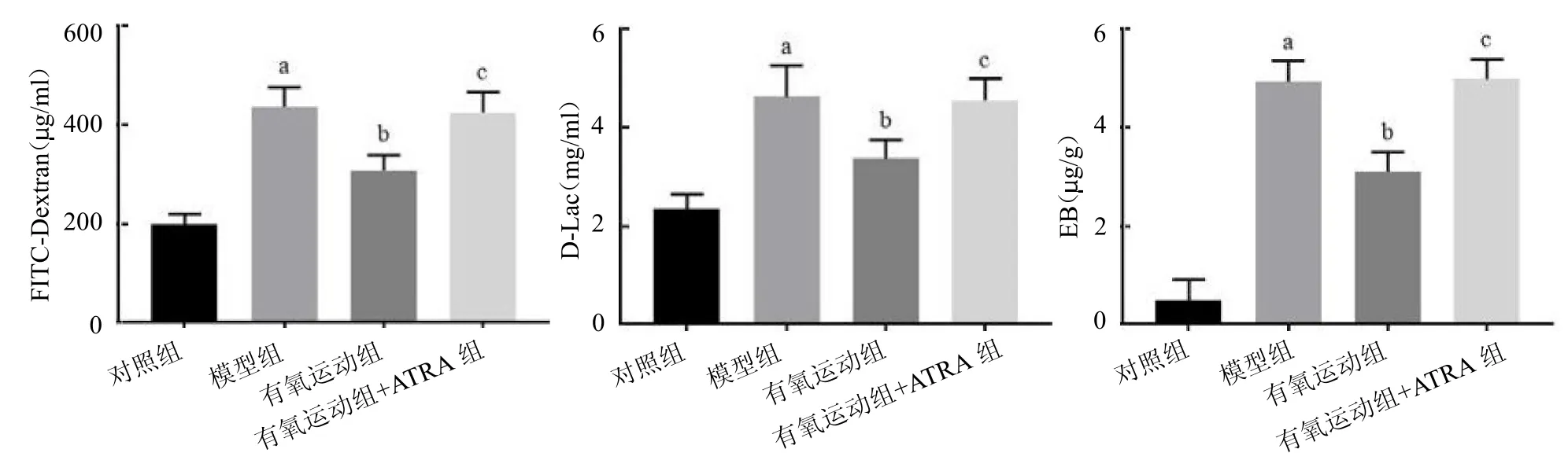
图5 4 组大鼠FITC-Dextran、D-Lac 及EB 水平比较
2.6 4 组大鼠肠、脑组织器官菌群移位比较 4 组肠道细菌在肠和脑组织中移位阳性个数差异均有统计学意义(F≥191.852,均P <0.05)。与对照组比较,模型组肠道细菌在肠和脑组织中移位阳性个数升高(q≥27.530,均P <0.05);与模型组相比,有氧运动组移位阳性个数降低(q≥17.889,均P <0.05);与有氧运动组相比,有氧运动+ATRA组移位阳性个数升高(q≥14.907,均P <0.05),见图6。
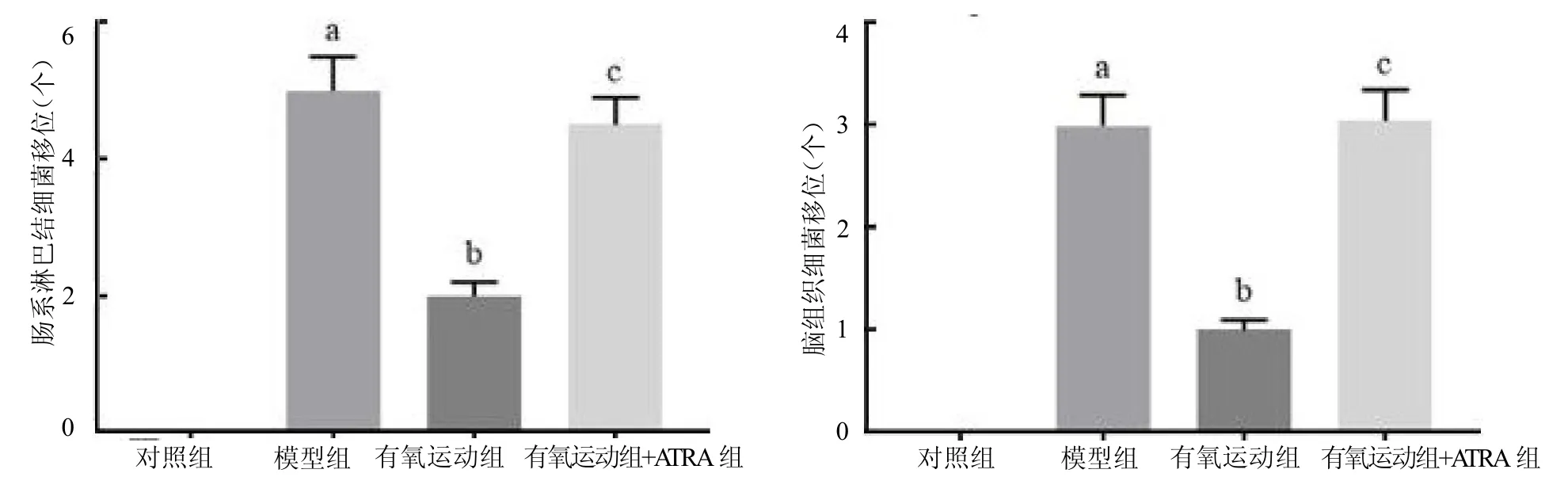
图6 4 组大鼠肠道细菌移位阳性个数比较
2.7 大鼠小肠、海马组织中Nrf2/ARE/HO-1 通路蛋白及SOD、IL-1 、IL-10 蛋白表达 4 组小肠、海马组织中Nrf2、HO-1、SOD、IL-1 、IL-10 蛋白表达差异均有统计学意义(F≥34.183,均P <0.05)。与对照组比较,模型组小肠、海马组织细胞核中Nrf2 蛋白表达、细胞胞浆中HO-1、SOD、IL-1 、IL-10 蛋白表达升高(q≥7.380,均P <0.05);与模型组比较,有氧运动组蛋白表达升高(q≥5.134,均P <0.05);与有氧运动组比较,有氧运动+ATRA组蛋白表达降低(q≥5.300,均P <0.05),见图7。
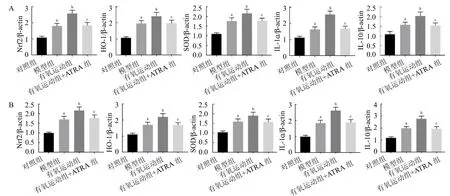
图7 4 组大鼠蛋白表达比较
3 讨论
研究发现,SCZ 认知功能减退与中枢神经系统海马神经元变性有关[6]。有氧运动可增强记忆功能和反应速度,延缓大脑皮质的萎缩,减少海马体积损失,从而维持认知功能的稳定性[7]。本研究发现,有氧运动干预后SCZ 大鼠认知及学习障碍缓解,海马神经元损伤及凋亡也明显缓解,这提示有氧运动有利于缓解SCZ 海马神经元损伤及认知功能障碍。
有研究发现SCZ 患者肠道内存在微生物菌群的多样性及丰度的改变[1]。肠道菌群及代谢产物如LPS 等释放增加,会刺激肠黏膜释放炎症性细胞因子增加,改变肠道屏障的通透性,进而导致肠道菌株产生的神经递质通过肠黏膜屏障及肠道神经系统传入大脑,作用于神经元,影响认知功能改变引起脑损伤[8-9]。本研究发现,模型组大鼠肠道屏障及通透性改变,肠道菌群移位及释放的神经递质、炎性因子增加,通过有氧运动干预后发现大鼠肠黏膜通透性及屏障损伤缓解,血浆LPS、血清中炎性因子及神经递质水平降低,血脑屏障通透性改变也显著缓解,这提示有氧运动也可改善SCZ 大鼠肠道屏障损伤作用。
Nrf2/ARE/HO-1 为机体抗应激损伤的重要通路。机体在受到炎性及氧化应激等损伤后,会刺激Nrf2 与ARE 结合,并促进抗氧化蛋白类基因如SOD、及抗炎类因子如IL-1 表达来发挥抗应激损伤;另外Nrf2/ARE 活化,还可上调HO-1 表达,发挥抗炎、抗氧化、抗凋亡作用,来保护组织免受损伤[10]。有研究显示激活Nrf2/ARE/HO-1 通路可促进SCZ大鼠抗氧化酶含量,缓解氧化应激,改善大鼠认知功能,从而缓解精神分裂[11]。本研究发现有氧运动组大鼠肠-脑轴组织中出现Nrf2/ARE/HO-1 通路及其抗炎、抗氧化途径的激活,提示有氧运动发挥肠-脑轴保护作用,可能与激活Nrf2/ARE/HO-1 通路及其介导的抗炎、抗氧化途径有关,而ATRA可减弱有氧运动的上述作用。
利益冲突 所有作者声明无利益冲突
作者贡献声明 叶乐:实验设计和操作、论文撰写;李颖芳:数据整理、统计学分析;李阳:研究指导、论文修改

