1-磷酸鞘氨醇受体3 对脂多糖处理大鼠肾小管上皮细胞凋亡的影响
吴晋,应静
脓毒症相关急性肾损伤(sepsis-associated acute kidney injury,S-AKI)是指原无肾损伤的患者在发生脓毒症后出现包括血、尿指标异常,以及组织学或影像学可见的实质性肾损伤[1-2]。与其他病因引起的AKI 相比,S-AKI 死亡风险高出6 ~8 倍[3]。1-磷酸鞘氨醇受体(sphingosine-1-phosphate receptor,S1PR)是一类七次跨膜的G 蛋白偶联受体,与1-磷酸鞘氨醇结合,启动细胞跨膜信号转导效应。S1PR3作为S1PRs 家族中一个主要成员,在成年鼠以及人体多种器官、组织和细胞中广泛表达[4]。本研究用脂多糖(LPS)处理大鼠肾小管细胞来建立S-AKI 细胞模型,观察S1PR3 动态变化,来探讨S1PR3 介导的信号通路在S-AKI 上的作用及机制,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂 大鼠肾小管细胞(NRK-52E)购自上海中科院细胞库。试剂主要有DMEM/F12 细胞培养液(美国Gibco 公司),LPS(美国SIGMA 公司),S1PR3 激动剂KRX-725(上海吉尔生化有限公司),青霉素钠、硫酸链霉素(大连美仑生物),CCK8试剂盒、Annexin V-FITC/PI apoptosis kit、Goat anti-Mouse IgG、Goat anti-Rabbit IgG、-Actin(杭州联科生物公司),0.45m PVDF 膜(Millipore 公司),彩色预染蛋白分子量标准(Fermentas 公司),ECL Plus 发光试剂盒、SDS-PAGE 蛋白上样缓冲液(×5)、Western 及IP 细胞裂解液、PMSF、BCA 蛋白浓度测定试剂盒、GreenNuc™活细胞caspase-3 活性检测试剂盒(碧云天公司),ELISA检测试剂盒(江莱生物公司),钙离子检测试剂(美国Molecular Probes 公司)。
1.1.2 仪器 二氧化碳培养箱3111 型(Thermo 公司),倒置显微镜IX73 型(Olympus 公司),全波长酶标仪SpectraMax Plus 384 型(美国MD),流式细胞仪(美国BD 公司),涡旋振荡仪QL-861 型(海门市其林贝尔仪器制造有限公司),电泳系统、凝胶成像仪(美国Bio-RAD 公司),移液器(德国Eppendorf 公司),台式高速冷冻离心机(湖南湘仪实验仪器公司),台式低速离心机(湖南凯达实业公司),微光分光光度计(美国Merinton 公司)。
1.2 方法
1.2.1 NRK-52E 细胞培养 NRK-52E 细胞株常规培养在含有5%胎牛血清和1×青链霉素的DMEM/F12 中,培养条件为37 ℃、5%CO2的湿润无菌环境,每4 ~5 天换液传代1 次。
1.2.2 建立脓毒症细胞模型 将NRK-52E细胞分为对照组及LPS 组。对照组为空白组,不予处理。LPS组予LPS(20g/ml)刺激不同时间(12、24 及36h)后分别离心收集待检。上述细胞分组收集好后做CCK8 检测细胞活力,筛选出最佳LPS 作用时间(刺激12 h)。
1.2.3 实验分组及预处理 将细胞分为对照组、LPS组、S1PR3 激动剂+LPS 组。对照组不予处理;LPS 组予LPS(20g/ml)刺激12h后做离心收集待检;S1PR3激动剂+LPS 组先用S1PR3 激动剂KRX-725 预处理2h后再予LPS(20g/ml)刺激12h后做离心收集待检。
1.2.4 流式细胞术检测NRK-52E 细胞凋亡差异各组取培养好NRK-52E 细胞,以3×105/孔接种于6孔板中,按各组要求做好预处理后,用无EDTA的胰酶消化离心收集细胞,1×PBS 洗涤细胞两次(1 000 r/min,离心时间5 min 收集细胞),用500l 1×Binding Buffer 悬浮细胞,在细胞悬浮液中加入5l Annexin V-FITC 和10l PI,并设置单染管,轻轻混匀后于4 ℃避光条件下孵育5 min,上机检测。
1.2.5 Western Blot 检测S1PR3 蛋白表达 将细胞分组并预处理后加入细胞裂解液,分别离心提取总蛋白。将样品加入5×上样缓冲液混匀,100 ℃放置10 min,迅速冰浴中冷却,上样量为每泳道约30g,在10%SDS-PAGE凝胶中电泳后电转于硝化纤维素薄膜上。封闭、PBS 洗膜3 次后加入相应的一抗,4℃孵育过夜,洗膜3 次后,加入辣根过氧化物酶标记的二抗,室温孵育1 h。PBS 洗膜3 次后应用化学发光系统显色凝胶成像仪放射自显影,并分析电泳条带的灰阶密度值。
1.2.6 流式细胞术检测NRK-52E 细胞钙离子表达取培养好的细胞,以3×105/孔接种于6 孔板中,按各组要求做好预处理后,用无EDTA 的胰酶消化离心收集细胞,1×PBS 洗涤细胞两次(1 000 r/min,离心时间5 min 收集细胞),用培养基重悬细胞,DMSO溶解Fluo4-AM 母液,使用时用PBS 稀释1 000 倍加入装有细胞的EP 管中,37 ℃,避光30 min;离心500 g,5 min,弃掉上清,PBS 重悬细胞,上机检测。
1.2.7 ELISA 检测Calpain 1 及Calpain 2 的表达取培养好的细胞,按照Calpain 1、Calpain 2 ELISA试剂盒说明书操作,用全自动酶标仪测定450 nm 波长处的OD 值,通过绘制标准曲线得出的浓度。
1.2.8 流式细胞术检测NRK-52E 细胞caspase-3 表达 取培养好的细胞,以3×105/孔接种于6 孔板中,按各组要求做好预处理后,用无EDTA 的胰酶消化离心收集细胞,1×PBS 洗涤细胞两次(1 000 r/min,离心时间5 min 收集细胞),用培养基重悬细胞,使细胞浓度在106/ml;吸取200l 于流式检测管,加入1l 的底物,立即混匀使底物浓度为5mol/L,室温避光孵育30 min,加入300l培养基,上机检测。
1.3 统计方法 采用GraphPadPrism 统计软件,计量资料采用均数±标准差表示,多组间比较采用F 检验,多重比较采用LSD-t 检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 NRK-52E细胞凋亡率比较 NRK-52E细胞凋亡率对照组为(1.99±0.35)%,LPS 组为(13.50±0.69)%,S1PR3 激动剂+LPS 组为(21.69±0.81)%,3 组差异有统计学意义(F=2107.60,P <0.05),其中LPS 组明显高于对照组(t=44.63,P <0.05),S1PR3 激动剂+LPS 组明显高于LPS 组(t=23.09,P <0.05)。
2.2 NRK-52E 细胞 S1PR3 蛋白表达比较 NRK-52E 细胞S1PR3 蛋白灰度值比值对照组为0.39±0.11,LPS组为0.78±0.07,S1PR3激动剂+LPS组为0.92±0.04,3 组差异有统计学意义(F=36.50,P<0.05),其中LPS 组明显高于对照组(t=5.18,P <0.05),S1PR3 激动剂+LPS 组明显高于LPS 组(t=3.01,P <0.05),见图1。

图1 3 组Western Blot 检测S1PR3 蛋白表达电泳条带
2.3 NRK-52E 细胞钙离子表达比较 NRK-52E 细胞钙离子表达相对荧光强度对照组为100.00±6.14,LPS 组为371.43±11.20,S1PR3 激动剂+LPS 组为604.36±7.09,3 组差异有统计学意义(F=8061.53,P<0.05),其中LPS组明显高于对照组(t=63.75,P<0.05),S1PR3 激动剂+LPS 组明显高于LPS 组(t=52.72,P <0.05)。
2.4 NRK-52E 细胞Calpain 1 及Calpain 2 表达LPS 组Calpain 1 及Calpain 2 水平明显高于对照组(t=38.37、45.06,均P <0.05),S1PR3 激动剂+LPS 组Calpain 1 及Calpain 2 水平明显高于LPS 组(t=13.79、58.60,均P <0.05),见表1。
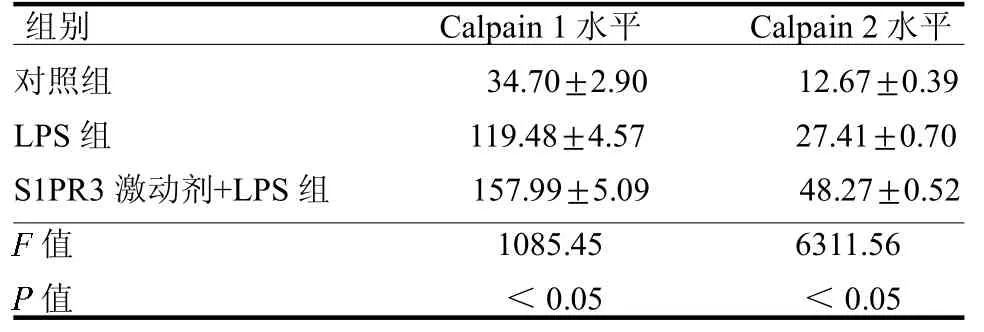
表1 3 组Calpain 1 及Calpain 2 表达水平比较 ng/ml
2.5 NRK-52E 细胞caspase-3 表达比较 NRK-52E细胞 caspase-3 表达相对荧光强度,对照组为100.00±3.55,LPS 组为357.05±8.99,S1PR3 激动剂+LPS 组为666.36±24.88,3 组差异有统计学意义(F=3047.71,P <0.05),其中LPS 组明显高于对照组(t=79.78,P <0.05),S1PR3 激动剂+LPS 组明显高于LPS 组(t=35.08,P <0.05)。
3 讨论
S-AKI 是危重患者不良预后的独立危险因素,与非脓毒症致AKI及单纯脓毒血症患者相比,S-AKI患者死亡率显著增加[5]。笔者以往研究采用盲肠结扎穿刺术建立了脓毒症小鼠模型,发现脓毒症小鼠出现了明显的肾脏损伤,存活率显著下降[6-7]。本研究结果显示,在细胞层面上同样观察到脓毒症NRK-52E 细胞模型凋亡率显著增加。
脓毒症造成肾脏损伤机制还不完全明了,认为与炎性介质、凝血功能异常、肾缺血再灌注、内毒素、细胞坏死和细胞凋亡等因素有关。Sun 等[8]发现,患有脓毒症相关的急性呼吸窘迫综合征的患者体内S1PR3 启动子发生变异,导致S1PR3 蛋白表达下降。还有研究认为S1PR3 是参与脓毒症过程巨噬细胞清除细菌的关键分子,具有双面性,既能够增强巨噬细胞体氧依赖和非氧依赖杀菌能力,从而增强脓毒症小鼠抗感染能力,改善生存率;也能通过拮抗S1PR3 来抑制肺巨噬细胞的核因子NF- B 的活性,下调肺巨噬细胞炎症反应水平,从而起到脓毒症肺保护的作用[9-10]。Sammani 等[11]认为在LPS 介导的脓毒症急性肺损伤模型中,过度活化的S1PR3 会促进肺泡或血管内皮细胞通透性增加,加重肺的炎性损伤,而敲除S1PR3 则使内皮细胞通透性降低。因此以S1PR3 为基因靶点的个体化治疗脓毒症及相关的并发症具有重要临床意义,但是S1PR3 在S-AKI 上的作用及其机制,目前国内外尚未见到相关报道。
本研究结果显示,与对照组相比,LPS组细胞凋亡率显著增加,S1PR3 表达显著增加,说明脓毒症细胞模型建立成功,且脓毒症NRK-52E 细胞中S1PR3的表达是显著增加的。经过S1PR3 激动剂预处理后,脓毒症NRK-52E 细胞内S1PR3 蛋白表达水平显著增加,细胞凋亡率显著增加,说明S1PR3 过度激活后能加重细胞凋亡。
研究认为,S1PR3 激活能引起血管平滑肌细胞内钙离子浓度上升[12-13],而使用S1PR3 阻断剂TY-52156 可以抑制细胞内钙离子浓度上升[14]。细胞内微摩尔级浓度的钙离子可以激活钙依赖性蛋白酶Calpain-1,毫摩尔级浓度的钙离子可以激活Calpain-2。Calpains 参与机体多种细胞的凋亡[15-16]。激活Calpain-1 可直接降解caspase-12,进而激活细胞凋亡最终执行环节的关键分子caspase-3,引起细胞凋亡[17]。激活的Calpain-1 还可以剪切促凋亡因子Bid使之激活,Bid活性增加,破坏了与抗凋亡因子Bcl-2的平衡,通过激活线粒体凋亡通路引起凋亡[18]。在肾细胞中,caspase-3 的激活需要Calpains-1、2 作用。使用钙依赖性蛋白酶抑制剂处理,可以减少肾小管细胞的死亡率和caspase-3 的活性[19]。因此Calpains-1、2 可能位于caspase-3 细胞凋亡的信号通路的上游。本研究发现,相比于对照组,LPS 组细胞内S1PR3 表达显著增加,钙离子浓度显著增加,Calpain 1、Calpain 2 水平以及凋亡关键蛋白caspase-3 活性显著升高;而随着加入S1PR3 激动剂后,S1PR3 进一步激活,表达增加,导致脓毒症NRK-52E 细胞内钙离子浓度又继续增加,Calpain 1、Calpain 2 水平以及caspase-3 活性继续升高,最终表现为细胞凋亡又进一步加重。
利益冲突 所有作者声明无利益冲突
作者贡献声明 吴晋:实验操作、论文撰写、数据整理、统计学分析;应静:研究指导、论文修改、经费支持

