甲状腺功能亢进及甲状腺功能减退诱发老年骨质疏松的机制分析
刘 瑶,秦 迪,刘东明,王 岩,陈 雷,黄丽红*
(1.吉林大学中日联谊医院 老年病科,吉林 长春130033;2.内蒙古民族大学附属医院 内分泌科,内蒙古自治区 通辽028000;3.吉林大学中日联谊医院 科研中心,吉林 长春130033;4.白城市医院 急诊科,吉林 白城137000)
骨质疏松症(osteoporosis,OP)作为一种以骨量低、骨组织微结构损坏进而导致骨脆性增加、易发生骨折为特征的全身性骨病,同时也是最常见与增龄相关的骨骼疾病[1-2]。随着人口老龄化,老年骨质疏松的发病率逐年上升,对于老年人的危害不容小觑[3-4]。在发育、线性生长和成人骨骼转换和维护中,甲状腺激素起到了关键作用,甲状腺激素失衡造成的甲状腺功能异常则会影响到骨骼的稳态[5-6]。甲亢(甲状腺功能亢进)状态下,骨转换升高,重塑时间缩短;相反甲减(甲状腺功能减退)则会导致骨转换降低,骨重塑周期延长,这些使得骨形成和骨吸收之间的差异导致了骨量的负平衡[7]。由此可见,无论是甲亢或甲减,均可能会出现骨密度减低,并有骨质疏松甚至骨折的风险[6]。本文采用挖掘并预测甲状腺功能亢进及甲状腺功能减退与老年骨质疏松之间的交集靶点基因以及相关信号通路,旨在通过生物信息学方法去分析他们之间的潜在机制并对未来治疗策略提供新思路。
1 材料与方法
1.1 获取老年骨质疏松差异表达基因
老年骨质疏松基因表达谱下载于公共基因表达数据库(Gene Expression Omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo/),数据集为GSE35958,该数据集收录了9例骨髓样本,包括原发性老年骨质疏松5例和与年龄匹配的对照组4例;数据集通过应用GEO2R来分析病例组与对照组之间的差异表达基因(DEGs),从而获得老年骨质疏松相关DEGs,运用Origin软件绘制差异表达火山图。
1.2 筛选老年骨质疏松-甲亢、老年骨质疏松-甲减共靶点基因
通过人类基因综合数据库GeneCards (https://www.genecards.org/)和人类孟德尔遗传在线数据库 (Online Mendelian Inheritance in Man,OMIM)(https://www.genecards.org/) 分别搜索“osteoporosis”,“hyperthyroidism”,“hypothyroidism”获取骨质疏松、甲亢及甲减疾病的相关靶点基因(检索时间为建库至2022年12月),并将搜索得到的骨质疏松、甲亢及甲减靶点基因与2.1得到的老年骨质疏松DEGs整合并删除重复靶点后得到交集靶点基因,并以韦恩图的形式绘制出来。
1.3 功能富集分析
为了描述靶点基因的功能角色,将2.2获得的交集靶点基因用R语言对其筛选,进行基因本体(gene ontology,GO)、京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,并将前5个富集结果进行可视化。
1.4 构建PPI 网络和筛选关键基因
将1.2获得的交集靶点基因借助交互基因检索工具(Search Tool for the Retrieval of Interacting Genes,STRING)(https://cn.string-db.org/),物种选择人类(Homo spaiens),可信度设置为中等可信(medium confidence 0.400),隐藏网络中已断开的节点,从而分别构建老年骨质疏松与甲亢、老年骨质疏松与甲减之间的交集靶点基因的蛋白质-蛋白质间相互作用(Protein-Protein Interaction,PPI)网络,并应用Cytoscape软件进行可视化,并按照连接度值(Degree)筛选PPI网络连接度前 5位的关键基因(hub genes)。
2 结果
2.1 老年骨质疏松差异表达基因
将老年骨质疏松数据集GSE35958中的老年骨质疏松组和对照组根据|logFC|>1、P-value<0.05 的筛选标准得出相应的DEGs,运用 Origin软件对差异表达结果进行火山图绘制,结果显示老年骨质疏松DEGs共有7359个,其中低表达基因有 1429个,高表达基因有 5930 个,见图1。
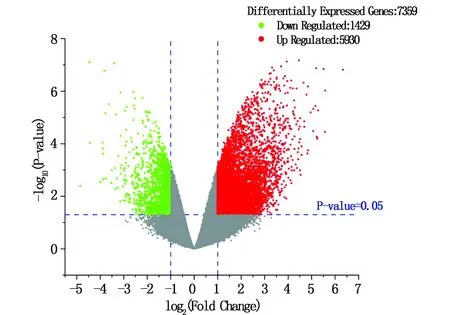
图1 老年OP差异表达基因火山图
2.2 老年骨质疏松-甲亢、老年骨质疏松-甲减交集靶点基因
GeneCards及 OMIM 在线数据库(将GeneCards数据库得到的基因进行关联分数(relevance score) >1筛选)中搜索并筛选得出的骨质疏松、甲亢及甲减3种疾病相关靶点数量为1688、440、1094,并将其骨质疏松基因靶点和老年骨质疏松DEGs分别与甲亢、甲减靶点进行匹配映射,最终得到67和126个交集靶点基因,见图2,图3。

图2 老年OP与甲亢靶点基因交集韦恩图

图3 老年OP与甲减靶点基因交集韦恩图
2.3 功能富集分析
将1.2得出的交集靶点基因利用R语言软件分别进行GO分析及KEGG分析。对于甲亢相关老年骨质疏松的靶点基因GO富集前5名结果显示,在生物学过程中 (biological process,BP),这些基因主要富集于腺体发育、骨化作用、白细胞-细胞黏附、细胞黏附的正性调控、白细胞迁移等;在细胞组分(cellular component,CC) 方面主要富集于内质网腔、质膜的外侧面、血浆脂蛋白颗粒、脂蛋白粒子、脂蛋白复合物等;在分子功能方面 (molecular function,MF),主要富集于受体配体活性、信号受体激活剂活性、蛋白酶结合、生长因子结合、脂蛋白颗粒结合等;KEGG通路富集前5结果显示,其主要集中在Ⅰ型糖尿病、糖尿病并发症中的AGE-RAGE信号通路、人类T细胞白血病病毒Ⅰ型感染、移植物抗宿主病、EGFR酪氨酸激酶抑制剂耐药性等,见图4。

图4 GO富集分析与KEGG通路分析气泡图
而对于甲减相关老年骨质疏松的靶点基因,GO富集前5名结果显示,在生物学过程中,这些基因主要富集于腺体发育、细胞黏附的调控、组织重构、上皮细胞增殖、细胞因子产生的正向调控等;细胞组分方面,基因主要富集于质膜的外侧面、内质网腔、包被囊泡、细胞顶端部分、血浆脂蛋白颗粒等;分子功能方面,这些基因主要富集于RNA聚合酶II-特异DNA结合转录因子结合、DNA结合转录因子结合、核受体结合、生长因子结合、外源蛋白结合等;KEGG通路富集前5名结果显示,其主要富集在糖尿病并发症中的AGE-RAGE信号通路、T17细胞分化、人类T细胞白血病病毒Ⅰ型感染、癌症中的蛋白聚糖、人巨细胞病毒感染等,见图5。
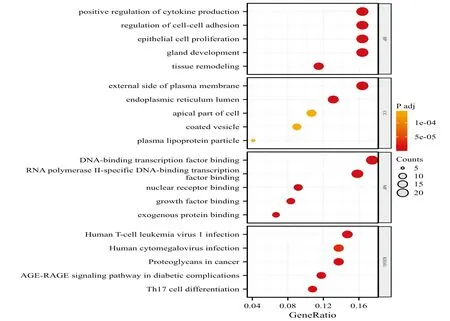
图5 GO富集分析与KEGG通路分析气泡图
2.4 PPI 网络互作及关键基因
将1.2得出的交集靶点基因分别导入STRING数据库,得到蛋白互作网络图,应用Cytoscape软件,分别得出Degree排名前5的hub genes。甲亢相关老年骨质疏松的关键基因有TNF(tumor necrosis factor,degree=39),AKT1(AKT1 substrate 1,degree=36),ALB(albumin,degree=36),CD4(CD4 molecule,degree=30),IL-2(interleukin 2,degree=27);甲减相关老年骨质疏松的关键基因有ALB(albumin,degree=62),AKT1(AKT1 substrate 1,degree=58),TP53(tumor protein p53,degree=57),TNF(tumor necrosis factor,degree=57),CTNNB1(catenin beta 1,degree=53),见图6,图7,表1,表2。

表1 甲亢相关老年OP前5关键基因

表2 甲减相关老年OP前5关键基因
3 讨论
随着全球人口老龄化的到来,骨质疏松症作为退行性疾病发病率不断上升,已成为世界范围内备受关注的主要健康问题。甲状腺激素作为维持骨骼结构和强度方面的一个必不可少的因素,当发生甲状腺功能异常(如甲亢或者甲减)时,可成为导致骨病的一个危险因素,然而甲状腺激素过多或不足在老年骨质疏松发病中的作用一直被低估,其潜在发病机制尚不清楚[7]。本文借助生信数据去探讨甲亢、甲减与老年骨质疏松之间可能的关联机制及分子治疗靶点。本研究发现了可能参与甲亢诱发的老年骨质疏松67个靶点基因以及参与甲减诱发的老年骨质疏松126个靶点基因。甲亢、甲减与老年骨质疏松之间相互作用的信号通路主要涉及人类T细胞白血病病毒Ⅰ型感染、糖尿病并发症中的AGE-RAGE信号通路、Ⅰ型糖尿病、移植物抗宿主病等。其中TNF、AKT1、ALB、CD4、IL2可能是治疗甲亢诱发的老年骨质疏松的主要潜在靶点;ALB、AKT1、TP53、TNF、CTNNB1则可能是治疗甲减诱发的老年骨质疏松的主要潜在靶点。
TNF(肿瘤坏死因子)可直接作用于破骨细胞前体,促进破骨细胞发生[8],且有报道显示TNF抑制剂会使骨密度增加,这可能与骨吸收减少和骨生成增加相关[9-10]。对于TSH抑制骨吸收的过程当中,TNFα则是介导其中的关键因素[11],也有证据表明TNFα的多态性与Graves病相关[12]。AKT(也被称为蛋白激酶B或PKB),其包括3个密切相关的亚型AKT1,AKT2和AKT3(或分别称作PKBα、β、γ),AKT1作为其中的一个亚型,在组织中广泛分布,并参与细胞的生长和存活[13],并且有研究发现AKT1作为成骨细胞的信号中介,可以控制成骨细胞与破骨细胞的分化[14-15]。ALB(白蛋白)是一种在人体血液中含量非常丰富的多功能血浆蛋白,其中心由疏水自由基组成,这些自由基是多种化合物的结合位点,例如甲状腺素(Thyroxine,T4),它是关于甲状腺激素快速交换资源的关键,可快速稳定T4水平[16]。有研究观察到低白蛋白血症持续时间越长,在同一解剖部位发生骨质疏松的风险则越高,表明了较低浓度的血清白蛋白水平与骨质疏松具有相关性,且独立于任何其他变量,但相关机制尚不明确[17]。有文章在确定原发性骨质疏松的差异表达基因中发现TP53(肿瘤蛋白p53)和CTNNB1(β连环蛋白1)是表达上调最多的DEGs,其可能在原发性骨质疏松症中发挥重要作用[18]。TP53作为细胞衰老的标志物之一,有实验表明循环TSH水平的升高和T4、T3水平的降低都与其基因表达降低显著相关[19]。CTNNB1编码β-连环蛋白基因,在影响骨质疏松和骨折易感性的生物途径中起着至关重要的作用[20],已有研究指出并强调CTNNB1在骨质疏松中成骨分化的作用,这可能会在骨质疏松症新疗法方面提供新的策略[21]。在最近有关骨质疏松的生物信息学实验验证研究文章中,分析了炎症因子与骨质疏松关键基因的相关性,并进一步通过孟德尔随机化分析细胞因子与骨质疏松的结局,最终发现IL2(白介素-2)的升高可导致骨质疏松的发生,两者之间存在显著的因果关系[22]。
人类T细胞白血病病毒Ⅰ型主要感染CD4+ T细胞,并在感染者中诱发慢性、持续性感染[23]。有分析发现CD4(CD4 分子)与骨吸收呈负相关,即高水平CD4与低转化型的骨质疏松症相关[24]。研究发现具有趋化和炎症特征CD4+细胞毒性T淋巴细胞(CD4+ CTL)参与了Graves眼病的发病机制,这种促进炎症的CD4+ CTL亚型可从血液迁移到眼眶组织,并根据其细胞毒性作用介导眼眶的炎症和重塑,它的细胞毒性和趋化性水平的升高很可能会与Graves眼病复发相关[25-27]。晚期糖基化终产物(Advanced glycation end products,AGEs)及其受体(receptor for AGEs,RAGE)被认为是发生炎症反应的重要组成部分,AGEs与多种受体相互作用,特别是RAGE,AGE-RAGE相互作用会影响到细胞的功能、代谢,以及导致多种生物学效应,其中就包括糖尿病的微血管及大血管的相关并发症,并且也导致多种信号的激活,包括PI3K/AKT、MAPK/ERK等[28]。RAGE可在包括炎症细胞、成骨细胞和破骨细胞在内的多种细胞上表达[29],且有研究已证实AGE-RAGE信号通路在促进成骨方面发挥着重要作用[30]。Ⅰ型糖尿病患者与胰岛素缺乏、骨稳态受损有关,成骨细胞和破骨细胞都受到其影响,长期的高血糖和炎症环境下可导致骨形成和骨吸收之间的负骨平衡,因此Ⅰ型糖尿病患者发生骨密度降低、骨折及骨折愈合不良的风险与一般人群相比会更高[31-33]。甲状腺激素影响着糖代谢的稳态,甲状腺疾病与糖尿病二者之间相互关联,二者作为常见的内分泌疾病,通常并存,Ⅰ型糖尿病患者中甲状腺疾病的发病率较高[34-36]。移植物抗宿主病(GVHD) 作为器官移植后常见并发症,现有研究表明在造血干细胞移植后GVHD的患者就包括甲状腺功能异常和骨质丢失[37]。
本文不足之处,结果为未经过实验验证所得出的生物信息学研究,需随疾病数据库的完善以及在动物实验和临床研究的基础上进一步探讨上述信号通路相关变化,从而更加全面的了解甲亢、甲减与老年骨质疏松疾病之间的机制及治疗策略。
综上所述,本文虽然通过生信分析去分别预测出甲亢、甲减与老年骨质疏松相关信号通路及关键基因,但是尚需体内、外实验的验证。在接下来的研究中,将进一步通过分子-细胞-动物水平多层次来验证上述关联基因及信号通路。旨在为临床开发防治甲亢、甲低诱发的老年骨质疏松的小分子基因治疗药物奠定前期基础。

