基于多序列MRI影像组学模型预测脑膜瘤组织学分型的价值
孔春雨,莫展豪,程斯文,隋 赫,宛迎春,吴 帅,范晓飞,吕忠文*
(吉林大学中日联谊医院 1.放射线科;2.超声科;3.内分泌科,吉林 长春130033)
脑膜瘤是颅内第二大常见肿瘤,病理上良性(WHO I级)约占>90%[1]。文献表明脑膜细胞在胚胎期参与大脑和颅骨的发育,可诱导不同的组织学亚型[2-4]。由于各亚型组织学特点不同,其术后相应的复发及对神经功能的损伤预后也不同[5-7]。WHO I级别脑膜瘤中纤维型脑膜瘤质地最为坚硬,手术切除需要将其从高度血管化的组织中分离出来[8],完整切除难度大、出血及残留率高[9-10]。因此尽早明确脑膜瘤分型,在术前采取血管栓塞术、抗血管生成治疗等措施,将有助于医生精准制定个体化手术方案[10-14]。影像组学利用自动化高通量的特征提取算法来反映肿瘤病理特征,不仅克服穿刺的局限性及损伤性,也使影像诊断方法从定性变为定量[14-15]。目前,预测脑膜瘤分型的影像组学研究大多基于MR成像方法,如NIU、ZHANG等[10,16-17]曾进行过相关机器学习方面的研究,但是这些研究的对象只局限于脑膜瘤病灶本身,忽略了病灶周围某些重要信息,比如水肿、脑膜尾征等;另外这些研究只预测脑膜瘤分级,现阶段针对脑膜瘤组织学分型的影像组学研究相对较少,尤其是对术中出血及术后残留有临床意义的纤维型脑膜瘤的研究。本研究选用支持向量机(AVM)的机器学习算法构建预测模型,利用受试者工作特征曲线(receiver-operating characteristic curve,ROC)评估预测脑膜瘤分型的影像组学模型,训练集和验证集中的ROC曲线下面积(area under curve,AUC)、敏感性、特异性等,旨在探讨基于多序列MRI的影像组学模型预测脑膜瘤分型的价值。
1 资料与方法
1.1 一般资料
本实验回顾收集了在2013年3月至2022年12月于吉林大学中日联谊医院行头颅MRI检查的374例脑膜瘤患者的临床和影像资料,其中符合本研究要求的为317例。其中,纤维型脑膜瘤组共45例,男4例,女41例,平均年龄(56.05±9.093)岁;非纤维型脑膜瘤组共272例,男73例,女199例,平均年龄(54.40±11.367)岁。纳入标准:(1)经手术后病理证实为脑膜瘤;(2)病理明确肿瘤的病理分型;(3)患者术前有完整的MRI平扫及增强图像;(4)行MRI检查前未行任何治疗。排除标准:(1)患者MRI图像伪影重、质量差;(2)肿瘤直径<5 mm;(3)肿瘤成分均为囊性,无强化实质成分;(4)行MRI检查前患者已接受治疗。纳入排除过程如图1所示。
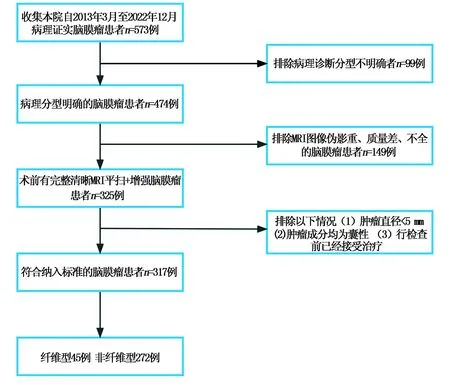
图1 纳入排除流程图
1.2 扫描设备和参数
使用Siemense skyra 3.0T磁共振机和标准头部正交线圈。收集入组的所有脑膜瘤患者术前均进行仰卧位正常呼吸下扫描。常规MRI扫描后,注射对比剂Gd-DTPA获得对比T1WI增强(T1WIC)图像。MRI的扫描参数详细数据如下:①T1WI序列(TR1800ms,TE9ms)、T2WI序列(TR5200ms,TE117ms)、T2WIFLAIR序列(TR8000ms,TE84ms)、T1WI增强序列(TR250ms,TE2.46ms),层厚为5.0 mm,层间距为1.0 mm,层数为20,视野为230 mm×230 mm,矩阵为256×256。②对比T1WI增强序列:对比剂使用Gd-DTPA,经肘静脉注射,剂量为0.1 mmol/kg,注射流率为1.0 ml/s,其他扫描参数同T1WI序列。
1.3 病理分析
病理组织学分型情况由多名病理医师共同进行评估。纤维型组中只包含纤维型脑膜瘤患者,其他病理类型(收集到的病例中包括了过渡型、皮细胞型、沙砾型、血管瘤型、微囊型、非典型、间变型)的脑膜瘤患者归为非纤维型组。
1.4 感兴趣区分割
将从PACS系统中导出的每位患者的T1WI、T2WI、T2WIFLAIR、T1WI增强(T1WIC)头颅MRI图像以DICOM格式导入到分割软件ITK-SNAP(version3.4.0)中,由2名初级(3年工作经验)医生对肿瘤病灶强化区进行逐层勾画,同时由1名高年资(10年工作经验)影像医师复核,获得感兴趣区(EnHROI),并上传至联影智能科研平台系统V1.0(上海联影智能医疗科技有限公司)[18],将EnHROI向周围膨胀3 mm和5 mm,分别得到EnH3mmROI和EnH5mmROI,如图2所示。
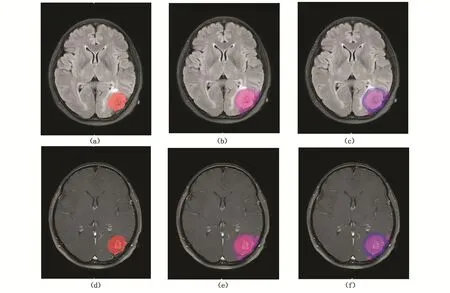
图2 ROI勾画示意图
分析肿瘤影像学特征包括:(1)肿瘤位置;(2)肿瘤直径;(3)肿瘤强化方式(均匀或不均匀);(4)肿瘤形状(规则或不规则);(5)肿瘤边界(瘤脑分界清晰或不清晰);(6)瘤周水肿(有或无);(7)脑膜尾征(有或无)。
1.5 影像学特征提取及筛选
在提取影像组学特征之前,对图像进行图像去噪、灰度标准化预处理。然后将勾画的感兴趣区及所有序列的图像,经过自动高通量特征分析算法来提取图像特征,包括形状特征、纹理特征及灰度统计量特征,在原始图像中提取上述3类特征,同时对图像进行多种滤波处理,提取纹理特征及灰度统计量特征。
对每个序列分别采用5折交叉验证法及留一法进行特征筛选。使用z-score标准化来进行特征的归一化后进行特征筛选。使用相关系数法进行单变量选择、用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)算法进行多变量选择。其中交叉验证法中利用投票法筛选出每一折中出现频次大于或等于3次的特征,5折交叉验证的筛选示意过程如图3所示。
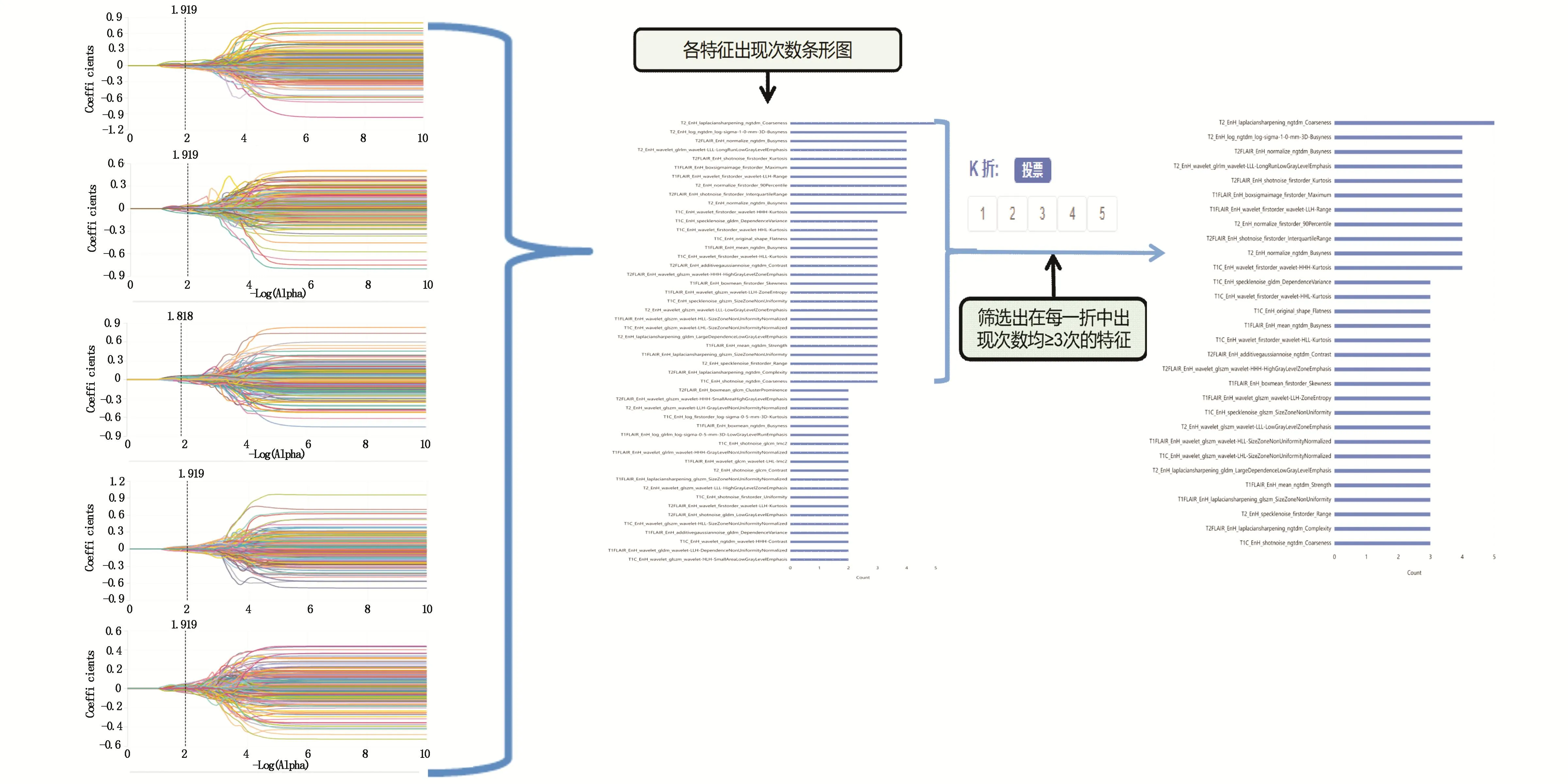
图3 利用5折交叉验证进行特征筛选的示意图
1.6 模型建立及验证、评估
将入组患者按照5∶1的比例随机分为训练集和测试集,然后将筛选降维后的影像组学特征通过支持向量机(AVM)的机器学习方法建立预测模型。因为组间样本分布不均衡,所以训练集分别采用了5折交叉验证法和留一法交叉验证(LOOCV)分别进行模型验证,其中5折交叉验证法中选择了验证集最佳的一折进行独立测试集验证。分别构建EnHROI、EnH3mmROI、EnH5mmROI模型,并且应用ROC及其相关评价指标来比较不同模型的预测能力及相关指标的差异。
基于T1WI、T2WI、T2WIFLAIR、T1WIC序列EnHROI提取的组学特征利用5折交叉验证法得到的每一折的特征筛选LASSO路径图,然后对每一折中各种特征出现次数进行统计,最后筛选出每一折中出现频次大于或等于3次的影像组学特征。
1.7 统计学分析
对于所采集的患者临床资料、影像学特征、组别间定量及定性资料的比较使用SPSS 26.0软件,分别采用两独立样本t检验和χ2检验进行统计学分析,所有统计学结果以P<0.05为差异具有统计学意义。使用ROC曲线下面积(area under curve,AUC)、灵敏度、特异度、准确率、精确率及F1-score等指标评价模型。
2 结果
2.1 临床及影像学特征分析
本研究中,纤维型脑膜瘤组共45例,非纤维型脑膜瘤组共272例。经过临床及影像学特征分析得出:性别构成、脑膜瘤的位置以及有无瘤周水肿均具有统计学意义(χ2=4.961,P=0.026;χ2=27.500,P<0.001;χ2=10.655,P=0.001),结果见表1。

表1 脑膜瘤组织学分型与临床及影像学特征分析结果
2.2 影像组学特征提取及降维
使用了15种滤波器,每个MRI序列分别提取7组共2083个特征。其中包括一阶特征413个、灰度共生矩阵483个、灰度相关矩阵322个、灰度行程矩阵368个、灰度区域大小矩阵368个、邻域灰度差矩阵115个、形状特征14个。经过筛选及降维,其中利用5折交叉验证筛选得出的基于EnHROI预测组织学分型模型有意义的特征共30个,EnH3mmROI模型共33个特征,EnH5mmROI模型共35个特征(LASSO筛选路径如图4所示);利用留一法得出的基于EnHROI预测组织学分型模型有意义的特征共25个,EnH3mmROI模型共22个特征,EnH5mmROI模型共23个特征(LASSO筛选路径如图5所示)。影像组学特征从MRI各序列中进行提取并筛选,各序列中的特征分布如图6。
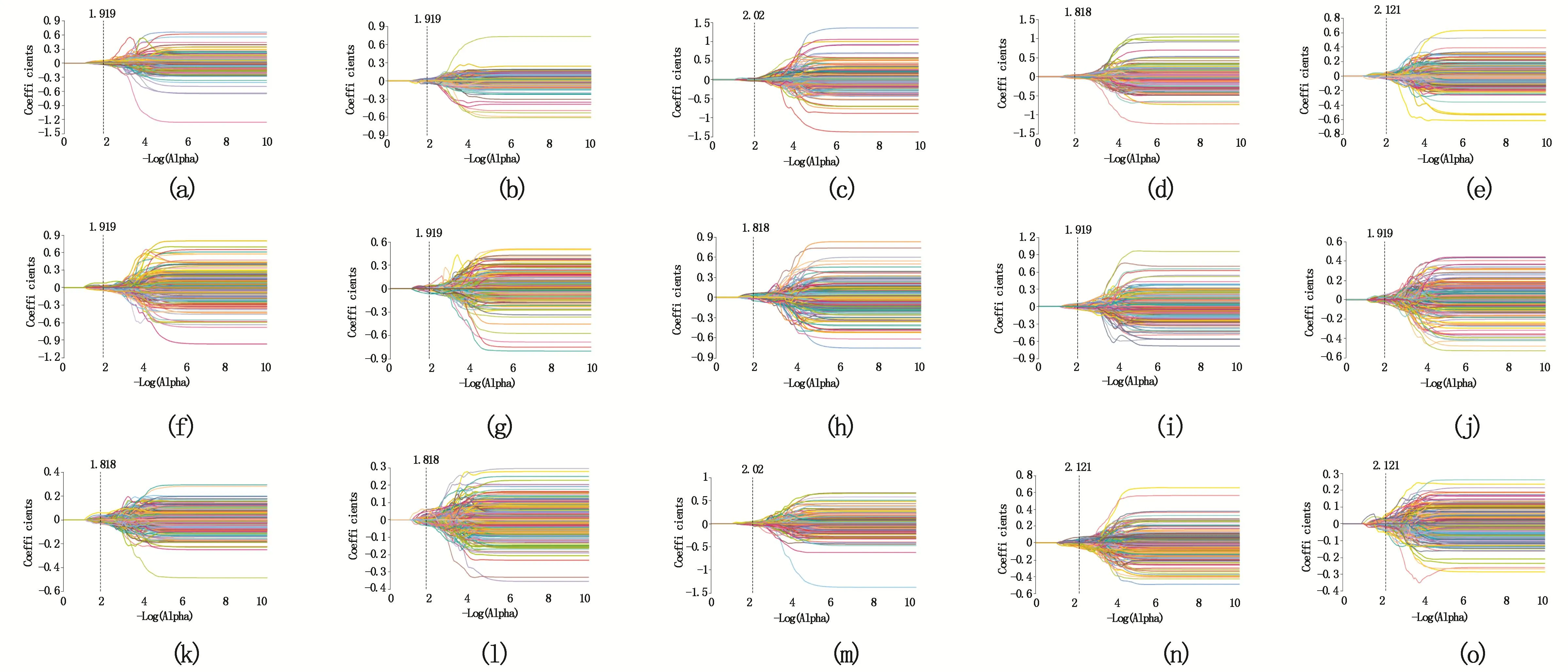
图4 利用5折交叉验证筛选特征中每一折的LASSO路径图

图5 利用留一法筛选特征的LASSO路径图
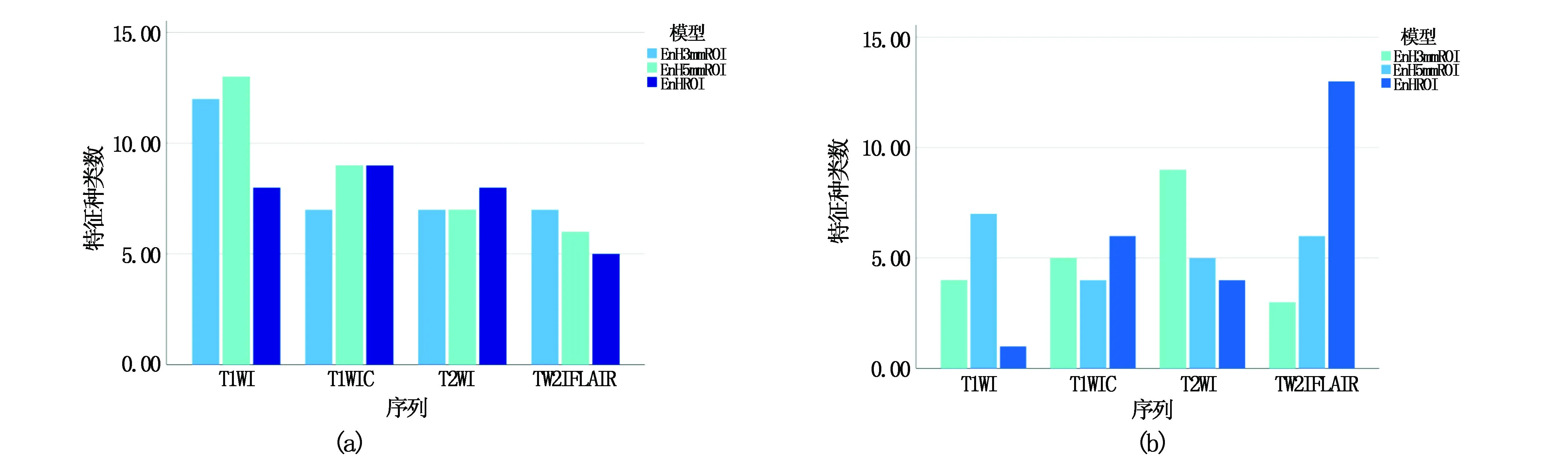
图6 所筛选的组学特征在各个MRI序列的分布情况
a-e 基于EnHROI的5折交叉验证法中每一折的筛选路径图;f-j 基于EnH3mmROI的5折交叉验证法中每一折的筛选路径图;k-o基于EnH5mmROI的5折交叉验证法中每一折的筛选路径图;其中横坐标为-log(alpha),纵坐标为不同参数下的系数。
2.3 影像组学模型的建立及验证、评估
对于利用5折交叉验证术前预测脑膜瘤组织学分型的各序列图像(包括T1WI、T2WI、T2WIFLAIR、T1WIC)模型中,基于EnH3mmROI的预测模型均优于基于EnHROI的模型及EnH5mmROI的模型,且各模型间预测效能比较:EnH3mmROI模型>EnH5mmROI模型>EnHROI模型。
对于利用留一法验证术前预测脑膜瘤组织学分型的各序列图像(包括T1WI、T2WI、T2WIFLAIR、T1WIC)模型中,基于EnH3mmROI的预测模型均优于基于EnHROI的模型及EnH5mmROI的模型。
5折交叉验证法和留一法分别验证预测组织学分型模型的评估结果见表2、3,图7、8。

表2 利用5折交叉验证预测脑膜瘤组织学分型模型的各项评估指标

表3 利用留一法验证预测脑膜瘤组织学分型模型测试集的各项评估指标
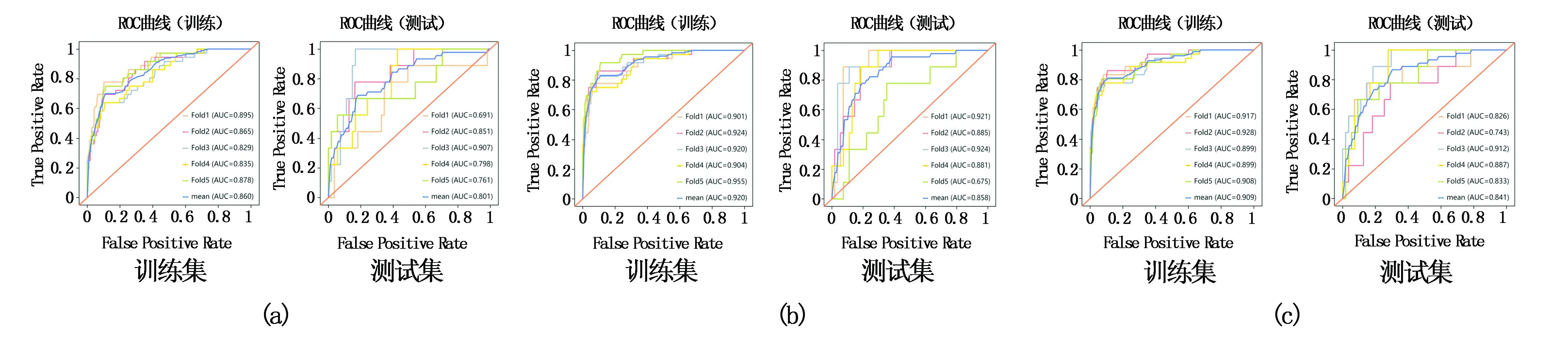
图7 利用5折交叉验证模型中每一折的训练集和测试集的ROC曲线图
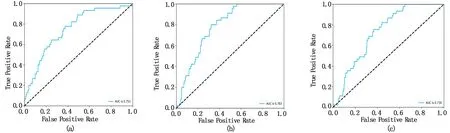
图8 利用留一法验证模型测试集的ROC曲线图
a、b基于EnHROI提取的组学特征预测脑膜瘤分型使用LASSO进行特征筛选;c、d 基于EnH3mmROI提取的组学特征预测脑膜瘤分型使用LASSO进行特征筛选;e、f 基于EnH5mmROI提取的组学特征预测脑膜瘤分型使用LASSO进行特征筛选;a、c、e横坐标为-log(alpha),纵坐标为LASSO模型的均方误差MSE;b、d、f横坐标为-log(alpha),纵坐标为不同参数下的系数。
3 讨论
随着人工智能在医学领域的应用越来越广泛,影像组学对于影像诊断的价值逐渐得到了大家的关注。影像组学作为一门新兴的交叉学科,它可以对图像进行客观定量分析,并且与疾病的临床特征联系起来。本研究利用影像组学分析脑膜瘤MRI影像组学特征与分型的关系,在术前无创地预测脑膜瘤分型,有助于手术计划制定及预测预后进展。通过验证,该模型具有良好的预测能力,在预测脑膜瘤分型上具有潜在价值。
本研究对纤维型和非纤维型脑膜瘤的四个序列(T1WI、T2WI、T2WIFLAIR、T1WIC)图像进行影像特征的提取及筛选,分别构建EnHROI模型、EnH3mmROI模型、EnH5mmROI模型,然后利用ROC曲线中的各种指标评估每种模型的诊断效能,最终得出EnH3mmROI模型的预测效果最优,且各模型间预测效能比较:EnH3mmROI模型优于EnH5mmROI模型优于EnHROI模型,分析原因可能是EnH3mmROI模型不仅包含了病灶本身的特征如坏死液化,还囊括了脑膜尾征、瘤周水肿带等特征,因为它们的产生与肿瘤的病理特点及影像特征等相关,反映了肿瘤的特性[19-20]。但同时EnH3mmROI模型也优于EnH5mmROI模型,分析可能因为某些是颅底脑膜瘤或脑膜瘤离颅骨、大脑镰太近,扩张5 mm时包含了这些额外结构,所以降低了模型的诊断效能。另外,本研究还对影像学特征在各序列中的分布做了研究(图6),发现建立模型所筛选的特征较多来自于T1WI及T2WIFLAIR序列,尤其是EnH3mmROI模型和EnH5mmROI模型,这提醒在今后的研究中应尽可能全面地纳入患者的各序列图像,充分利用各序列价值。
本研究还发现脑膜瘤患者的性别、瘤周水肿和肿瘤位置差异具有统计学意义。首先,研究发现女性患者明显多于男性患者,这正与脑膜瘤好发于女性的特点相契合[21];其次,纤维型脑膜瘤瘤周水肿发生率远低于非纤维型,有相关文献报道级别越高的脑膜瘤发生水肿的几率越大,这可能与血管内皮生长因子(VEGF)表达增多,大脑皮层发出的分支主要供应脑膜瘤后,对于肿瘤周围的供血减少,从而导致细胞毒性水肿有关[22]。
研究结果表明,本研究所建立的预测模型具有良好的效能,考虑与以下几点有关:①首先对T1WI、T2WI、T2WIFLAIR、T1WIC这四个序列都进行了特征提取,由于各序列反映的侧重点不同,如T1WIC序列主要反映肿瘤血供、坏死,T2WI和T2WIFLAIR序列反映瘤周水肿,T1WI序列反映出血及钙化等等,这可以更好地帮助鉴别脑膜瘤分型,并极大地提高模型预测能力。②本研究的ROI不仅包含了肿瘤在MRI上的各个层面的强化区,而且又将肿瘤强化区分别向周围膨胀3 mm及5 mm,这就使得部分肿瘤周围的水肿区以及肿瘤内部的坏死区域全都纳入到ROI内,所以本研究范围更全面。③在对模型进行构建验证是采用了5折交叉验证法和留一法分别去验证,并构建AVM的机器学习模型,然后发现留一法的AUC值要比交叉验证法的AUC值小,而且留一法的准确率明显低于5折交叉验证法的准确率,另外从验证方法的角度分析,5折交叉验证其实更具有说服力,首先它随机分组减少了偏倚,其次得到了每一折的特征筛选LASSO图并可以进行比较,而留一法需要构建317个模型去比较,较为复杂,因此,5折交叉验证法表现更优秀。综上所述,影像组学方法无需侵入性活检,帮助避免了进行与肿瘤病理特征不符的手术方式,在鉴别肿瘤分型上具有潜在价值。
但本研究还存在一定的局限性以及改进空间,主要归纳为以下几点:①为单中心回顾性研究;②未对非纤维型脑膜瘤进行具体分类研究,NIU等[10]利用影像组学对3种亚型脑膜瘤(80例上皮型脑膜瘤、80例纤维型脑膜瘤、81例移行型脑膜瘤)进行预测,共分为4组,预测准确率分别为91.3%、95.0%、100.0%和94.2%。而本研究结果准确率较之略低,可能与未对非纤维型脑膜瘤进行具体分型有关,另外本组间样本量差距太大,也造成了准确率较之略低。因此,后续研究中,在扩大纤维型脑膜瘤样本量的同时,还可以将非纤维型脑膜瘤进行具体分类研究;③人工分割图像极易产生误差,以后可以尝试采用半自动或全自动分割软件;④在轴位图像上提取影像特征时,颅底和大脑凸面的肿瘤更容易受周围颅骨影响而降低诊断效能,对此以后应尽量在冠状面或矢状面上提取特征,避开颅骨;⑤纳入序列较为局限,可以在以后的研究中加入DWI、SWI等特殊序列,以便更全面地反映肿瘤的影像特征,提高分型预测的准确性。
总之,本研究建立了基于常规MRI序列术前预测脑膜瘤组织学分型的影像组学模型,经过验证,该模型有助于脑膜瘤患者的临床决策及精准的个体化治疗指导。

