构树叶黄酮类物质提取工艺的优化及其对小鼠表皮干细胞的抗氧化作用
岑丽航,孙鸽云,2,王珍珍,肖瑞琳,王丽丽,常冰梅
1.山西医科大学基础医学院生物化学与分子生物学教研室,山西 太原 030001;2.太原市铁路局疾病预防控制中心,山西 太原 030001;3.山西医科大学第一医院,山西 太原 030001
构树[Broussonetia papyrifera(L.)Vent.]属于桑科构属植物,在我国分布较广,适应性强,速生丰产,广泛应用于畜禽饲料、医药、园林绿化、食品、造纸等领域,综合价值较高[1]。构树叶中富含蛋白质、多糖、黄酮及皂苷类化学物质等,具有营养保健、抗肿瘤、抗菌抗病毒、抗氧化、抑制红细胞溶血等作用[2-8]。构树属于“药食同源”植物[2,9],近年,多个地区将种植构树作为扶贫项目,扩大了种植数量,也加快了其综合开发利用的进程[10]。
构树叶中蛋白质及氨基酸含量高,种类多,营养价值高,还具有来源广、饲喂效果好等优点,可作为畜禽饲料中蛋白原料的来源[2]。构树叶富含黄酮、生物碱等多种功能性活性物质,极具开发利用价值。但目前开发利用方式单一,缺乏综合利用的方法,尤其对构树叶黄酮类物质的开发与利用相对滞后,缺少构树加工后(饲料加工或制浆造纸加工)原液中黄酮类物质回收利用方法,构树资源综合提取工艺尚不完善,无统一提取工艺标准[9]。本课题组前期采用碱溶酸沉法提取构树叶蛋白,再经浓缩醇沉法提取粗多糖,通过酶解废渣,制备水不溶性膳食纤维,促进构树叶资源的合理利用[11-12]。黄酮类化合物大多具有酚羟基,在碱液中形成可溶性盐[13]。本研究通过碱溶酸沉法提取构树叶蛋白和多糖粗提原液中的黄酮类物质,再经聚酰胺富集浓缩,并采用单因素试验及正交试验设计对提取工艺进行优化,同时评价构树叶黄酮类物质对小鼠表皮干细胞相对活力及氧化损伤的作用,以期为后续对构树资源及其相关产品的深入开发奠定基础。
1 材料与方法
1.1 样品 新鲜构树叶由中国科学院植物研究所提供,并经山西医科大学药学院中药学教研室杨官娥教授鉴定为桑科构属构树[Broussonetia papyrifera(L.)Vent.]叶。
1.2 主要试剂 葡聚糖标准品及分散酶Ⅱ均购自美国Sigma 公司;聚酰胺粉购自江苏长丰化工有限公司;芦丁标准品购自中国食品药品检定研究院;山羊血清购自北京索莱宝生物科技有限公司;Anti-mouse CD71 PE和Anti-Mouse CD49f PE均购自美国eBioscience公司;亲和素β1及FITC标记的驴抗兔IgG购自美国Santa Cruz 公司;EasySep 磁极和小鼠PE 分选试剂盒均购自加拿大Stemcell 公司;油红O 染液、还原型谷胱甘肽(reduced glutathione,GSH)及丙二醛(Malon-dialdehyde,MDA)测定试剂盒均购自南京建成生物科技有限公司;DAPI 和CCK-8 均购自上海碧云天生物技术公司;所有分离有机溶剂均为国产分析纯。
1.3 实验动物 SPF 级BALB/c 乳鼠,0~3 日龄,体质量(2.0 ± 0.5)g,由山西医科大学实验动物中心提供,动物合格证号为:SCXK(晋)2019-0004。本实验对乳鼠的所有处理均以科研为目的,且按山西医科大学实验动物伦理相关规定进行[文件号为:山医大科(2019)8号]。
1.4 构树叶黄酮类物质的提取 将构树叶自然风干,粉碎。称取构树叶粉末20.0 g,按一定液料比加入NaOH 溶液,一定温度下浸提2 h;浸提液经200 目尼龙滤布过滤,用4 mol/L 盐酸调节pH,使蛋白质析出,室温静置过夜;3 005 ×g离心30 min;取上清液,经60 ℃水浴浓缩,再用终浓度80%的无水乙醇沉淀多糖,室温静置过夜;3 005 ×g离心30 min;取上清液,通过直形冷凝管装置于75 ℃回收乙醇,剩余液体于60 ℃鼓风烘箱内通过聚酰胺柱纯化浓缩液,经苯除去小分子杂质,用甲醇洗脱黄酮类物质,60 ℃干燥获得黄酮类物质。
1.5 构树叶黄酮类物质提取工艺的优化
1.5.1 单因素试验 选择液料比(15∶1、20∶1、25∶1、30∶1、35∶1)、NaOH浓度(0.2%、0.4%、0.6%、0.8%、1.0%)、pH(2.5、3.0、3.5、4.0、4.5)、浸提温度(60、65、70、75、80 ℃)进行单因素试验,基本参数为液料比25∶1,pH 3.5,NaOH 浓度0.6%,浸提温度70 ℃,单因素改变时,其他参数保持不变,以黄酮类物质质量分数为评估指标。试验重复3次。
1.5.2 正交试验设计 基于单因素试验结果,以液料比(A)、NaOH 浓度(B)、pH(C)和浸提温度(D)为相应因素,黄酮类物质质量分数为评估指标,设计4因素3 水平正交试验设计,见表1,共设计9 组试验,见表2。试验重复3次。
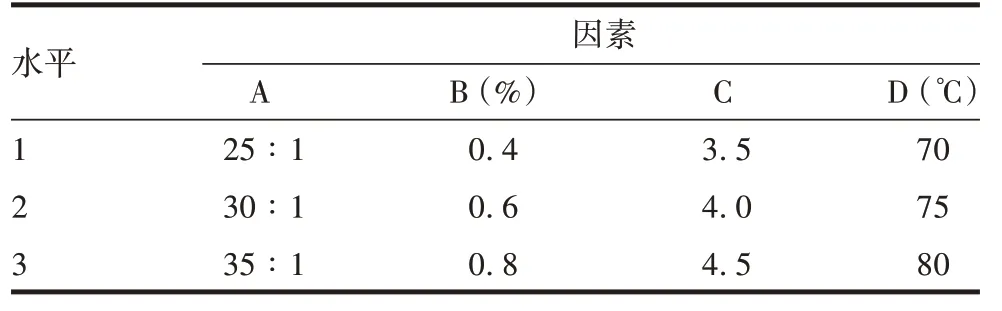
表1 4因素3水平正交试验条件设计Tab.1 Design of four factors and three levels orthogonal test conditions
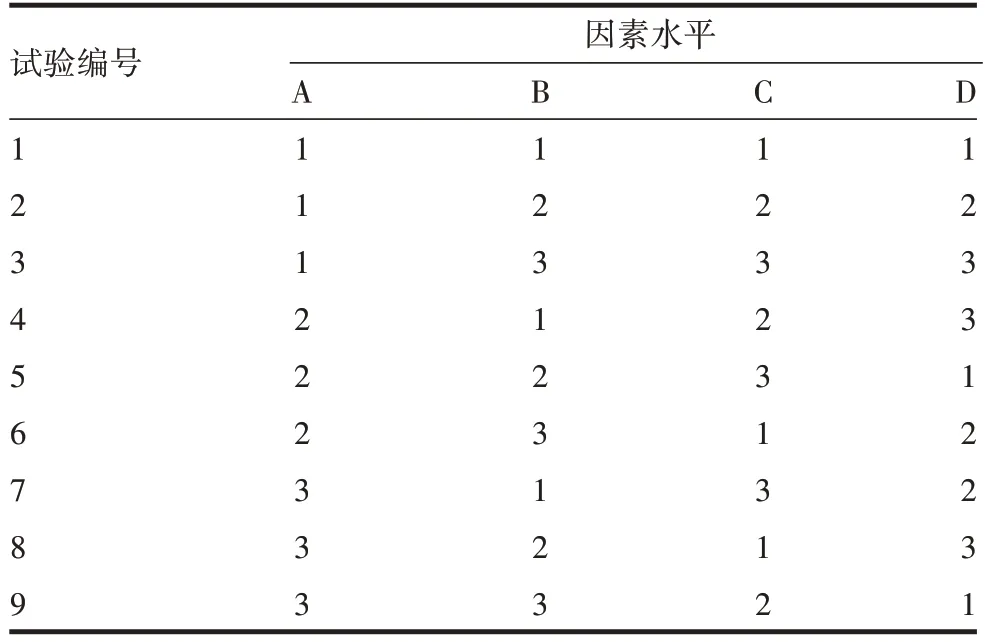
表2 正交试验设计Tab.2 Design of orthogonal test
1.6 黄酮类物质质量分数的计算 比色法测定最佳条件下获得黄酮类物质浓度,称取1 mg,用99.8%甲醇稀释至50 mL。将芦丁标准品用99.8%甲醇溶解,配制为50 μg/mL 的芦丁标准液。分别吸取0、1.0、2.0、3.0、4.0、5.0 mL芦丁标准液,加入99.8%甲醇至10 mL,混匀,检测A360。以芦丁标准液浓度为横坐标,A360为纵坐标绘制标准曲线。将样本带入标准曲线计算黄酮类物质的浓度,并按下式计算构树叶黄酮类物质质量分数[14]。每个样品平行检测3次。
黄酮类物质质量分数(%)=(黄酮类物质浓度/聚酰胺洗脱前干燥物总浓度)×100%
1.7 表皮干细胞的分选 采用免疫磁珠法。将乳鼠经颈椎脱臼处死,取背部皮肤,加入分散酶Ⅱ,4 ℃消化过夜;刮取基底层细胞,0.25%胰酶消化20 min;188×g离心3 min,收集细胞,采用小鼠PE 分选试剂盒分选小鼠表皮干细胞CD49f+/CD71-[15]。
1.8 表皮干细胞的鉴定
1.8.1 荧光显微镜观察 将CD49f+/CD71-细胞置荧光显微镜下观察细胞形态。
1.8.2 细胞免疫荧光法 于24 孔板内放入细胞爬片,将CD49f+/CD71-细胞以2×105个/孔接种至24孔板,37 ℃,5% C02培养箱培养72 h;取出爬片,用4%多聚甲醛固定15 min,0.3%Triton 100透膜15 min;加入山羊血清,500 μL/孔,室温封闭30 min;加入整合素β1(1∶200稀释),3 ~5滴/孔,4 ℃孵育过夜;加入FITC 标记的驴抗兔IgG(1∶200稀释),3 ~5滴/孔,避光孵育1 h;加入DAPI(1∶1 000 稀释),避光孵育10 min,荧光显微镜下观察结果[16]。
1.8.3 诱导成脂试验 将CD49f+/CD71-细胞接种至12 孔板,5 × 105个/孔,成脂诱导培养基于37 ℃培养15 d;油红O 染液室温染色15 min,置显微镜下观察成脂情况。
1.8.4 细胞增殖情况 将CD49f+/CD71-细胞接种至96 孔板中,1× 104个/孔,设6 个复孔,于37 ℃培养2~8 d;加入CCK-8 试剂,10 μL/孔,继续孵育1 h,用酶标仪检测A450。
1.9 黄酮类物质对表皮干细胞相对活力影响的检测将CD49f+/CD71-细胞接种至96孔板中,1×104个/孔,分别加入1.4 项提取的黄酮类物质至终浓度3.125、6.25、12.5、25、50 μg/mL,同时设空白对照组(不加黄酮类物质及细胞)及阴性对照组(0 μg/mL黄酮类物质),每组设6 个复孔,37 ℃培养48 h;加入CCK-8试剂,继续培养1 h;用酶标仪检测A450,并按下式计算细胞相对活力。
细胞相对活力(%)=(实验组- 空白对照组)/(阴性对照组-空白对照组)×100%
1.10 黄酮类物质对表皮干细胞中GSH 和MDA 含量影响的检测 将CD49f+/CD71-细胞接种至6 孔板,1×106个/孔,分别加入1.4 项提取的黄酮类物质终浓度为3.125、6.25、12.5、25、50 μg/mL,同时设阴性对照组(0 μg/mL黄酮类物质),37 ℃培养48 h;收集细胞,用0.3 mL PBS重悬,超声破碎细胞,取0.1 mL细胞悬液,采用GSH及MDA测定试剂盒检测GSH和MDA含量。
1.11 统计学分析 应用SPSS 24.0 软件进行统计学分析,组间比较采用方差分析及独立样本t检验,均以P<0.05为差异有统计学意义。
2 结果
2.1 构树叶黄酮类物质提取工艺的优化
2.1.1 单因素试验
2.1.1.1 液料比 黄酮类物质质量分数随液料比增大而增大,当液料比为35∶1 时得率仅略提高,可能是其他可溶性杂质溶出导致,见图1。考虑到液料比过大造成资源的浪费,因此,确定最佳液料比为30∶1。
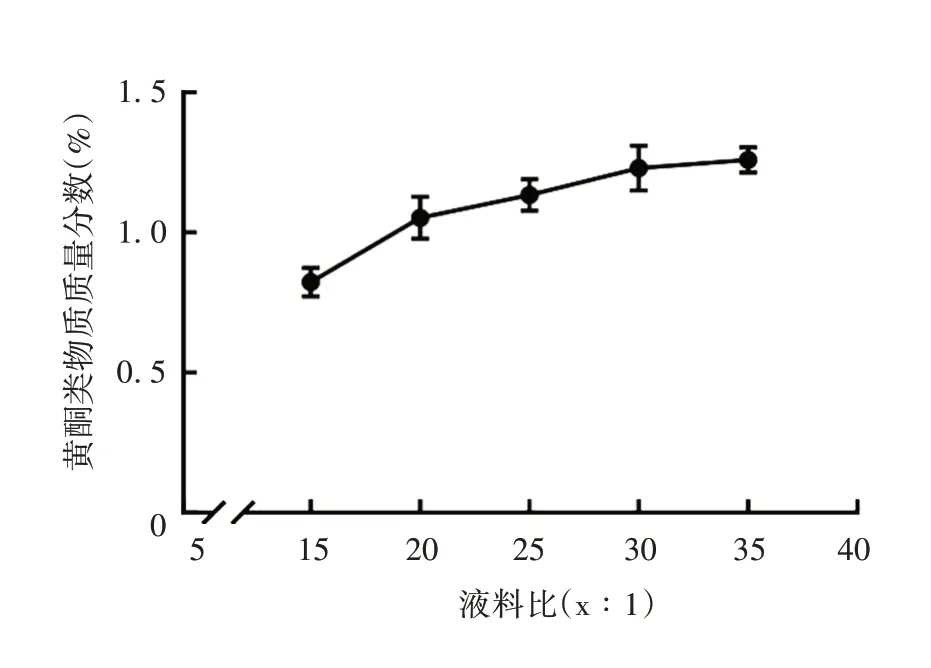
图1 液料比对构树叶黄酮类物质质量分数的影响Fig.1 Effect of liquid-solid ratio on flavonoids mass fraction of B.papyrifera leaves
2.1.1.2 NaOH 浓度 黄酮类物质质量分数率随NaOH 浓度增高呈先升后降趋势,这是由于黄酮类化合物具有多个酚羟基,随着碱浓度增加,其溶解度增大,当碱浓度超过一定量时,强碱破坏了黄酮母核导致黄酮类物质质量分数下降。NaOH 浓度为0.6%时,质量分数达最大,见图2。因此,确定最佳NaOH浓度为0.6%。
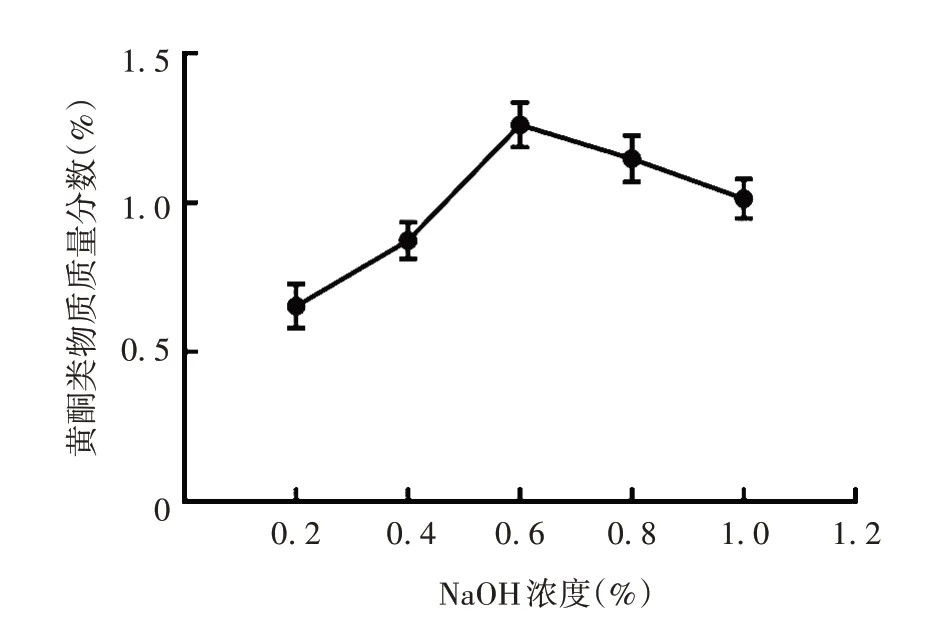
图2 NaOH浓度对构树叶黄酮类物质质量分数的影响Fig.2 Effect of NaOH concentration on flavonoids mass fraction of B.papyrifera leaves
2.1.1.3 pH 黄酮类物质质量分数随pH 增高呈先升后降趋势,这是由于当pH 过低时强酸破坏黄酮结构导致质量分数下降,pH 过高时构树叶中的蛋白或多糖等非黄酮类物质也会析出而导致质量分数降低。pH为4.0时黄酮类物质质量分数最大,见图3。因此,确定最佳pH 为4.0。

图3 pH对构树叶黄酮类物质质量分数的影响Fig.3 Effect of pH value on flavonoids mass fraction of B.papyrifera leaves
2.1.1.4 浸提温度 黄酮类物质质量分数随浸提温度增高呈先升后降趋势,这是由于温度过高可使部分黄酮类物质氧化变性,使其质量分数反而降低。当浸提温度为75 ℃时质量分数最高,见图4。因此,确定最佳温度为75 ℃。
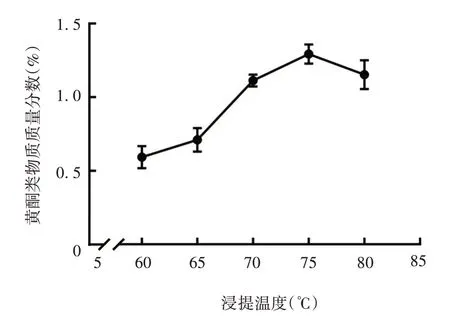
图4 浸提温度对构树叶黄酮类物质质量分数的影响Fig.4 Effect of extraction temperature on flavonoids mass fraction of B.papyrifera leaves
2.1.2 正交试验 构树叶黄酮类物质质量分数影响程度为B >A >D >C,NaOH 浓度对黄酮类物质质量分数影响最大。构树叶黄酮最佳工艺为A2B2C3D2,即液料比30∶1、NaOH浓度0.6%、pH 4.5、浸提温度75 ℃,但方差分析差异均无统计学意义(P均>0.05)。见表3 和表4。3 次验证试验结果表明,构树叶黄酮类物质平均质量分数为1.47%。
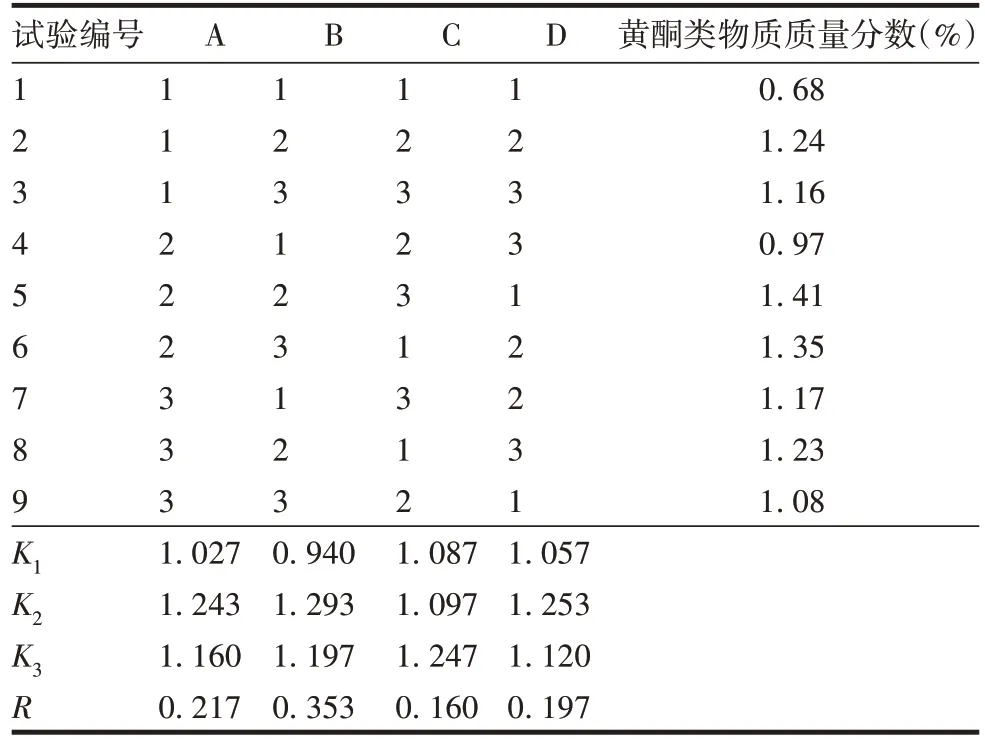
表3 正交试验结果Tab.3 Orthogonal test results

表4 黄酮类物质质量分数的方差分析Tab.4 Variance analysis of flavonoids mass fraction
2.2 黄酮类物质浓度的测定 以芦丁为标准品绘制标准曲线见图5。获得回归方程为y= 0.033x,R2=0.997。芦丁标准品在0 ~25 μg/mL 范围内,与A360呈良好的线性关系。

图5 芦丁的标准曲线Fig.5 Rutin standard curve
2.3 表皮干细胞的鉴定
2.3.1 荧光显微镜观察 CD49f+/CD71-细胞可见明显的红色荧光,细胞状态良好,见图6。
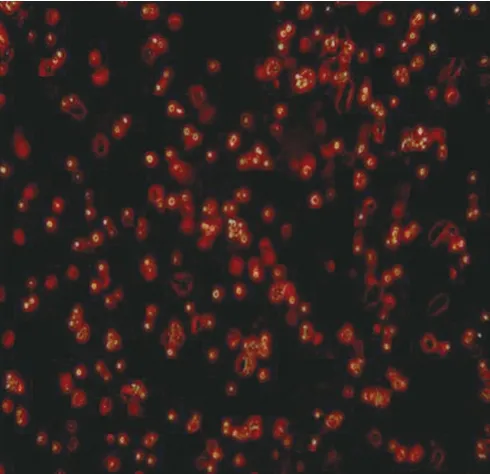
图6 CD49f+/CD71-细胞形态的镜下观察(×200)Fig.6 Microscopy of CD49f+/CD71-cell morphology(×200)
2.3.2 细胞免疫荧光 CD49f+/CD71-细胞呈整合素β1阳性表达,见图7。

图7 整合素β1表达情况的镜下观察(×200)Fig.7 Microscopy of integrin β1 expression(×200)
2.3.3 诱导成脂试验 CD49f+/CD71-细胞内有明显的脂滴形成,见图8。
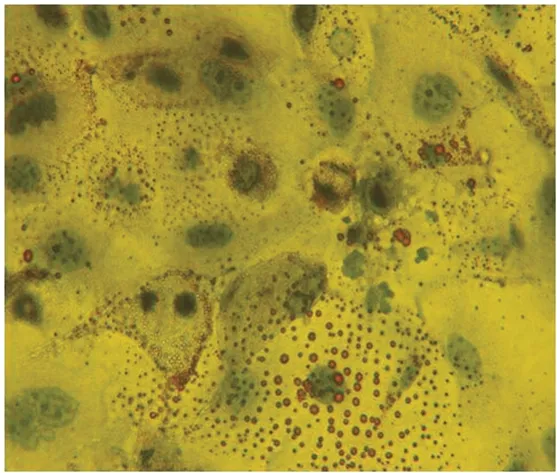
图8 脂滴形成情况的镜下观察(油红O染色,×400)Fig.8 Microscopy of lipid droplet formation(oil red O staining,×400)
2.3.4 细胞增殖情况 CD49f+/CD71-细胞随培养时间的延长,增殖速度逐渐提高,见图9。表明CD49f+/CD71-细胞具有表皮干细胞的生物学特征。

图9 CD49f+/CD71-细胞的增殖情况Fig.9 Proliferation of CD49f+/CD71-cells
2.4 黄酮类物质对表皮干细胞相对活力的影响 与阴性对照组比较,构树叶黄酮类物质对CD49f+/CD71-细胞有促进增殖的作用,当黄酮类物质终浓度为25及50 μg/mL时,细胞活力明显增加(F分别为1.427和13.747,P均<0.01),见图10。
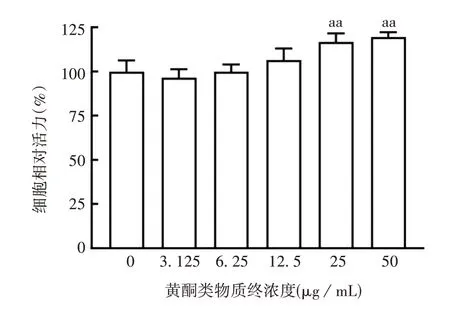
图10 不同浓度黄酮类物质作用后表皮干细胞的相对活力Fig.10 Relative vability of epidermal stem cells in different concentrations of flavonoids
2.5 黄酮类物质对表皮干细胞中GSH 和MDA 含量的影响 黄酮类物质浓度增加,CD49f+/CD71-细胞中GSH 含量呈增加趋势,MDA 含量呈下降趋势。与阴性对照组比较,当黄酮类物质终浓度为12.5、25、50 μg/mL时,GSH含量明显升高(F分别为0.044、0.291和2.577,P均<0.05),MDA 含量明显下降(F分别为3.568、4.909 和1.400,P均<0.05)。见图11 和图12。

图11 各组表皮干细胞中GSH的含量Fig.11 GSH levels of epidermal stem cells in various groups
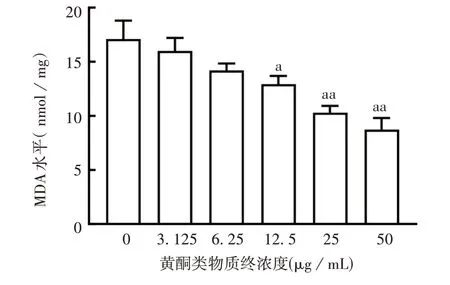
图12 各组表皮干细胞中MDA的含量Fig.12 MDA levels of epidermal stem cells in various groups
3 讨论
目前,已有多种黄酮类物质提取工艺,如超声辅助提取法、加热回流提取法、酶法提取、碱溶酸沉法等[17-21]。本课题组前期采用碱溶酸沉法和乙醇沉淀法提取构树叶蛋白和多糖后,利用余下的原液采用碱溶酸沉法结合吸附树脂柱富集方法,提取黄酮类物质,可实现对构树叶组分成分综合开发利用[20,22]。本研究通过结合单因素及正交试验,考察液料比、NaOH 浓度、pH、浸提温度4 个因素对黄酮类物质质量分数的影响,优化构树叶黄酮类物质提取工艺,其中,NaOH 浓度对构树叶黄酮类物质得率影响最大,确定最优条件为:液料比30∶1,NaOH 浓度0.6%,pH 4.5,浸提温度75 ℃,黄酮类物质质量分数为1.47%。与单独提取构树叶黄酮类物质的提取方法比较,合理利用了资源,减少了提取过程中对环境污染物的产生,该方法相对简单、成本低、效率高,适用于工业化生产。该方法的建立为后期大规模开发应用构树及进一步功能研究奠定了基础。
黄酮类物质具有显著抗氧化,延缓皮肤衰老的作用[23]。研究表明,构树根提取物(楮树黄酮醇B 和构树醇J)通过激活AMPK 活性和降低脂肪基因表达而改善肝脏和脂肪组织炎症,增加肥胖小鼠对胰岛素的敏感性[6]。王亭等[24]在构树叶中提取的总黄酮对紫外线引起的表皮细胞损伤具有清除自由基,抗氧化作用。随着对皮肤氧化衰老机制的深入研究,表皮干细胞在皮肤衰老中作用日益受到重视[25-26]。研究表明,大鼠背部提取的表皮干细胞有利于创伤修复及血管形成,可重建新生组织[27]。本研究通过免疫磁珠法分选获得CD49f+/CD71-标记的小鼠表皮干细胞,结果表明,构树叶总黄酮对CD49f+/CD71-小鼠表皮干细胞有促进增殖作用,当黄酮类物质终浓度为25、50 μg/mL时,细胞相对活力明显高于空白对照组(P均<0.01)。
GSH 是机体内非酶性抗氧化物,能维持氧化还原稳态及细胞膜完整性[28];MDA 是氧化应激标志物,可反映机体内脂质过氧化程度和受自由基攻击的严重程度[29]。本研究结果表明,黄酮类物质可增加GSH 水平,降低MDA 水平,从而发挥抗氧化损伤作用。当黄酮类物质终浓度为12.5、25、50 μg/mL时,GSH含量明显高于阴性对照组(P均<0.05),MDA含量明显低于对照组(P均<0.05)。
构树中黄酮物质丰富,可分离多种黄酮类化合物,包括黄酮、构树醇、黄酮醇、二氢黄酮、芹菜素、槲皮素等[30]。本研究提取的是总黄酮类物质,黄酮类的具体组分还需进一步分析,这是本研究后续工作的目标之一。另外,构树叶原液中总黄酮物质可通过碱溶酸沉法提取再利用,黄酮类物质具有促进小鼠表皮干细胞增殖和抗氧化作用,这为构树叶资源再利用奠定了基础,同时也为皮肤的氧化衰老及护肤品的开发应用提供了一个新的思路。本研究仅对构树叶总黄酮进行了初步功能验证,其具体的活性成分和信号通路机制,有待验进一步深入研究。

