狂犬病病毒CVS-11毒株基质蛋白鼠源和兔源多克隆抗体的制备、鉴定及比较
牟韶璐,范家琛,崔灿,张曦,许运斌
遵义医科大学贵州省普通高等学校传染病与生物安全特色重点实验室,贵州 遵义 563000
狂犬病是由狂犬病病毒(rabies virus,RV)引起的人畜共患急性传染病[1],每年全球约有59 000 人死于该病[2]。人感染RV 后,若不及时、有效处理,一旦出现脑脊髓炎症状后,死亡率高达100%[3]。RV是不分节段的单股负链RNA 病毒,属于弹状病毒科(Rhabdoviridae)狂犬病病毒属(Lyssavirus),具有严格的嗜神经性[4]。其基因可编码5种蛋白:核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)和RNA 依赖性RNA聚合酶L[5]。
作为RV 相对分子质量最小的结构蛋白[6],M 蛋白能够调节转录和复制的平衡[7],在病毒感染早期阶段,可通过与宿主基因相互作用影响病毒脱壳[8];在病毒感染后期可诱导细胞凋亡以促进病毒复制[9],并在病毒组装、成熟和出芽过程中发挥重要作用[10-11]。目前,针对M 蛋白的多克隆抗体研究相对较少,且部分毒株可能存在抗原性效果不佳的现象。赵雪超等[12]用回收纯化方法纯化蛋白,蛋白结构发生热变性,由此导致了蛋白质空间结构的不确定性。郑光来等[13]运用杆状病毒表达M 蛋白,虽然表达的蛋白有转录和翻译后的加工,但因成本较高,不适用于大量制备。
本研究经原核表达RV M蛋白,分别免疫BALB/c小鼠和新西兰大白兔制备多克隆抗体,采用ELISA法检测其效价,Western blot 法、免疫沉淀(immunoprecipitation,IP)法、免疫荧光试验(immunofluorescence assay,IFA)检测其反应原性,为抗原表位分析及解析RV M蛋白在RV感染过程中的生物学功能提供了抗体工具。
1 材料与方法
1.1 实验动物 SPF 级BALB/c 小鼠,雌性,5 只,体质量(23 ± 3)g,6 ~8 周龄,购自遵义医科大学实验动物管理中心,动物合格证号:SCXK(黔)2021-0002。本实验均以科研为目的进行小鼠的养殖和使用,且按照动物伦理相关规定进行,文件号:遵义伦审(2019)2-007号;伦审(2018)2-071号。
1.2 病毒、菌株及细胞 RV CVS-11、RV SRV9毒株及原核表达载体pET-28a(+)、E.coliDH5α、E.coliBL21(DE3)、人神经母细胞瘤SK-N-SH 细胞均由本实验室于液氮罐或-80 ℃冰箱保存。
1.3 主要试剂及仪器 弗氏完全佐剂、弗氏不完全佐剂购自默克化工技术(上海)有限公司;Ni-NTA His标签蛋白纯化试剂盒、ELISA显色液购自生工生物工程(上海)股份有限公司;双色预染蛋白Marker WJ102购自上海雅酶生物医药科技有限公司;Bradford 法蛋白定量试剂盒、RIPA 裂解液购自上海碧云天生物技术有限公司;ELISA 终止液购自北京索莱宝科技有限公司;Alexa Flour 594山羊抗鼠IgG、Alexa Flour 647山羊抗兔IgG 购自美国CST 公司;ProteinA/G 琼脂糖珠购自圣克鲁兹生物技术(上海)有限公司;Chemi-DocTouch化学发光成像系统购自美国Bio-Rad公司;激光共聚焦显微镜成像系统购自德国ZEISS公司。
1.4 原核表达载体的构建 根据GenBank 上登录的RV CVS-11 株M 蛋白基因序列(GQ918139.1),结合pET-28a(+)载体多克隆位点酶切序列,设计引物。上游引物序列:5′-CGCGGATCCGCGATGAACGTTCTACGCAAGAT-3′(下划线部分为BamHⅠ酶切位点);下游引物序列:5′-CCCCAAGCTTGGGGTTATTCTAGAAGCAGAGAAGAGTC-3′(下划线部分为HindⅢ酶切位点)。采用Trizol 法[14]提取RV CVS-11 感染的SK-N-SH细胞总RNA,参考阙海平等[15]方法,将RNA反转录为cDNA,以其为模板,利用特异性引物对M全长基因进行PCR 扩增。反应条件:95 ℃预变性2 min;95 ℃变性10 s,45 ℃退火10 s,72 ℃延伸30 s,共30个循环;72 ℃延伸10 min。用BamHⅠ和HindⅢ将PCR 产物与pET-28a(+)载体连接,构建M全长基因原核表达载体pET-28a-M,转化E.coliBL21(DE3)感受态细胞,挑取单克隆进行PCR 鉴定。阳性单克隆送生工生物工程(上海)股份有限公司测序。
1.5 兔源M 蛋白多克隆抗体的制备 委托杭州华安生物技术有限公司完成,包括M 蛋白的表达、纯化以及新西兰大白兔免疫(免疫第7周取全血,分离血清)。
1.6 鼠源M蛋白多克隆抗体的制备
1.6.1 pET-28a-M载体的表达 将pET-28a-M载体转化E.coliBL21(DE3)感受态细胞,挑取单克隆,接种至含1 mmol/L 卡那霉素的LB 培养基,参考文献[16-17]设置诱导条件为37 ℃,160 r/min培养至A600达0.6 ~0.8 后,加入IPTG 至终浓度为1 mmol/L,28 ℃诱导6 h;4 ℃,8 800 ×g离心5 min;收集菌体,PBS重悬,冰浴超声破碎,4 ℃,13 225×g离心20 min;收集菌体,超声破碎,收集上清和沉淀进行10%SDSPAGE 分析,鉴定M蛋白的表达及表达方式。以pET-28a(+)空载和诱导前菌体作为阴性对照。
1.6.2 M蛋白的纯化 按照1.6.1项方法大量诱导菌体,参考杨晰朦等[18]方法进行变性条件下M 蛋白的纯化,收集蛋白洗脱液,进行10% SDS-PAGE 分析。将蛋白洗脱液放入透析袋中密封,参考章民[19]方法设6、4、3、2、1、0 mol/L 尿素的梯度无菌复性液复性M 蛋白;PEG20000 覆盖在透析袋外周,4 ℃浓缩蛋白2 h。Bradford法检测复性后蛋白浓度。
1.6.3 多克隆抗体的制备 将5 只BALB/c 小鼠适应性饲养1 周。参考文献[20-22,23]设置免疫周期和剂量。将蛋白溶液与等体积弗氏完全佐剂混合后充分乳化,进行初次免疫,与等体积弗氏不完全佐剂混合后充分乳化,分别于2、4、5 周后进行加强免疫。均为皮下多点注射,初次免疫150 μg/只,加强免疫100 μg/只。小鼠第6 周取全血,4 ℃放置2 h,4 ℃,2 200 ×g离心10 min,收集血清,-80 ℃保存备用。
1.7 M蛋白多克隆抗体效价的检测 采用ELISA法,具体操作参考霍娜等[24]方法。以检测孔A450/阴性孔A450≥2.1为阳性标准。
1.8 M蛋白多克隆抗体的反应原性鉴定
1.8.1 Western blot 法 用RV CVS-11 和SRV9 毒株分别感染SK-N-SH 细胞,同时设未感染RV 的SK-NSH 细胞为阴性对照,病毒感染48 h 后收集总蛋白,经10%SDS-PAGE 分离后,湿转至NC 膜,经5%脱脂奶37 ℃封闭1 h;分别以鼠源和兔源血清(均1∶500稀释)为一抗,Alexa Flour 594 山羊抗鼠IgG、Alexa Flour 647山羊抗兔IgG(均1∶4 000稀释)为二抗,进行Western blot分析,ECL显色。
1.8.2 IP 法 参考许运斌[25]方法,用RV CVS-11 和SRV9 毒株分别感染SK-N-SH 细胞,同时设未感染RV 的SK-N-SH 细胞为阴性对照,病毒感染48 h 后,用RIPA 裂解液获取细胞总蛋白,4 ℃,13 225 ×g离心10 min;收集上清,ProteinA/G 琼脂糖珠预处理,2 500×g离心5 min 去珠;分别加入鼠源和兔源血清(1∶50 稀释),4 ℃摇床过夜;用ProteinA/G 琼脂糖珠富集免疫复合物,4 ℃,2 500×g离心5 min收集琼脂糖珠;预冷1×PBS洗涤8次,每次洗涤后离心弃上清,RIPA 裂解液稀释琼脂糖珠后,加入5 × SDSPAGE 蛋白上样buffer,煮沸10 min,进行Western blot分析,方法同1.8.1项。
1.8.3 IFA 用RV CVS-11、SRV9 毒株分别感染SKN-SH 细胞,同时设未感染RV 的SK-N-SH 细胞为阴性对照,病毒感染48 h 后,按甲醇∶丙酮(V/V)=1∶1,-20 ℃固定30 min;1×PBS洗涤3次,每次5 min,分别加入鼠源(1∶50 稀释)和兔源(1∶100 稀释)血清,37 ℃孵育1 h;1×PBS 洗涤3 次,每次5 min,分别加入Alexa Flour 594 山羊抗鼠IgG、Alexa Flour647 山羊抗兔IgG(1∶300 稀释),37 ℃1 h;1 × PBS 洗涤3次,每次5 min,蔡司共聚焦显微镜观察及拍照。
1.9 数据采集及分析 使用ChemiDocTouch 化学发光成像系统对考染的SDS-PAGE 胶或免疫印迹膜进行曝光及拍照;使用激光共聚焦显微镜成像系统对免疫荧光试验的细胞进行观察和拍照。
2 结果
2.1 pET-28a-M载体的鉴定 测序结果显示,质粒中M基因序列正确,未发生移码,表明原核表达载体pET-28a-M构建正确。
2.2 表达产物的鉴定 诱导后菌体蛋白含量高于诱导前,表明M 蛋白在E.coli中获得高效表达,表达的蛋白相对分子质量约27 000,主要以包涵体形式存在,见图1。
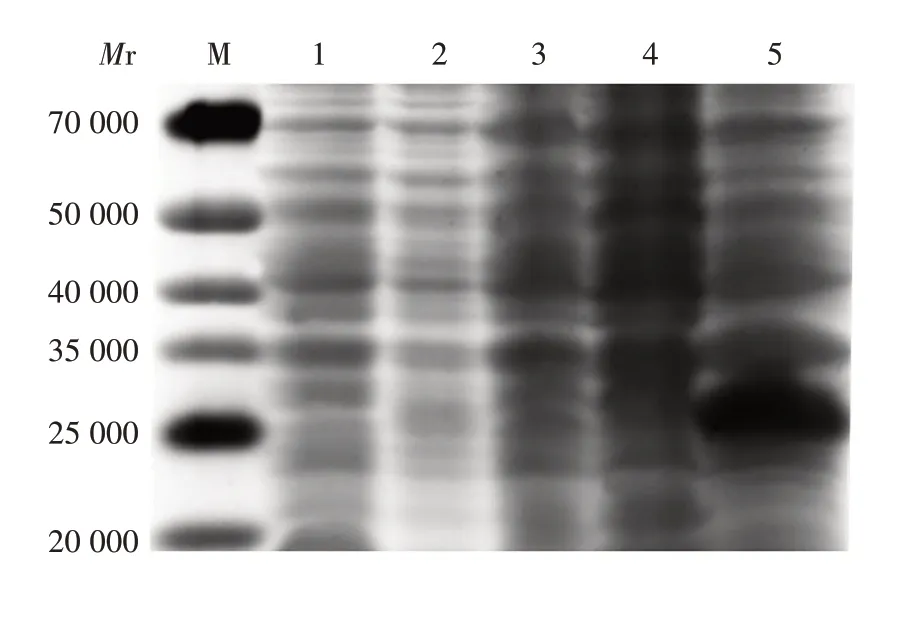
图1 表达产物的SDS-PAGE分析Fig.1 SDS-PAGE analysis of expressed products
2.3 纯化产物的鉴定 纯化的M 蛋白在相对分子质量约27 000 处可见明显条带,大小与预期相符,见图2。表明M 蛋白纯化效果良好,可用于抗体制备。复性后蛋白浓度为1.05 mg/mL。
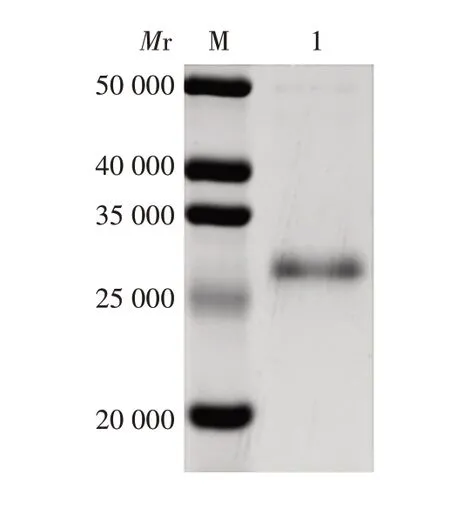
图2 纯化产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of purified products
2.4 鼠源和兔源多克隆抗体效价 鼠源多克隆抗体效价为1∶100,兔源多克隆抗体的效价为1∶256 000。
2.5 鼠源和兔源多克隆抗体的反应原性
2.5.1 Western blot法 感染CVS-11和SRV9的SK-NSH 细胞总蛋白在相对分子质量约27 000 处均可见特异性条带,而阴性对照未见此条带,两种多克隆抗体与未感染CVS-11 和SRV9 的SK-N-SH 细胞蛋白均不发生反应,见图3。

图3 鼠源和兔源多克隆抗体反应原性的Western blot鉴定Fig.3 Identification of reactivity of murine and rabbit polyclonal antibodies by Western blot
2.5.2 IP 法 感染CVS-11 和SRV9 的SK-N-SH 细胞总蛋白相对分质量约27 000,大小与预期相符,两种多克隆抗体与阴性对照均不发生反应,见图4。
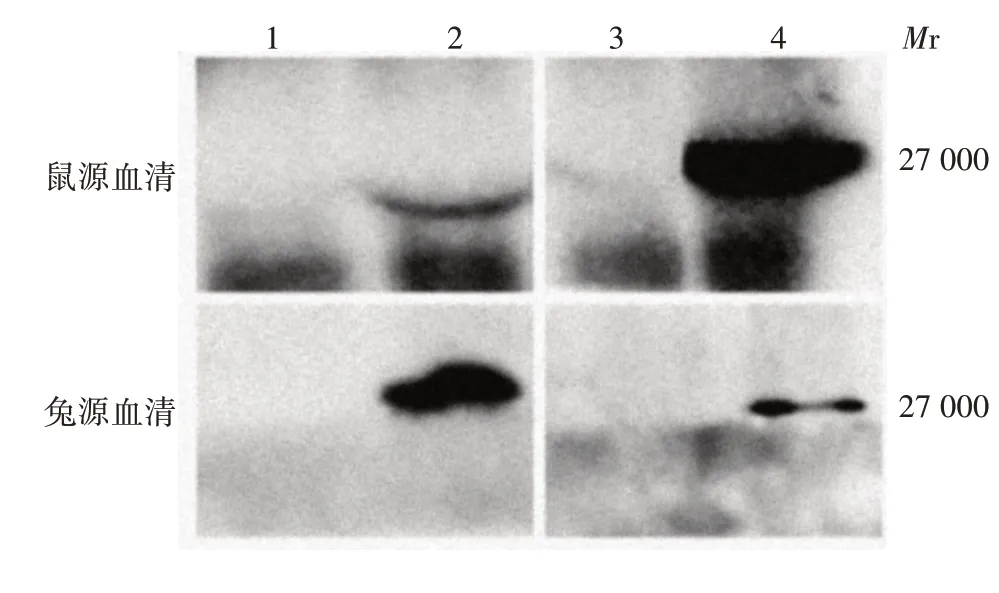
图4 鼠源和兔源多克隆抗体反应原性的IP鉴定Fig.4 IP identification of reactivity of murine and rabbit polyclonal antibodies
2.5.3 IFA 鼠源和兔源多克隆抗体均能成功标记两种毒株感染细胞中的病毒M 蛋白,但鼠源多克隆抗体对SK-N-SH 细胞中SRV-9 毒株M 蛋白标记效果一般,见图5。

图5 鼠源和兔源多克隆抗体反应原性的IFA鉴定(×63)Fig.5 IFA identification of reactivity of murine and rabbit polyclonal antibodies(×63)
3 讨论
本研究中,用镍柱亲和层析法纯化回收带有His标签的目的蛋白,相较于直接从SDS-PAGE 中回收[12],蛋白不受高温影响;再结合尿素浓度梯度复性,可使M 蛋白构型更趋近于其原始构型,能更好地保留M 蛋白的抗原性。本研究运用IFA 对制备的两种多克隆抗体与RV CVS-11或SRV9毒株感染的SKN-SH 细胞中病毒M 蛋白的反应原性进行分析,与单用Western blot[13,23]相比,能显示出被抗体荧光标记的M 蛋白在细胞内的定位情况,适用于细胞蛋白与病毒蛋白在细胞内的定位情况分析。IFA结果显示,鼠源多克隆抗体与CVS-11 毒株反应原性良好,与SRV9 毒株反应原性较弱,而兔源多克隆抗体与两种毒株的反应原性均较好,可能由于动物种类不同,对同种蛋白的不同抗原表位的免疫应答能力存在差异,导致不同种类动物机体中产生的多克隆抗体有效组分也会存在差异,因此其IFA 反应原性也存在一定差异。LIU 等[26]利用小鼠制备的抗CVS-11M 蛋白单克隆抗体对CVS-11 感染小鼠的大脑皮层锥体神经元有染色作用,但对HEP-Flury感染小鼠的脑组织无反应,也可能是同一个原因导致。赵雪超等[12]制备兔源抗体的同时,采用相应免疫原免疫了1 批小鼠,但其免疫效果较低。而本研究制备的鼠源多克隆抗体效价相较于兔源多克隆抗体效价也严重偏低。因此,推测对于抗体制备而言,采用新西兰大白兔进行免疫,其免疫系统可对免疫原更多的抗原表位产生免疫应答,可制备各方面反应原性较好的多克隆抗体。且兔源多克隆抗体制备时操作简单,量大质优,不失为一种制备多克隆抗体的高效选择;其次,与单克隆相比,多克隆抗体可识别更多的抗原表位,在研究M 蛋白与宿主蛋白相互作用关系时有更大几率发现与M蛋白相互作用的宿主蛋白。
综上所述,本研究成功制备了M 蛋白多克隆抗体,其反应原性良好,可用于研发与RV 相互作用的宿主蛋白,也可为病毒M蛋白在RV感染过程中的作用及其分子机制的探讨提供基础性生物学工具。
——兼与亚当·斯密《道德情操论》比较

