抗IL-17A单抗调控痛风自噬及痛风炎症的机制
王鹏,黄玉琴,雷天意,张曾,郭建伟,余玲,青玉凤,张全波
1.川北医学院附属医院高尿酸血症与痛风研究所,四川 南充 637000;2.川北医学院附属医院,四川 南充 637000;3.四川省仪陇县人民医院,四川 南充 637000;4.川北医学院基础与法医学院,四川 南充 637000
痛风是一种由单钠尿酸盐(monosodium urate,MSU)晶体异常沉积引起的慢性自身炎性疾病[1]。近年来,痛风的发病率和患病率逐年升高[2-4],易伴高血压病、高胆固醇血症、糖尿病等合并症[5]。随着全球人口老龄化[6],痛风可能成为社会潜在的巨大经济负担。急性痛风治疗药物主要包括非甾体抗炎药、秋水仙碱、糖皮质激素,虽然这些药物可缓解痛风的急性炎症,但由于不良反应、禁忌症及疗效欠佳,临床使用常受限[7]。
自噬是一系列维持细胞内稳态的溶酶体过程[8-10],可双向调节炎性反应[11]。研究表明,自噬缺陷或放松调控与人类各种疾病有关,如癌症、传染性疾病、自身免疫性疾病、心血管疾病、风湿性疾病、代谢性疾病等[12-13]。自噬过程包括启动、成核、伸长、成熟、融合和降解等阶段,均受到自噬相关基因(autophagyrelated gene,ATG)的调控。Beclin-1可直接参与自噬启动,ATG16L1 可与ATG5-ATG12 偶联,形成多聚复合物,促进自噬体形成,该过程需要ATG7 的催化。ATG4B可对自噬膜上微管相关蛋白1轻链3B(microtubule-associated protein 1 light chain 3B,LC3B)进行特异性切割。LC3B 是自噬体形成标志,通过检测LC3B-Ⅱ蛋白水平可判断自噬强弱[14]。ZH-ANG 等[15]证明,半日花烷型二萜Leojaponin通过恢复自噬改善MSU 晶体诱导的急性痛风性关节炎。HSIEH 等[16]报道,4-hydroxy auxarconjugatin B(一种合成的自噬诱导剂)可通过NAD-依赖性去乙酰化酶(sirtuin-1,SIRT1)依赖性自噬诱导途径抑制核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain receptor protein 3,NL-RP3)炎性小体的激活。以上研究表明,自噬参与了痛风的炎症调节。
IL-17A 是痛风中重要的促炎细胞因子[17],可诱导或抑制自噬而调控炎症[18-19]。抗IL-17A 单抗(司库奇尤单抗,secukinumab)是一种针对IL-17A 的高亲和性全人源IgG1/κ 型单抗,可选择性地结合并中和IL-17A 从而抑制炎症,已被批准用于中重度斑块状银屑病[20]及强直性脊柱炎(ankylosing spondylitis,AS)的临床治疗[21],但目前在痛风中未见相关研究。本研究通过检测ATG4B、ATG7、ATG16L1、Beclin-1和LC3B在痛风中的表达,建立体外急性痛风炎症细胞模型,评估司库奇尤单抗对自噬及炎症的作用,并探讨司库奇尤单抗通过调控自噬缓解痛风炎症的作用机制。
1 材料与方法
1.1 主要试剂及仪器 人外周血淋巴细胞分离液购自天津灏洋生物科技公司;尿酸及秋水仙碱购自美国Sigma-Aldrich 公司;司库奇尤单抗购自瑞士诺华制药公司(生产批号:SDWX2;生产日期为2021 年9月,有效期至2023 年8 月);TRIzol 及逆转录试剂购自日本TaKaRa 公司;ELISA 试剂盒购自武汉菲恩生物科技公司;RIPA 裂解液、BCA 蛋白检测试剂盒、极超敏ECL 发光试剂盒购自上海碧云天生物技术有限公司;兔抗GAPDH、IL-1β、LC3B、ATG16L1、ATG4B、ATG7、Beclin-1 单抗及HRP 标记的山羊抗兔IgG 购自美国Cell Signaling 公司;紫外分光光度计购自美国Thermo Fisher 公司;酶标仪、PCR 操作系统CFX96及凝胶成像系统均购自美国Bio-Rad公司。
1.2 研究对象 收集2021 年11 月—2022 年10 月川北医学院附属医院风湿免疫科就诊的原发性痛风患者外周静脉血114 份,其中急性期痛风(acute gout,AG)患者、间歇期痛风(intermittent gout,IG)患者各57 份。所有患者均符合2015 年美国风湿病学会/欧洲抗风湿病联盟(American College of Rheumatology/European League Against Rheumatism,ACR/EULAR)制订的痛风诊断标准[22]。以同期来自川北医学院附属医院健康体检中心的健康男性志愿者外周静脉血82份作为健康对照(HC)组(除外炎性关节病、痛风病史及家族史、癌症、血液病、肾病、感染或其他自身免疫性疾病史)。本研究由川北医学院附属医院伦理委员会批准(2022ER327-1),所有患者及健康志愿者均知情同意。
1.3 样本处理及MSU晶体制备 采用Ficoll-Hypaque密度梯度离心法从外周静脉血中分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),于-80 ℃保存,用于后续试验。将1 g尿酸溶解在含6 mL NaOH 的200 mL 沸水中,加入盐酸调pH 至7.2,室温冷却、搅拌,4 ℃过夜;过滤沉淀并低热干燥获得MSU晶体,称重,最终配制成溶于PBS 的25 mg/mL 悬浮液,于4 ℃保存备用。
1.4 急性痛风炎症模型的建立 取5 份健康志愿者外周静脉血,4 mL/管,肝素锂抗凝,均加入MSU 晶体至终浓度为100 μg/mL,混匀,37 ℃,5%CO2加湿温箱中孵育,按照不同时间点(0、1、2、4、6、8 h)收集血浆及PBMCs备用。
1.5 司库奇尤单抗浓度筛选 取5份健康志愿者外周静脉血,4 mL/管,肝素锂抗凝,分为5组:第1组加入等量PBS 作为对照组,其余4 组加入MSU 至终浓度为100 μg/mL 后,依次加入0、100、200、400 μmol/L司库奇尤单抗,37 ℃,5%CO2加湿温箱中孵育4 h,收集血浆及PBMCs备用。
1.6 司库奇尤单抗干预急性痛风炎症模型的建立 取5 份健康志愿者外周静脉血各16 mL,分为对照组、MSU、MSU+秋水仙碱、MSU+司库奇尤单抗组。对照组不经MSU处理,另3组均加入MSU晶体混悬液至终浓度100 μg/mL;MSU+秋水仙碱组加入秋水仙碱至终浓度为30 μg/mL,MSU+司库奇尤单抗组加入司库奇尤单抗至终浓度400 μmol/L。均于37 ℃,5%CO2加湿温箱中孵育4 h,收集血浆及PBMCs备用。
1.7 RT-qPCR 检测 用TRIzol 试剂提取各组细胞总RNA,紫外分光光度仪检测RNA 浓度。选择吸光度为1.8 ~2.0 的总RNA,按照逆转录试剂说明书逆转合成cDNA,以其为模板进行PCR 扩增。ATG4B、ATG7、Beclin-1、LC3B、IL-1β、ATG16L1、GAPDH基因引物序列见表1,引物由生工生物工程(上海)股份有限公司合成。RT-qPCR总体积为20 μL:Power SYBR Green PCR Master Mix 10 μL,cDNA 2 μL,正向和反向引物各0.3 μL,ddH2O 7.4 μL。反应条件为:95 ℃变性30 s,95 ℃退火5 s,60 ℃延伸34 s,共40 个循环。目的基因Ct值减去内参基因Ct值为△Ct,以2-△Ct为目的基因相对表达量。

表1 引物序列Tab.1 Primer sequences
1.8 ELISA检测 按试剂盒说明书检测IL-1β、IL-12和IL-35表达水平,绘制标准曲线,计算样本表达量。
1.9 Western blot 检测 将收集的PBMCs 加入含有蛋白酶抑制剂的RIPA 裂解液冰上裂解30 min;4 ℃,12 000 ×g离心10 min;收集上清液,提取总蛋白,BCA 试剂盒测定蛋白浓度;加入上样缓冲液,煮沸10 min;取30 μg 蛋白,经10% SDS-PAGE 分离蛋白,湿转法转至PDVF 膜上,5%脱脂奶粉室温封闭1 h;TBST洗膜3次,加入兔抗GAPDH、IL-1β、LC3B、ATG-16L1、ATG4B、ATG7、Beclin-1单抗(均1∶1 000稀释),4 ℃摇床过夜;TBST 洗膜3 次,加入HRP 标记的羊抗兔IgG(1∶2 000 稀释),室温孵育1 h;TBST 洗膜3次,用极超敏ECL 发光试剂盒对膜进行可视化处理。Image J 软件对条带灰度值进行定量,目的基因蛋白与GAPDH蛋白的比值为相对表达量。
1.10 统计学分析 采用GraphPad Prism 8.0.1 软件进行统计学分析。多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著差异检验(LSD-t)。以P<0.05为差异有统计学意义。
2 结果
2.1 ATG mRNA 在痛风中的表达 AG、IG 和HC 组ATG4B、Beclin-1和LC3BmRNA转录水平差异有统计学意义(F分别为3.896、11.78、3.856,P均<0.05),其中AG 组ATG4B、Beclin-1、LC3BmRNA 转录水平分别低于IG 和HC 组(t分别为2.692、3.234、2.231 和2.085、4.795、2.748,P均<0.05),但IG 与HC组间差异无统计学意义(t分别为0.839 5、1.282、0.7594,P均>0.05);ATG16L1mRNA 转录水平在三组间差异有统计学意义(F=7.949,P <0.001),且在AG 组显著低于HC 组(t=3.860,P<0.001),但与IG 组相比,差异无统计学意义(t= 1.257,P >0.05);AG 组ATG7mRNA 转录水平高于IG 组,差异有统计学意义(t= 2.109,P <0.05),但与HC 组相比,差异无统计学意义(t=1.822,P >0.05)。见图1。
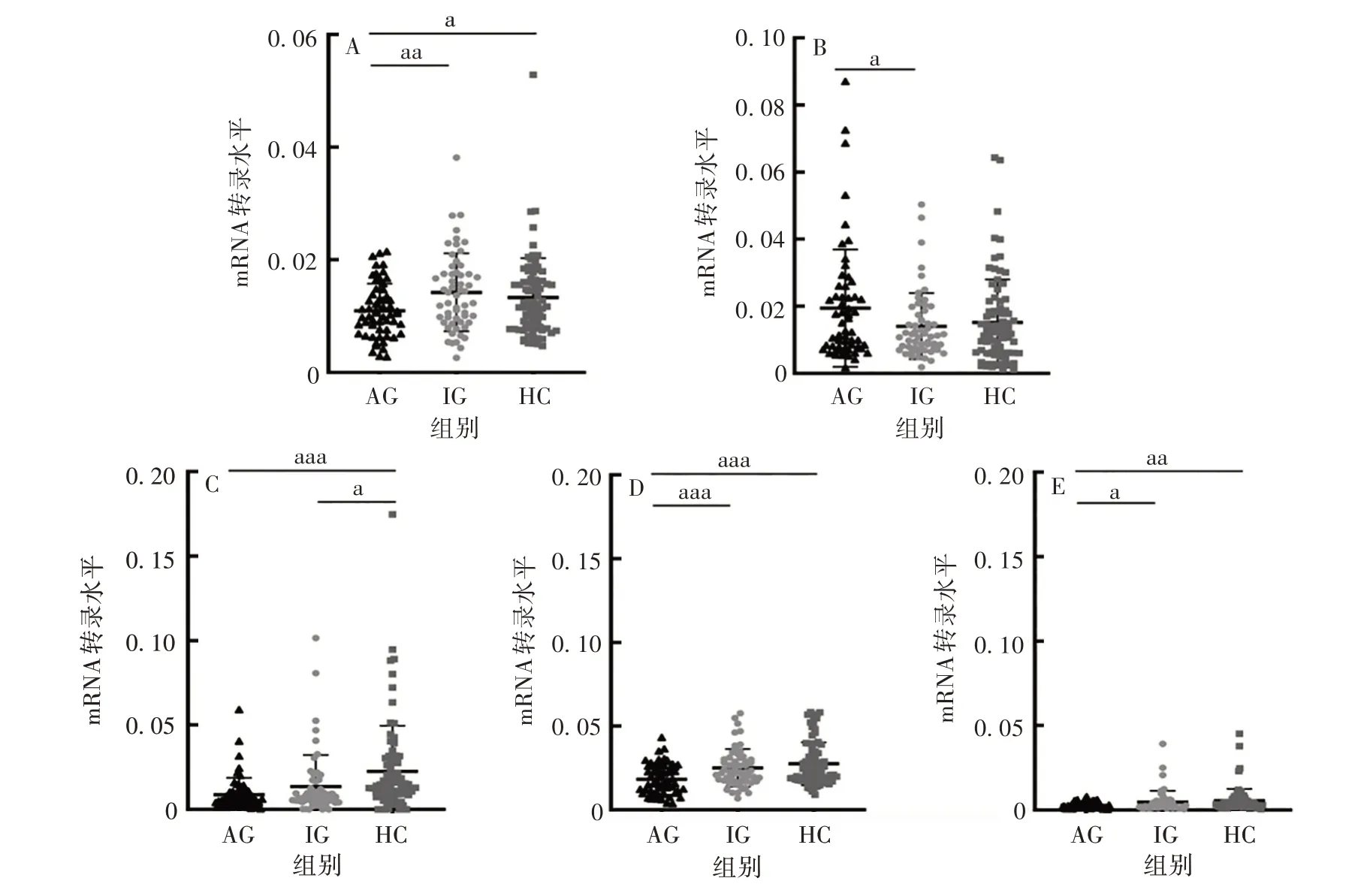
图1 各组ATG4B(A)、ATG7(B)、ATG16L1(C)、Beclin-1(D)和LC3B(E)mRNA转录水平Fig.1 Transcription levels of ATG4B(A),ATG7(B),ATG16L1(C),Beclin-1(D)and LC3B(E)mRNA in various groups
2.2 急性痛风炎性因子水平变化 在建立的急性痛风炎症模型中,IL-1βmRNA 转录水平在2 h 时迅速达到高峰(F=88.56,P<0.001),随后迅速下降;IL-1β 蛋白表达水平在4 h 达到高峰(F= 351.3,P<0.001),随后逐渐下降。见图2。表明急性痛风炎性反应在2 ~4 h时可达到高峰。
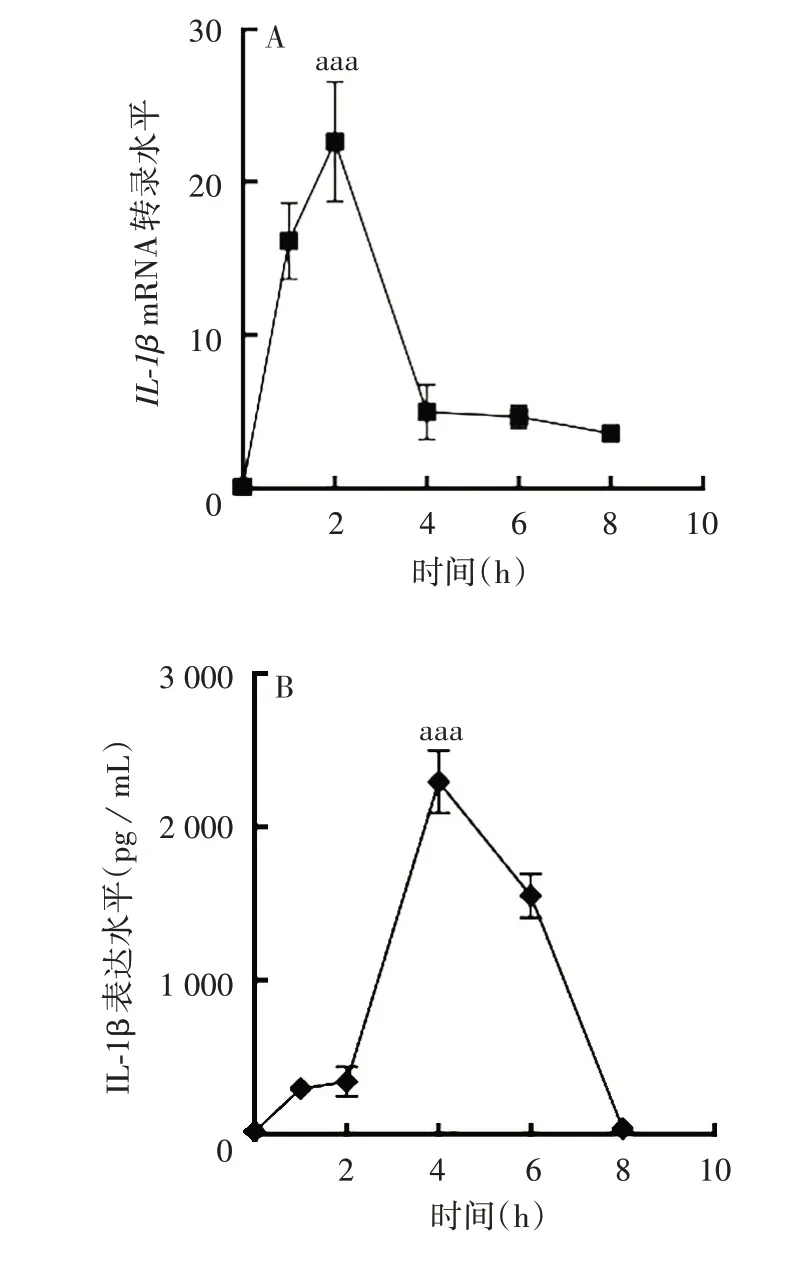
图2 急性痛风炎症模型中IL-1β mRNA 转录(A)及蛋白(B)表达水平Fig.2 IL-1β mRNA(A)and protein(B)expression in AG inflammation model
2.3 不同浓度司库奇尤单抗对急性痛风炎症的影响MSU 组IL-1β mRNA 转录及蛋白表达水平明显高于对照组,差异有统计学意义(t分别为5.488、4.261,P均<0.01)。与MSU 组相比,IL-1β mRNA 转录及蛋白表达水平在不同浓度MSU+司库奇尤单抗组中均有下降,其中MSU+400 μmol/L司库奇尤单抗组降低最显著,差异有统计学意义(t分别为3.099、3.334,P均<0.05)。见图3。表明高剂量司库奇尤单抗可有效抑制MSU晶体诱导的急性痛风炎症。

图3 不同浓度司库奇尤单抗对急性痛风炎症模型中IL-1β mRNA转录(A)及蛋白(B)表达水平的影响Fig.3 Effect of different concentrations of secukinumab on IL-1β mRNA(A)and protein(B)expression in AG inflammation model
2.4 司库奇尤单抗对急性痛风ATG mRNA转录、蛋白及炎性细胞因子水平的影响与对照组相比,MSU组IL-1β mRNA 转录及蛋白表达水平均明显升高,差异有统计学意义(F分别为12.80、230.4,P均<0.001),表明MSU 晶体成功诱导了急性痛风炎症模型。与MSU 组相比,MSU+秋水仙碱和MSU+司库奇尤单抗组IL-1βmRNA 转录及蛋白表达水平均降低,差异有统计学意义(t分别为4.906、13.46和3.116、16.16,P均<0.05),表明秋水仙碱及司库奇尤单抗均可有效抑制MSU晶体诱导的急性炎症。MSU+司库奇尤单抗组ATG16L1和LC3BmRNA 转录水平低于MSU组,差异有统计学意义(t分别为2.343、2.916,P均<0.05);MSU+司库奇尤单抗和MSU 组ATG4BmRNA转录水平差异无统计学意义(t=0.588 7,P>0.05);MSU + 司库奇尤单抗组ATG7mRNA 转录水平低于MSU组,但差异无统计学意义(t=0.4602,P >0.05)。见图4。
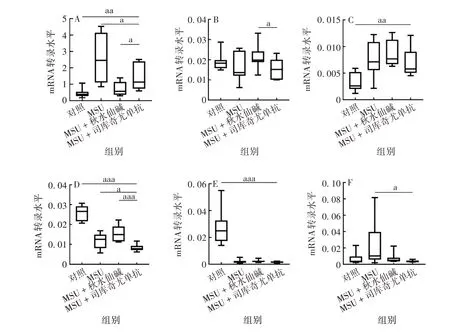
图4 司库奇尤单抗对急性痛风ATG及IL-1β mRNA转录水平的影响Fig.4 Effect of secukinumab on expression levels of ATGs and IL-1β mRNA in AG model
与MSU组相比,MSU+司库奇尤单抗组ATG4B、ATG7、Beclin-1、ATG16L1、LC3B-Ⅱ蛋白表达水平均显著降低,差异有统计学意义(t分别为28.84、11.6、8.402、4.124和2.458,P均<0.05);MSU+秋水仙碱组ATG16L1、LC3B-Ⅱ蛋白表达水平较MSU 组增加,差异有统计学意义(t分别为8.549、10.01,P均<0.05)。见图5和图6。
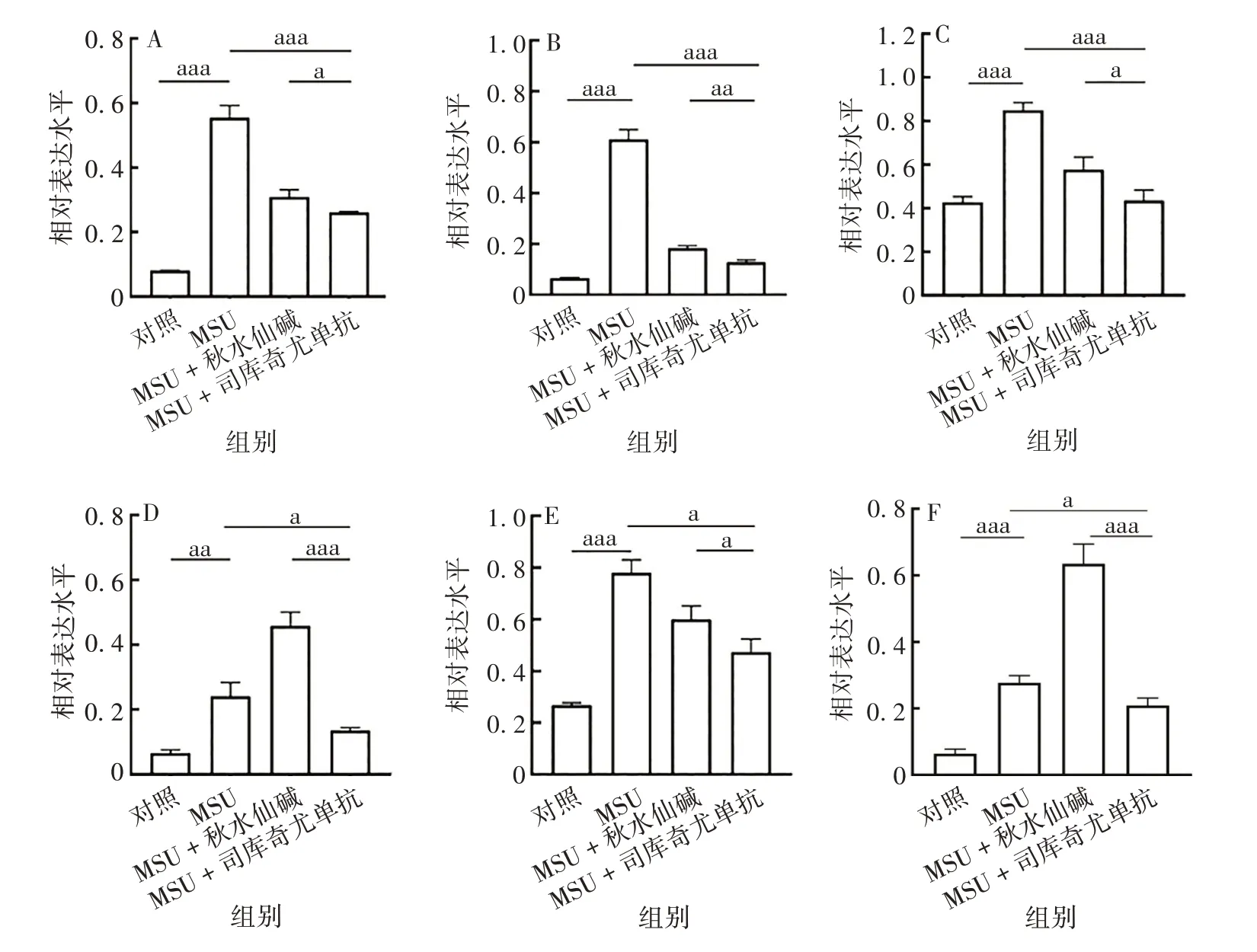
图5 司库奇尤单抗对急性痛风ATG及IL-1β蛋白表达的影响Fig.5 Effect of secukinumab on expression levels of ATGs and IL-1β protein in AG model
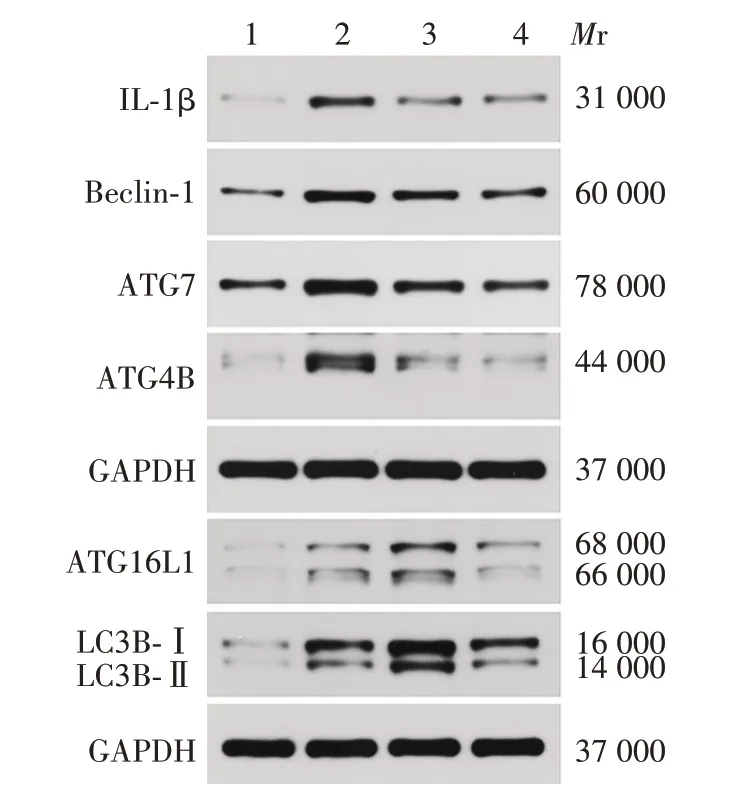
图6 司库奇尤单抗对急性痛风ATG 及IL-1β 蛋白表达影响的Western blot分析Fig.6 Western blot analysis of effect of secukinumab on expression levels of ATGs and IL-1β protein in AG model
2.5 司库奇尤单抗对急性痛风炎性细胞因子水平的影响 对照、MSU、MSU + 秋水仙碱、MSU + 司库奇尤单抗组间IL-12 和IL-35 蛋白表达水平差异有统计学意义(F分别为7.009、6.518,P均<0.01)。其中,与MSU组相比,MSU+司库奇尤单抗组IL-12蛋白表达水平降低,差异有统计学意义(t=2.604,P<0.05),IL-35 蛋白表达水平也降低,但差异无统计学意义(t=1.928,P >0.05)。见图7。
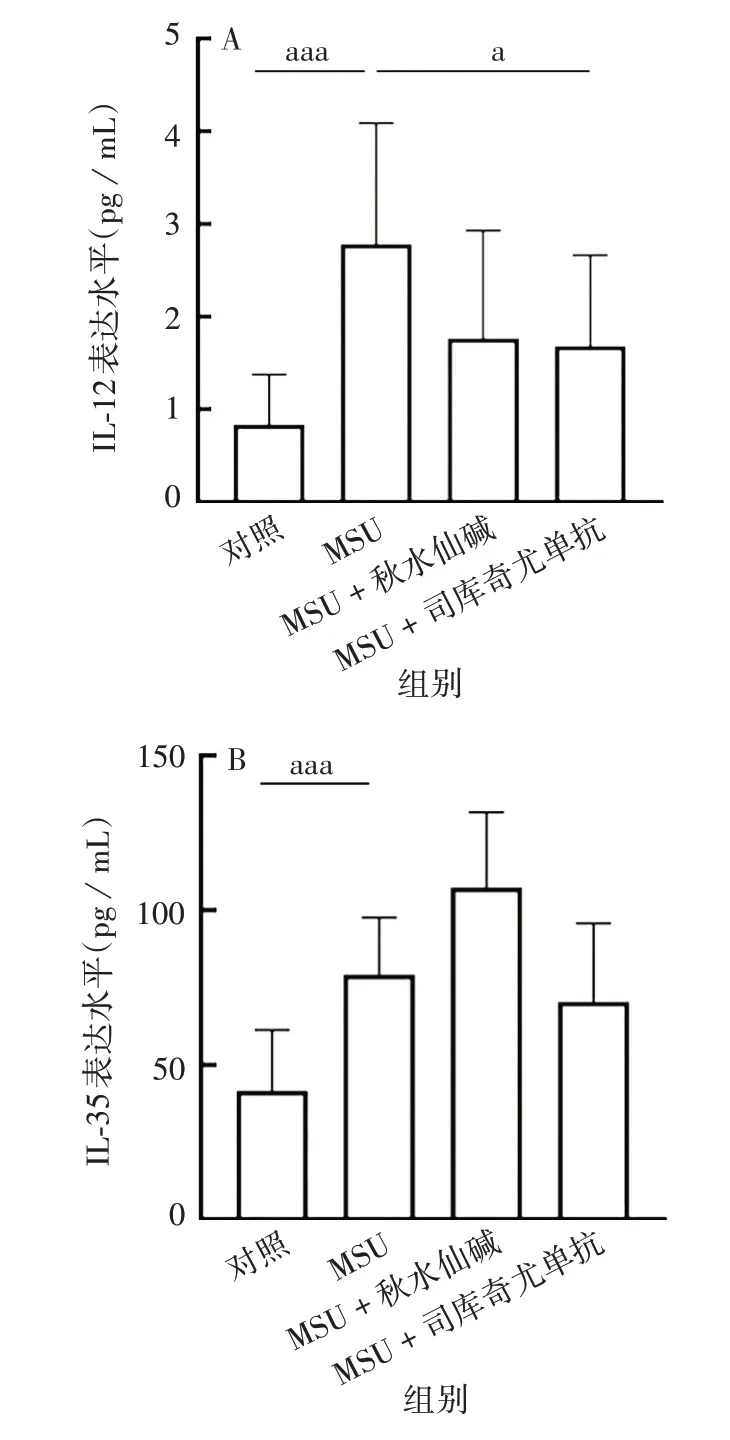
图7 司库奇尤单抗对急性痛风炎症模型中IL-12(A)、IL-35(B)表达水平的影响Fig.7 Effect of secukinumab on expression levels of IL-12(A)and IL-35(B)protein in AG model
3 讨论
痛风作为一种炎性代谢性疾病,反复发作可导致慢性滑膜炎、结构性关节损伤、尿酸性肾病等。QING 等[23]和SZEKANECZ 等[24]研究证实,Toll 样受体信号通路(TLR4-NF-κB 通路)与NOD 样受体(nucleotide oligomerization domain-like receptor,NLR)信号通路是痛风性关节炎的经典炎性信号通路。自噬具有抑制内源性炎症的能力[25],其在痛风中的表现日益受到关注。司库奇尤单抗作为IL-17A 拮抗剂,能靶向IL-23/IL-17A 抑制炎症,在银屑病和强直性脊柱炎中已被证实有明显抗炎效应[20,26-27],但与痛风自噬、炎症的关系尚未见报道。
本研究中AG 组ATG4B、Beclin-1和LC3BmRNA在痛风中转录水平降低,急性期更低。ATG16-L1mRNA 在痛风中转录水平也明显降低,提示痛风自噬的基础活性较低。ATG 在痛风不同时期的差异表达明确自噬参与了痛风发病,这与黄玉琴等[28]报道一致。首先,本研究用MSU 刺激健康志愿者外周静脉血成功建立了急性痛风炎症模型,并评估了司库奇尤单抗对急性痛风中ATG mRNA、蛋白及炎性细胞因子的影响。与MSU组相比,MSU+司库奇尤单抗组ATG16L1和LC3BmRNA 转录水平降低,ATG4B、ATG7、Beclin-1、ATG16L1、LC3B-Ⅱ蛋白表达水平降低,表明司库奇尤单抗在转录及翻译水平均能显著下调痛风自噬。其中ATG16L1在司库奇尤单抗干预后转录及翻译水平均明显降低,提示ATG16L1 可能是司库奇尤单抗调控痛风自噬的关键基因。ATG16L1是自噬过程的核心蛋白,ATG16L1 与ATG5-ATG12 复合物中的隔离膜结合形成ATG5-ATG12-ATG16L1铰链复合体,促进磷脂酰乙醇胺与LC3 结合,有助于自噬体的形成[29]。MIKI 等[30]研究报道,在帕金森病患者中ATG16L1mRNA 低表达,ATG16L1 蛋白表达水平显著增高,ATG16L1 以负反馈方式参与了帕金森病发生。推测痛风中可能存在类似情况。
有研究报道,患者使用IL-17A 抗体后血清IL-17A表达水平高低不一,部分银屑病患者使用IL-17A单抗后血清IL-17A 反而增高,临床却持续受益[31-32]。IL-17A表达水平作为IL-17A抗体抗炎效应评价指标存在争议。因此,本研究选择IL-12 与IL-35 表达水平以评估痛风炎性水平。IL-12和IL-35同属于IL-12家族细胞因子,IL-12 是炎性肠病、银屑病等炎性疾病中的重要促炎细胞因子[33-35]。IL-35 是调节性T 细胞(Tregs)分泌的细胞因子,能抑制免疫细胞炎性反应。本研究发现,与MSU 组相比,MSU + 司库奇尤单抗组IL-12、IL-1β表达水平显著降低,但IL-35却不明显,提示司库奇尤单抗可能通过抑制促炎细胞因子途径发挥作用,而非促进抑炎细胞因子表达。
本研究痛风模型中自噬下调与炎症缓解之间的因果关系尚不能确定。有研究发现,抑制ATG16L1,导致自噬小体形成障碍,增强p62 积累,促进了炎性因子IL-1β表达[36]。但也有报道指出,ATG16L1缺乏可增强机体对细菌感染免疫功能[37],ATG16L1 的低表达在特定情况下对机体可能是保护性因素[38]。表明自噬相关蛋白ATG16L1 对炎症的调控具有两面性。本研究中司库奇尤单抗同时降低了痛风自噬水平及促炎细胞因子表达,推测是在痛风急性发作期,IL-17A 等炎性因子水平突然升高,自噬水平增高,而司库奇尤单抗抑制了该阶段IL-17A 及其诱导的自噬,自噬以负反馈方式限制炎症,从而解释司库奇尤单抗下调自噬,缓解痛风炎症。本研究存在一定局限性,后续可在痛风炎症模型中敲除关键自噬基因后验证自噬及炎性水平,进一步评估司库奇尤单抗的作用。另外,本研究还发现,MSU+秋水仙碱组ATG16L1、LC3B-Ⅱ蛋白表达水平较MSU 组明显增高,与MSU+司库奇尤单抗组相反,提示秋水仙碱和司库奇尤单抗调控自噬的路径可能不同,具体机制仍有待进一步研究。
综上所述,ATG 在痛风不同阶段表达不同。司库奇尤单抗在转录及翻译水平下调自噬,降低促炎细胞因子水平,缓解痛风炎症。司库奇尤单抗可调控自噬,抑制痛风炎症。本研究为痛风治疗提供了参考。

