基于SCF/C-kit通路探讨三焦针法对腹泻型肠易激综合征大鼠的影响
尚雪梅 朱洲 潘莉 唐徐韵 宋光仙 石丽杉 程敏 杨孝芳
肠易激综合征(irritable bowel syndrome,IBS)作为一种慢性胃肠道疾病,临床特征主要表现为腹痛、腹泻及粪便性状改变[1-2]。在我国IBS发病率约占7%~11%,其中临床以腹泻型肠易激综合征(irritable bowel syndrome with diarrhea,IBS-D)最为常见,约占整个IBS患者数的74%[3-5]。近来研究发现,胃肠动力异常是引起IBS-D发病一大病理特征[6],研究认为,Cajal间质细胞(interstitial cells of Cajal, ICC)作为胃肠活动“起搏器”,其异常可导致胃肠动力障碍,而干细胞因子(stem cell factor,SCF)和酪氨酸激酶受体(tyrosine kinase receptor, C-kit)则可直接调控ICC功能的发挥[7]从而影响胃肠动力。因而,对SCF/C-kit通路在胃肠动力异常过程中的作用机理进行探讨具有一定意义。
中医学认为IBS-D病位在肠,与肝、脾、肾、肺等脏腑功能密切相关,其发病主要与情志失调、饮食不节、感受外邪等密切相关[8],但其根源于脏腑气机失调,从而诱发IBS-D。因而,调畅全身脏腑气机成为IBS-D重要治则。《难经·六十六难》云:“三焦者,原气之别使也,主通行三气。”[9]中医古籍认为三焦在一身气机运行中占有重要地位,是一身气机的通道,因而,通过调畅三焦可调控全身脏腑气机的运行。基于此,本研究通过采用韩景献教授基于“三焦气化失司”理论提出的三焦针法调节IBS-D脾胃运化、改善脏腑气机、益气调血、扶本培元[10]。同时基于IBS-D大鼠模型,探究三焦针法对IBS-D大鼠SCF/C-kit通路的调控作用,阐述三焦针法治疗IBS-D改善胃肠动力的可能作用机制。
1 材料与方法
1.1 实验动物与分组
SPF级健康wistar雄性大鼠24只,体质量(300±50)g,购自:长沙市天勤生物技术有限公司[生产许可证号:SCXK(湘)2019-0013]。饲养于贵州中医药大学中心动物实验室,饲养温度(20±2)℃,湿度(60±5),光明/黑暗周期为12小时,定期更换垫料,保持环境干燥通风,自由饮水和摄食。大鼠适应性喂养7天,按随机数字表抽取6只大鼠为空白组,其余18只大鼠为模型组进行造模。造模完成后,根据随机数字表分为模型组、西药组和三焦组,每组6只。所有动物实验过程均通过贵州中医药大学实验伦理审查(论理审批号:20220068),同时符合国家实验动物福利指南。
1.2 主要试剂与仪器
冰醋酸(20220402,成都金山化学试剂有限公司),匹维溴安片(法国苏威公司,进口药品注册证号:H20160396),苏木素—伊红(hemotoxylin-eosin,HE)染色试剂(武汉赛维尔生物科技有限公司),PCR引物(生工生物工程(上海)股份有限公司),Trizol试剂(合肥博美生物技术有限公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),兔抗大鼠SCF、C-kit抗体(abclonal)。
针刺针(0.25 mm×0.25 mm,苏州医疗用品厂有限公司),旷场实验箱(XR-XZ301,上海欣软信息科技有限公司),电子天平(PPT-A+100,美国康州HZ电子科技有限公司),数字切片扫描仪[Pannoramic250,3DHISTECH(Hungary)],酶标仪(型号:SpectraMAX Plus384,美谷分子仪器有限公司),实时荧光定量(RT-PCR)仪(型号:QuantStudio TM3,美国Thermofisher仪器有限公司),电泳仪JY200C(北京君意东方电泳设备有限公司),水平脱色摇床TY-80A(江苏科析仪器有限公司),化学发光凝胶成像仪5200(上海天能科技有限公司)。
1.3 造模方法
IBS-D模型动物制备参照章海凤等[11]的方法,采用冰醋酸+束缚应激方式进行造模:4%的冰醋酸溶液按0.2 mL进行灌肠,每隔两日增加0.1 mL,直至剂量为0.5 mL。灌肠后,进行束缚刺激,1次/d,每次2小时,持续给药14天。以大鼠出现静卧少动、肛周污秽等一般症状及体质量较空白组降低,旷场实验中横向运动、纵向距离较空白组减少、稀便率和AWR3分时注水量增加为造模成功标准[11]。
1.4 干预方法
空白组、模型组:予固定但不进行其余干预。
西药组:进行匹维溴铵灌胃,浓度为1.5 mg/mL的匹维溴铵混悬液按大鼠体质量以15 mg/kg的剂量给药,1次/d,连续治疗14天。
三焦组:参照文献[12]进行三焦针法干预:将大鼠固定,选取“膻中”“中脘”“气海”及双侧“血海”“足三里”(穴位定位参照《实验动物常用穴位名称与定位第2部分:大鼠》[13]进行定位),“血海”向上平刺2~5 mm,行捻转补法(>120次/min)30秒,其他穴位均直刺2~3 mm,行捻转补法30秒,1次/d,连续治疗14天。
1.5 观察指标及检测方法
1.5.1 一般状态 每日观察大鼠的食量、饮水、精神状态、皮毛色泽、活动度、粪便、肛周污秽程度及有无其它异常症状等情况,同时记录大鼠体质量。
1.5.2 旷场实验 分别于造模前、造模后及干预后进行。实验开始前将大鼠放置于实验环境中适应30分钟后开始实验。每次将一只大鼠放置于50 cm×50 cm×50 cm的旷场实验箱中心位置,利用摄像机记录大鼠5分钟内行为,运用ANY-MAZE软件分析大鼠横向运动(行走距离)、纵向运动(直立次数)及粪便粒数。每只大鼠实验后,用75%乙醇溶液擦拭旷场实验箱,避免大鼠残留气味影响实验结果。
1.5.3 稀便率 参照文献[13]进行干预,在造模后、治疗后,将每组大鼠分开放置于铁笼中,将垫有滤纸的托盘放置于铁笼下方,4小时后统计各组大鼠总排便粒数和稀便数,计算 稀便率。稀便率(%)=(稀便数÷总排便粒数)×100%。
1.5.4 AWR评分 参照文献[13]进行干预,分别于造模后、治疗后采用结直肠扩张(colorectal dilatation,CRD)法对各组大鼠进行AWR评分,以评估大鼠内脏敏感性。测定前12小时大鼠禁食不禁水。大鼠吸入七氟烷轻度麻醉后,将甘油润滑的6F导尿管缓慢插入肛门7 cm后用胶带将导尿管固定于大鼠尾根部,将大鼠置于单笼中,待大鼠苏醒且状态稳定时经球囊注入(27±1)℃的0.9%氯化钠溶液,观察引起大鼠AWR达3分时的注水量,重复检测3次,取3次平均值作为大鼠引起 AWR 达3分时最小容量阈值,AWR评分标准见表1。

表1 AWR评分标准
1.5.5 HE染色法观察大鼠结肠组织 干预结束后第二天,将大鼠麻醉,迅速分离结肠,使用4%的多聚甲醛进行固定,将固定后组织经乙醇梯度脱水,二甲苯透明,包埋,石蜡切片(5 μm);采用HE染色,切片脱蜡至水,苏木精染色,盐酸乙醇分化,流水冲洗,中性树胶封固,使用Pannoramic 250数字切片扫描仪(3DHISTECH)进行图片观察并采集。
1.5.6 RT-PCR法检测大鼠结肠组织中SCF、C-kit mRNA表达 将上述各组大鼠结肠组织用Trizol试剂提取总RNA,RT反应后逆转录为cDNA,将cDNA进行实时荧光定量PCR反应。PCR反应:95℃30秒,95℃5秒,55℃30秒,72℃30秒,共45个循环,得到检测样本相应CT值,通过2-ΔΔCT计算样本mRNA表达量。引物序列详见表2。

表2 引物序列
1.5.7 Western blot法检测大鼠结肠组织中SCF、C-kit蛋白表达 提取结肠组织蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度,具体操作根据试剂盒说明书进行。后进行蛋白变性、电泳、转膜、封闭、一抗孵育(C-kit 1∶2000;SCF 1∶1000;β-actin 1∶50000)、二抗孵育(1∶5000稀释)。使用ECL发光液按1∶1混合后,滴加到PVDF膜上反应1分钟,将膜置于化学发光凝胶成像仪暗室中,使用天能GIS机箱控制软件V2.0进行曝光扫描,用Image J软件进行分析,结果以目的蛋白相对表达量表示。
1.6 统计学处理

2 结果
2.1 大鼠一般状态比较
造模后,空白组大鼠毛色光滑,抓取时动作敏捷,精神充足,肛周干净,粪便呈颗粒状。其余三组大鼠毛色暗淡,精神萎靡,反应迟钝,肛周污迹且伴粪便稀薄。干预后,西药组和三焦组大鼠精神状态,毛色、活动、肛周污迹及粪便性状得到改善。
2.2 各组大鼠体质量比较
造模前,各组大鼠体质量无明显差异;造模后,与空白组比较,各组大鼠体质量降低(P<0.01);干预后,与模型组比较,西药组、三焦组体质量显著升高(P<0.05,P<0.01),且西药组与三焦组比较无统计学意义(P>0.05)。见表3。
表3 各组大鼠体质量比较
2.3 各组大鼠旷场实验比较
造模前,各组大鼠无差异;造模后,与空白组比较各组大鼠横向运动距离及纵向运动次数均显著减少(P<0.01)。干预后,与模型组比较,西药组及三焦组大鼠横向运动距离及纵向运动次数均显著增加(P<0.01),且西药组与三焦组比较无统计学意义(P>0.05)。见表4。

表4 各组大鼠横向运动与纵向运动结果比较
2.4 各组大鼠稀便率情况
造模后,与空白组比较各组大鼠稀便率显著增加(P<0.01)。干预后,与模型组比较,西药组及三焦组大鼠稀便率均显著降低(P<0.01),且西药组与三焦组比较无统计学意义(P>0.05)。见表5。

表5 各组大鼠稀便率情况比较
2.5 各组大鼠AWR3分时注水量情况
造模后,与空白组比较各组大鼠AWR3分时注水量显著降低(P<0.01)。干预后,与模型组比较,西药组及三焦组大鼠AWR3分时注水量均显著增加(P<0.01),且西药组与三焦组比较无统计学意义(P>0.05)。见表6。

表6 各组大鼠AWR3分时注水量情况比较
2.6 各组大鼠结肠病理情况
模型组大鼠结肠固有层有少量炎症细胞浸润,以淋巴细胞为主;其余大鼠结肠粘膜结构清晰完整,分层明显,上皮细胞排列整齐,固有层腺体排列较规则,固有层和粘膜下有不同程度的中性粒细胞或淋巴细胞聚集,无明显病理变化。见图1。
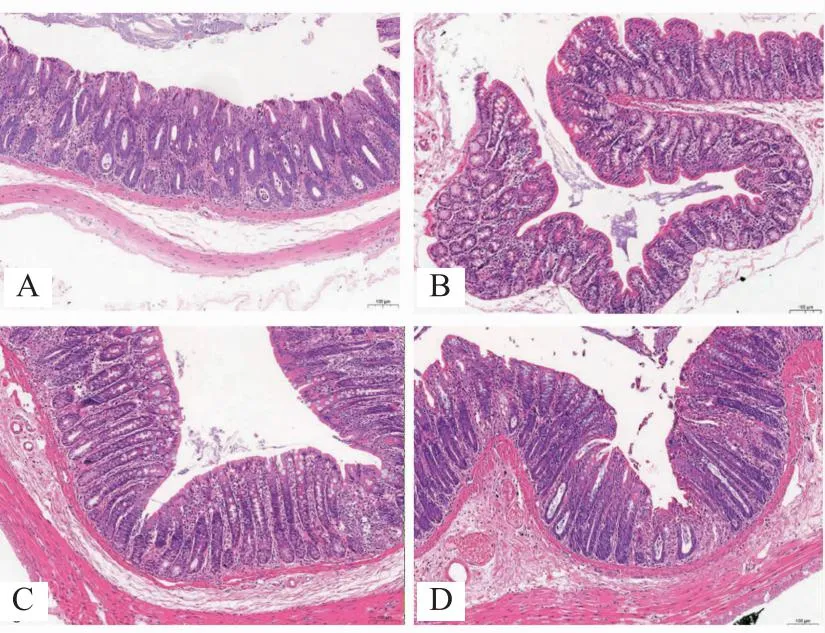
注:A 空白组;B 模型组;C 西药组;D 三焦组。
2.7 各组大鼠结肠组织中SCF、C-kit mRNA表达水平比较
与空白组相比,IBS-D模型组大鼠结肠组织SCF、C-kit mRNA表达均显著升高(P<0.01)。与模型组相比,三焦组大鼠结肠组织中SCF mRNA、C-kit mRNA表达均显著降低(P<0.01),西药组大鼠结肠组织中SCF mRNA、C-kit mRNA表达无统计学意义(P>0.05)。见表7。

表7 各组大鼠SCF、C-kit mRNA表达水平比较
2.8 各组大鼠结肠组织中SCF、C-kit蛋白表达水平比较
与空白组相比,模型组大鼠结肠组织中SCF、C-kit蛋白表达水平均显著升高(P<0.01)。与模型组相比,三焦组大鼠结肠组织中SCF、C-kit蛋白表达水平显著降低(P<0.05),西药组结肠组织SCF、C-kit蛋白表达水平比较无统计学意义(P>0.05)。见图2、表8。
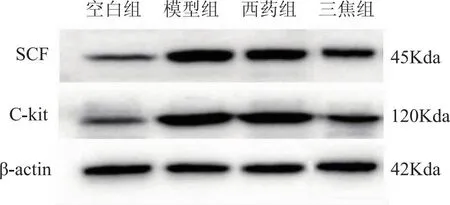
图2 各组大鼠SCF、C-kit蛋白表达水平的影响

表8 各组大鼠SCF、C-kit蛋白表达水平比较
3 讨论
IBS-D是一种功能性胃肠道疾病,其发病机制尚未明确。大量研究显示,胃肠运动功能紊乱是导致IBS-D发病的一大重要病理机制。目前临床多采用对症治疗,但存在一定不良反应且复发率高等副作用[14],因而探索其替代疗法、潜在机制及治疗靶点尤为重要。
本实验采用“冰醋酸灌肠+束缚应激”建立IBS-D模型,针对大鼠体质量、横向运动、纵向运动、稀便率及AWR3分时阈值进行观察检测。结果显示,与空白组相比,IBS-D模型大鼠体质量明显下降,横向运动和纵向运动次数明显减少,稀便率明显增加,AWR3分时注水量明显降低,提示模型复制成功。经针刺干预后,三焦组大鼠体质量、横向运动、纵向运动次数明显升高,稀便率明显减少,AWR3分时注水量明显增高,提示三焦针法具有改善IBS-D大鼠腹痛、腹泻症状作用。
匹维溴铵作为临床常用治疗IBS-D的解痉药,主要用于改善由胃肠道功能紊乱导致的排便异常、疼痛等症状,可缓解肠道痉挛,改善胃肠道功能,故本实验选其为阳性对照药物[15]。本研究显示,匹维溴铵干预后,SCF、C-kit基因及蛋白表达具有下调趋势,但无统计学意义,提示匹维溴铵能够在一定程度上缓解IBS-D症状,改善胃肠道紊乱情况,这可能与匹维溴铵作为肠道解痉药,通过抑制Ca2+离子通道,降低肠道平滑肌兴奋性,缓解痉挛[15]的作用机制有关。
中医学根据临床特征将IBS-D归属于“腹痛”、“泄泻”等范畴。《景岳全书·泄泻》曰:“泄泻之本,无不由于脾胃”。《诸病源候论》认为“脾胃虚弱则运化不利,水谷不化,致脾胃升降失司,清浊不分则生泄泻”[16]。因而通过调节脾胃功能,促使脾胃气机调畅达到腐熟水谷、宣统气血津液可治疗IBS-D。研究发现,韩景献教授根据“三焦气化失司”理论提出的三焦针法可通调三焦、助力中焦脾胃运化,以达到“中焦如沤”的状态[10]。因而本研究以三焦针法作为干预措施,其方所选穴位包括膻中、中脘、气海、血海(双侧)及足三里(双侧)。膻中为心包募穴,位属上焦,刺激膻中可宣通上焦心肺之气,达到“上焦如雾”的状态;中脘属任脉,为胃之募穴,脾胃表里,二者合用,可改善脾胃功能,促进中焦气机运化。气海为肾之原穴,可生发元气,为人体提供动力。足三里为胃经合穴,胃下合穴,针刺足三里可促进后天脾胃之气,调节气血生化。血海属足太阴脾经,为血液汇聚之处,血为气之母,刺激该穴可促进气血输布[10, 17]。五穴合用,可调畅三焦气机、改善中焦脾胃运化功能、滋养脏腑、促进脾胃气血生化功能的发挥、固本培元,以改善IBS-D的病情。
ICC被称为肠道平滑肌起搏细胞,研究显示,ICC通过产生慢波电位控制肠道平滑肌收缩频次、方向及节点,介导肠道平滑肌收缩,调控肠道神经元释放相关神经递质及胃肠激素[7, 18]。ICC的结果和数量异常会直接影响胃肠道运动从而导致出现胃肠动力异常性疾病。C-kit受体是一种具有酪氨酸激酶活性的跨膜蛋白,在ICC细胞膜上特异性表达,因而可间接作为ICC细胞特异性标记物,调控ICC的生理过程与表达。同时,SCF作为一种高度糖化的跨膜蛋白,是C-kit的配体,两者特异性结合在维持ICC的数量、活化及功能的发挥方面具有关键作用[19-21]。本研究通过检测SCF、C-kit基因及蛋白水平表达,发现IBS-D模型大鼠SCF、C-kit基因和蛋白水平均显著升高。针刺干预后,SCF、C-kit基因及蛋白水平显著降低,提示三焦针法可显著调控SCF/C-kit通路改善IBS-D胃肠道动力障碍,这可能与SCF、C-kit基因及蛋白下调,SCF/C-kit通路受到抑制,肠道平滑肌细胞兴奋性下降有关。
综上所述,本研究初步证明三焦针法可通过调节SCF、C-kit基因和蛋白表达,改善IBS-D胃肠动力异常,缓解IBS-D症状。但本研究也存在一些不足之处,针刺对SCF/C-kit的影响是多方面的,接下来研究当中会加入阻断剂阻断SCF/C-kit通路传导,进一步证实三焦针法对SCF/C-kit的影响。

