慢性阻塞性肺疾病患者睡眠质量和焦虑抑郁情况及其影响因素:一项多中心横断面研究
李兴洋 孙婉琪 尹孟洁 窦婷婷 吕逸丽 徐伟 查震球

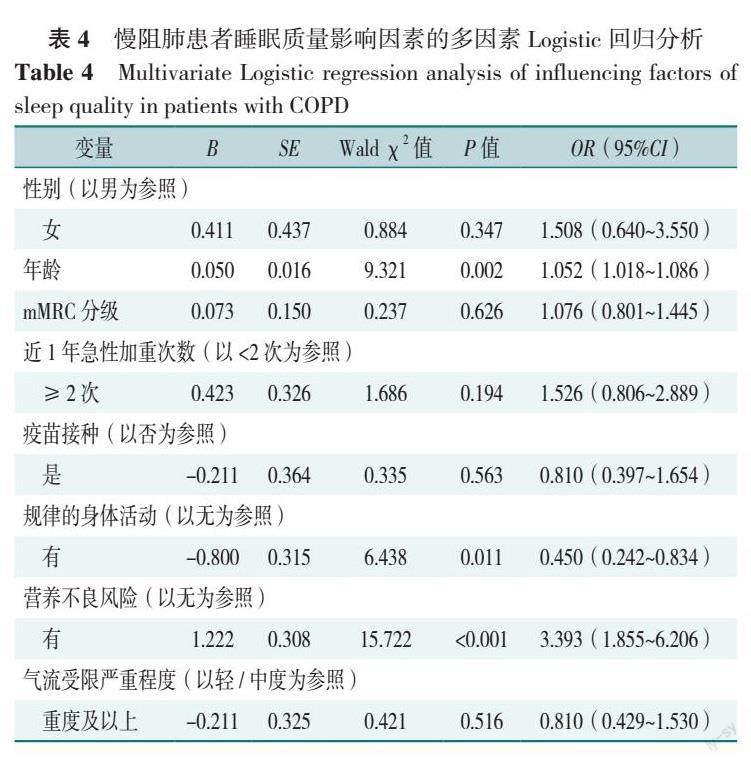

【摘要】 背景 慢性阻塞性肺疾病(以下簡称慢阻肺)易使患者睡眠质量下降,并产生焦虑抑郁症状,但常被医护人员和患者自身忽视。了解慢阻肺患者睡眠质量和焦虑抑郁情况及其影响因素,有助于提高患者的生活质量,但相关多中心研究尚少。目的 调查慢阻肺患者的睡眠质量和焦虑、抑郁情况,并探究其影响因素。方法 采用方便抽样,对2022年8—11月在安徽省7家医院呼吸与危重症医学科就诊的慢阻肺患者进行招募,收集患者的人口学特征、呼吸困难等级、气流受限严重程度、营养不良风险、身体活动水平、疫苗接种和近1年急性加重情况。分别采用匹兹堡睡眠质量指数(PSQI)和医院焦虑抑郁量表(HADS)评估慢阻肺患者的睡眠质量和焦虑抑郁症状,并采用多因素Logistic回归分析其影响因素。结果 共调查慢阻肺患者248例,其中睡眠质量差的发生率为60.9%(151/248),仅8.9%(22/248)的患者认为自己有很好的睡眠质量,一半以上的患者实际睡眠时间不足(54.4%)或睡眠效率低(60.1%);29.4%(73/248)的慢阻肺患者至少存在焦虑或抑郁其中一种症状,其中35例存在焦虑症状,61例存在抑郁症状,23例同时存在焦虑和抑郁两种症状。多因素Logistic回归分析结果显示,年龄大(OR=1.052,95%CI=1.018~1.086)、有营养不良风险(OR=3.393,95%CI=1.855~6.206)是慢阻肺患者睡眠质量差的危险因素,有规律的身体活动是慢阻肺患者睡眠质量差的保护因素(OR=0.450,95%CI=0.242~0.834)(P<0.05)。近1年急性加重次数≥2次(OR=2.220,95%CI=1.093~4.510)、有营养不良风险(OR=1.961,95%CI=1.044~3.683)是慢阻肺患者发生焦虑抑郁症状的危险因素(P<0.04)。慢阻肺患者PSQI评分与焦虑症状得分(HADS-A)(rs=0.413)、抑郁症状得分(HADS-D)(rs=0.430)存在正相关关系,HADS-A评分和HADS-D评分存在正相关关系(rs=0.719,P<0.05)。结论 慢阻肺患者中睡眠质量差和焦虑抑郁症状的发生率较高,年龄、营养不良风险、规律的身体活动和近1年急性加重次数是重要的影响因素。医护人员、家属和患者自身应提高对睡眠质量和焦虑抑郁的认识,对重点患者积极开展筛查和干预工作,以改善患者的睡眠质量和心理健康。
【关键词】 慢性阻塞性肺疾病;睡眠质量;焦虑;抑郁;影响因素分析;多中心研究
【中图分类号】 R 563.9 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2023.0794
Sleep Quality and Anxiety and Depression in Patients with Chronic Obstructive Pulmonary Disease and Their Influencing Factors:a Multicenter Cross-sectional Study
LI Xingyang1,SUN Wanqi1,YIN Mengjie2,DOU Tingting3,LYU Yili3,XU Wei3,ZHA Zhenqiu1,3*
1.Department of Epidemiology and Health Statistics,School of Public Health,Anhui Medical University,Hefei 230032,China
2.Department of Rheumatology,the First Affiliated Hospital of Anhui University of Chinese Medicine,Hefei 230031,China
3.Anhui Provincial Center for Disease Control and Prevention/Public Health Research Institute of Anhui Province,Heifei 230601,China
*Corresponding author:ZHA Zhenqiu,Associate chief physician;E-mail:zhenqiuzha@126.com
【Abstract】 Background Respiratory problems in chronic obstructive pulmonary disease(COPD)patients are prone to poor sleep quality,anxiety and depression,but they are often ignored by medical staff and patients themselves. Understanding the sleep quality,anxiety and depression symptoms of patients with COPD and their influencing factors can help to improve the quality of life of patients,however,there are few relevant studies. Objective To investigate the sleep quality,anxiety and depression of patients with COPD and explore the influencing factors. Methods Convenience sampling was used to recruit COPD patients who visited the Department Respiratory Diseases and Critical Care Medicine of seven hospitals in Anhui Province from August to November 2022. Demographic characteristics,dyspnea grade,airflow restriction severity,risk of malnutrition,physical activity level,vaccination,and acute exacerbations in the last 1 year were collected. The Pittsburgh Sleep Quality Index(PSQI)and the Hospital Anxiety and Depression Scale(HADS)were used to evaluate the sleep quality and anxiety and depression symptoms of COPD patients,and the influencing factors were analyzed by multivariate Logistic regression. Results A total of 248 patients with COPD were investigated,among which the incidence of poor sleep quality was 60.9%(151/248),only 8.9%(22/248)of the patients thought they had good sleep quality,and more than half of the patients actually had insufficient sleep time(54.4%) or low sleep efficiency(60.1%). 29.4%(73/248)of COPD patients had at least one of the symptoms of anxiety or depression,of which 35 had anxiety symptoms,61 had depression symptoms,and 23 had both anxiety and depression symptoms. Multivariate Logistic regression analysis showed that older ages(OR=1.052,95%CI=1.018-1.086)and risk of malnutrition(OR=3.393,95%CI=1.855-6.206)were risk factors for poor sleep quality in COPD patients. Regular physical activity was a protective factor for poor sleep quality in COPD patients(OR=0.450,95%CI=0.242-0.834)(P<0.05). Acute exacerbations ≥2 times(OR=2.220,95%CI=1.093-4.510)and malnutrition risk(OR=1.961,95%CI=1.044-3.683)were risk factors for anxiety and depression symptoms in COPD patients(P<0.04). In COPD patients,PSQI score was positively correlated with HADS-A(rs=0.413)and HADS-D score(rs=0.430),and there was a positive correlation between HADS-A score and HADS-D score(rs=0.719,P<0.05). Conclusion The incidence of poor sleep quality,anxiety and depression symptoms was high in COPD patients,and age,malnutrition risk,regular physical activity and number of acute exacerbations in the past year are important influencing factors. Medical staff,family members and patients themselves should improve the awareness of sleep quality,anxiety and depression,and actively carry out screening and intervention work for key patients to improve the sleep quality and mental health of patients.
【Key words】 Chronic obstructive pulmonary diseases;Sleep quality;Anxiety;Depression;Root cause analysis;Multicenter study
慢性阻塞性肺疾病(以下简称慢阻肺)是一种由气道异常和/或肺泡异常导致的持续性气流阻塞的异质性肺部疾病,有较高的发病率和死亡率[1]。2019年全球30~79岁人群的慢阻肺患病率为10.3%[2],2014—2015年中国慢阻肺监测结果显示我国40岁及以上人群慢阻肺的患病率为13.6%[3],慢阻肺已成为影响我国居民健康的重要公共卫生问题。
慢阻肺患者常表现为呼吸困难、咳嗽、咳痰等慢性呼吸道症状,长期的呼吸问题使慢阻肺患者的睡眠质量下降,并导致焦虑和抑郁症状增加[4]。多项研究显示40%以上的慢阻肺患者存在自我报告的睡眠障碍[5-6],10%~46%的慢阻肺患者会出现焦虑或抑郁症状[7-8]。尽管睡眠障碍和焦虑抑郁在慢阻肺患者中普遍存在,但由于多数症状不明显,容易被慢阻肺的症状所掩盖而常被医护人员和患者自身所忽视[1,9]。研究者们对慢阻肺患者睡眠质量和焦虑抑郁的相关影响因素也很少报道。因此,本研究采用匹兹堡睡眠质量指数(PSQI)和医院焦虑抑郁量表(HADS)评估慢阻肺患者的睡眠质量和焦虑抑郁情况,并对其影响因素进行研究,为制订相应的防治策略提供依据,以提高睡眠质量和心理健康水平,改善慢阻肺患者的生活质量。
1 对象与方法
1.1 研究对象
采用方便抽样法,招募2022年8—11月在安徽省7家医院呼吸与危重症医学科就诊的慢阻肺患者。纳入标准:符合《慢性阻塞性肺病诊断、治疗与预防全球策略(2023年版)》(简称GOLD 2023)诊断标准,肺功能支气管扩张后FEV1/FVC<70%,同时经医生诊断排除支气管哮喘、充血性心力衰竭、支气管扩张、结核等其他疾病。排除标准:严重幻听幻视、精神分裂、痴呆、理解能力障碍或听障人士等不能完成问卷调查,高位截瘫以及新近发现或正在治疗的肿瘤患者。所有纳入患者签署知情同意书,自愿加入研究项目。本研究已通过安徽省疾病预防控制中心医学伦理委员会审查(编号:2020-1201)。
1.2 方法
1.2.1 睡眠质量评估:采用PSQI评估慢阻肺患者近1个月的睡眠质量。该问卷包含19个条目,分7个领域计算得分,分别为睡眠质量、入睡时间、睡眠时间、睡眠效率、睡眠障碍、催眠药物和日间功能障碍。每个领域得分为0~3分,PSQI总分为0~21分,总分越高表明睡眠质量越差,>5分定义为睡眠质量差[10]。
1.2.2 焦虑和抑郁症状评估:采用HADS判断慢阻肺患者的焦虑和抑郁情况[11]。该量表由14个问题组成,7个与焦虑症状(A)有关,7个与抑郁症状(D)有关,每个项目0~3分。分别计算焦虑症状得分(HADS-A)和抑郁症状得分(HADS-D),得分越高的患者焦虑或抑郁程度越高,≥8分即认为存在焦虑或抑郁症状。
1.2.3 相关变量:(1)营养不良风险:采用微营养评估-短卷(MNA-SF)评价慢阻肺患者的营养不良风险,量表包含6个题目,涉及BMI、活动能力、近3个月心理压力或急性疾病、精神心理问题、食物摄入量减少和近3个月体质量减轻情况。最高得分为14分,>12分表明存在营养不良风险[12]。(2)规律的身体活动:根据WHO关于身体活动和久坐行为的指南[13],将每周≥150 min的中等强度身体活动、≥75 min的剧烈强度身体活动或者等量的中等强度和剧烈强度组合活动定义为规律的身体活动[14]。(3)慢阻肺患者气流受限严重程度参考GOLD 2023进行分级[15],轻度:FEV1≥FEV1预计值的80%;中度:FEV1预计值的50%≤FEV1 1.3 统计学方法 本研究使用SPSS 23.0软件进行统计分析。计数资料以相对数表示,组间比较采用χ2检验;符合正态分布的连续变量采用(x-±s)表示,组间比较采用成组t检验。采用多因素Logistic回归分析慢阻肺患者睡眠质量及焦虑抑郁的影响因素。采用Spearman秩相关系数分析慢阻肺患者睡眠质量、焦虑及抑郁之间的相关性。双侧检验水准α=0.05。 2 结果 2.1 一般情况 本研究共纳入慢阻肺患者248例,平均年龄(71.3±10.0)歲,其中男性占84.3%(209/248),女性占15.7%(39/248)。62.9%(156/248)的患者在近1年发生了2次及以上的急性加重事件,74.2%(184/248)的患者接种过疫苗,55.2%(137/248)的患者缺少规律的身体活动,52.4%(130/248)的患者存在营养不良的风险。慢阻肺患者气流受限严重程度轻度、中度、重度和极重度比例分别为16.5%(41/248)、41.9%(104/248)、30.2%(75/248)和11.3%(28/248)。 2.2 慢阻肺患者的睡眠质量情况 248例慢阻肺患者中,60.9%(151/248)的患者睡眠质量差。PSQI问卷调查结果显示,仅8.9%(22/248)的患者认为自己有很好的睡眠质量,49.6%(123/248)的患者在躺下后30 min内无法入睡,54.4%(135/248)的患者实际睡眠时间<7 h,60.1%(149/248)的患者睡眠效率(实际睡眠时间/床上时间×100%)<85%,70.2%(174/248)的患者出现日间困倦或做事精力不足的情况,13.7%(34/248)的患者在近1个月使用过镇静催眠药物。 睡眠质量好与睡眠质量差的患者性别、气流受限严重程度比较,差异无统计学意义(P>0.05);睡眠质量差的患者年龄大于睡眠质量好的患者,mMRC分级及近1年急性加重次数≥2次、没有接种疫苗、无规律的身体活动、存在营养不良风险的比例高于睡眠质量好的患者,差异有统计学意义(P<0.05),见表1。 2.3 慢阻肺患者的焦虑和抑郁情况 29.4%(73/248)的慢阻肺患者至少存在焦虑或抑郁其中一种症状,其中35例存在焦虑症状,61例存在抑郁症状,23例同时存在焦虑和抑郁两种症状。 有焦虑症状和无焦虑症状的患者性别、年龄、mMRC分级、近1年急性加重次数、疫苗接种情况比较,差异无统计学意义(P>0.05);有焦虑症状的患者无规律的身体活动、存在营养不良风险、气流受限严重程度重度及以上的比例高于无焦虑症状的患者,差异有统计学意义(P<0.05),见表2。 有抑郁症状和无抑郁症状的患者性别比较,差异无统计学意义(P>0.05);有抑郁症状的患者年龄大于无抑郁症状的患者,mMRC分级及近1年急性加重次数≥2次、没有接种疫苗、无规律的身体活动、存在营养不良风险、气流受限严重程度重度及以上的比例高于无抑郁症状的患者,差异有统计学意义(P<0.05),见表3。 2.4 慢阻肺患者睡眠质量影响因素的多因素Logistic回归分析 以慢阻肺患者睡眠质量为因变量(赋值:睡眠质量好=0,睡眠质量差=1),以性别、年龄、mMRC分级、近1年急性加重次数、疫苗接种、规律的身体活动、营养不良风险、气流受限严重程度为自变量,进行多因素Logistic回归分析,结果显示,年龄大(OR=1.052,95%CI=1.018~1.086)、存在营养不良风险(OR=3.393,95%CI=1.855~6.206)是慢阻肺患者睡眠质量差的危险因素,有规律的身体活动是慢阻肺患者睡眠质量差的保护因素(OR=0.450,95%CI=0.242~0.834)(P<0.05),见表4。 2.5 慢阻肺患者焦虑抑郁症状影响因素的多因素Logistic回归分析 以慢阻肺患者是否存在焦虑抑郁症状为因变量(赋值:无症状=0,至少存在焦虑或抑郁其中一种症状=1)以性别、年龄、mMRC分级、近1年急性加重次数、疫苗接种、规律的身体活动、营养不良风险、气流受限严重程度为自变量,进行Logistic回归分析,单因素分析结果显示:mMRC分级、近1年急性加重次数、规律的身体活动、营养不良風险和气流受限严重程度是慢阻肺患者发生焦虑抑郁症状的影响因素(P<0.05)。多因素分析结果显示:近1年急性加重次数≥2次(OR=2.220,95%CI=1.093~4.510)、存在营养不良风险(OR=1.961,95%CI=1.044~3.683)是慢阻肺患者发生焦虑抑郁症状的危险因素(P<0.04),见表5。 2.6 慢阻肺患者睡眠质量、焦虑和抑郁的相关性分析 慢阻肺患者PSQI评分与HADS-A、HADS-D评分存在正相关关系,HADS-A评分和HADS-D评分存在正相关关系(P<0.05),见表6。 3 讨论 睡眠障碍和焦虑抑郁是慢阻肺患者常见的并发症,是影响患者生活质量以及慢阻肺发展和预后的重要因素。既往研究发现睡眠质量差、合并焦虑或抑郁与更差的治疗依从性、更高的急性加重和死亡风险相关[6,11,16]。因此,评估慢阻肺患者的睡眠质量和焦虑抑郁情况,探讨相关影响因素可以为相关临床工作和疾病管理提供参考,最终改善慢阻肺患者的预后和生活质量。 3.1 慢阻肺患者的睡眠质量和焦虑抑郁情况 本研究是一项多中心的横断面调查,结果显示参与者中睡眠质量差的慢阻肺患者占比达到了60.9%,高于美国(54.0%)[6]和希腊(32.6%)[17]的研究结果,可能原因是本研究慢阻肺患者的平均年龄超过了70岁,高于这两项研究参与者的平均年龄。此外,国内近期的一项研究,同样采用PSQI对慢阻肺患者的睡眠质量进行了调查,结果显示睡眠质量差的发生率为49.4%[10]。本研究结果与之相近,均提示了慢阻肺患者睡眠质量差的发生率较高,并且高于国内一些研究者对社区中老年人群睡眠质量的调查结果(29.1%~40.0%)[18-20]。出现这一结果的生物学机制可能是:由于慢阻肺患者存在呼吸动力下降、呼吸肌张力降低、气道阻力增加、功能残气量增加、低氧血症和/或高碳酸血症等病理生理变化,导致其难以开始或维持睡眠,经历快速眼动睡眠时间缩短,轻度睡眠增加,频繁觉醒或睡眠碎片化,睡眠质量逐渐下降[21-22]。这也解释了研究的另一结果,49.6%的慢阻肺患者无法在30 min内入睡,一半以上的患者实际睡眠时间不足且睡眠效率低。 呼吸困难、喘息、咳痰、胸闷等呼吸道症状会使慢阻肺患者身体功能降低,社交活动减少,进而易产生不良情绪。 本研究结果显示,29.4%的慢阻肺患者至少存在焦虑或抑郁其中一种症状,且焦虑症状的发生率低于抑郁症状的发生率,与WU等[7]的研究报道相近,该研究慢阻肺患者抑郁症状的发生率也高于焦虑症状,分别为22.5%和13.9%。丹麦的一项调查显示,慢阻肺患者焦虑和抑郁两种症状的发生率均超过了70%,远高于本研究的结果,造成这种差异的原因可能是该研究的参与者均是重度以上的慢阻肺患者,而本研究大部分参与者是轻/中度的患者[23]。 3.2 慢阻肺患者睡眠质量的影响因素 本研究多因素Logistic分析结果显示,慢阻肺患者的年龄越大,睡眠质量越差,与之前的两项研究结果一致[17,21],可能与睡眠模式的改变和身体衰老有关,然而衰老过程伴随着众多生理或心理的复杂变化,这可能也是少数研究没有发现慢阻肺患者睡眠质量和年龄具有关联的原因[24]。 HIRATA等[25]研究结果显示,不运动的慢阻肺患者比运动的患者睡眠更碎片化,更难以维持,睡眠质量更差,本研究的结果与之一致,达到WHO推荐的身体活动水平的慢阻肺患者睡眠质量更好,其可能的机制是:身体活动可以提高体温,使人更容易入睡;且在身体活动期间,能量消耗的增加,会使非快速眼动睡眠阶段延长,深度睡眠增加[26]。因此,对于睡眠质量差的慢阻肺患者应实施合适的运动干预以改善睡眠质量。有研究认为慢阻肺患者可以选择普拉提、步行、肌肉耐力训练、太极和瑜伽等运动训练改善自身的睡眠质量,这些运动中肌肉耐力训练联合步行可能是提高睡眠质量的最佳方案[27]。 既往研究显示,30%~60%的慢阻肺患者存在营养不良[28],而本研究采用MNA-SF评估了慢阻肺患者的营养不良风险,发现存在营养不良风险的患者睡眠质量更差。一项对社区老年人的调查结果在一定程度上支持了本研究结果,该调查显示良好的营养状态与较少的日间功能障碍、充足的睡眠时间和良好的主观睡眠质量显著相关[29]。营养影响睡眠的机制是复杂的,长期营养不足可能导致炎症,而炎症与失眠密切相关;水果、蔬菜和全谷物的充足摄入对睡眠也有积极作用[26]。蛋白质摄入过少或过多同样会影响睡眠质量,导致入睡困难,这可能与色氨酸含量变化有关,色氨酸是大脑血清素的前体,具有安眠的作用[30]。因此,在临床工作中,应及时评估慢阻肺患者的营养状态,保证蛋白质、维生素等营养素的摄入可能有助于改善睡眠质量。 3.3 慢阻肺患者焦虑抑郁症状的影响因素 一项队列研究显示,确诊慢阻肺的患者发生抑郁的可能性比非慢阻肺患者高42%,而且呼吸困难更严重的患者患抑郁的风险更大[31],本研究的单因素Logistic分析结果也支持这一发现,mMRC分级高、严重程度重度以上的患者焦虑抑郁症状的发生率更高。多因素Logistic回归分析结果显示,近1年急性加重次数≥2次的慢阻肺患者更易出现焦虑抑郁症状,与LONG等[32]的研究结果一致。频繁的急性加重,常伴有呼吸困难加重、住院和药物治疗增多以及经济负担加重等,容易使慢阻肺患者产生负面情绪;而不良的情绪会增强患者的主观感受,放大对呼吸困难、喘息、活动能力下降等症状的感知,又会进一步加重焦虑抑郁症状[33]。建议对于每年频繁急性加重的患者,医护人员应积极开展焦虑抑郁筛查并实施心理干预;患者家属也应掌握一定的心理健康知识,关注患者情绪变化,给予充分的关心和爱护以减少不良情绪的产生。 本研究也发现了营养不良风险与焦虑抑郁症状的关联,国内的一项研究支持了这种关联,营养不良风险是慢阻肺患者焦虑抑郁的重要影响因素[34]。CHOI等[35]的研究也显示体质量过轻是慢阻肺患者抑郁的危险因素。一项随机对照试验初步验证了营养补充对焦虑抑郁的作用,其结果显示慢阻肺患者经过1年的营养补充剂(富含亮氨酸、维生素D和多不饱和脂肪酸)干预后,HADS评分显著下降,而安慰剂组并没有变化[36]。营养对心理健康的影响机制尚不完全清楚,饮食不仅影响大脑组成、结构和功能,还影响内源性激素、神经肽、神经递质和“微生物-肠-脑轴”;在调节应激和炎症以及保持认知功能方面也发挥关键作用[37]。因此,坚持健康饮食,保证营养均衡也是慢阻肺患者维持心理健康所必需的。 3.4 慢阻肺患者睡眠质量、焦虑和抑郁的相关性 相关性分析结果显示,慢阻肺患者PSQI评分、HADS焦虑和抑郁评分之间有显著的正相关性,与多项研究结果一致[17,23]。在慢阻肺患者中,睡眠质量差和焦虑抑郁症状常同时存在,相互影响。本研究结果顯示,睡眠质量和焦虑抑郁症状可能有相同的影响因素;提高睡眠质量的干预措施也能改善心理健康,例如身心运动训练以及良好的营养状况均有助于改善睡眠和焦虑抑郁症状[26,38]。 本研究存在部分局限性。一方面,调查采用的PSQI和HADS是用来反映患者近1个月情况的筛查性量表,不能作为诊断标准;另一方面,本研究是一项横断面调查,尚不能对睡眠质量、焦虑抑郁和影响因素之间的关联作因果推断。 4 小结 慢阻肺患者中睡眠质量差和焦虑抑郁症状的发生率较高,且具有相关性;一半以上的患者睡眠质量较差,近1/3的患者至少存在焦虑或抑郁其中一种症状。年龄大、存在营养不良风险以及无规律的身体活动的慢阻肺患者睡眠质量更差;近1年急性加重次数≥2次、存在营养不良风险的患者更易产生焦虑抑郁症状。医护人员、家属和慢阻肺患者自身应提高对睡眠质量和焦虑抑郁的认识,对年龄大、急性加重频繁的患者积极开展评估筛查,并将运动训练和营养干预纳入疾病管理中,以期提高患者的睡眠质量和心理健康水平,最终改善患者的预后和生活质量。 致谢:感谢安徽省中医院、安徽省胸科医院、宣城市人民医院、芜湖市第一人民医院、肥东县人民医院、宁国市中医院和繁昌区人民医院7家医院呼吸与危重症医学科的领导、专家以及调查人员对本研究的支持和帮助。 作者贡献:李兴洋负责查阅文献、统计分析、论文撰写与修改,参与现场调查和数据收集;孙婉琪和尹孟洁参与现场调查、数据搜集、问卷录入与整理;窦婷婷和吕逸丽负责调查培训和质量控制;徐伟参与研究设计,技术支持;查震球负责研究整体设计、质量控制、论文指导和审校,对文章整体负责。 本文无利益冲突。 参考文献 Global Initiative for Chronic Obstructive Lung Disease(GOLD). Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease(2023 report)[EB/OL].(2022-11-14)[2023-01-21]. https://goldcopd.org/2023-gold-reports-2/. ADELOYE D,SONG P G,ZHU Y J,et al. Global,regional,and national prevalence of,and risk factors for,chronic obstructive pulmonary disease(COPD)in 2019:a systematic review and modelling analysis[J]. Lancet Respir Med,2022,10(5):447-458. DOI:10.1016/S2213-2600(21)00511-7. FANG L W,GAO P,BAO H L,et al. Chronic obstructive pulmonary disease in China:a nationwide prevalence study[J]. Lancet Respir Med,2018,6(6):421-430. DOI:10.1016/S2213-2600(18)30103-6. MIRAVITLLES M,RIBERA A. Understanding the impact of symptoms on the burden of COPD[J]. Respir Res,2017,18(1):67. DOI:10.1186/s12931-017-0548-3. SHOROFSKY M,BOURBEAU J,KIMOFF J,et al. Impaired sleep quality in COPD is associated with exacerbations:the CanCOLD cohort study[J]. Chest,2019,156(5):852-863. DOI:10.1016/j.chest.2019.04.132. BAUGH A,BUHR R G,QUIBRERA P,et al. Risk of COPD exacerbation is increased by poor sleep quality and modified by social adversity[J]. Sleep,2022,45(8):zsac107. DOI:10.1093/sleep/zsac107. WU D,ZHAO X N,HUANG D,et al. Outcomes associated with comorbid anxiety and depression among patients with stable COPD:a patient registry study in China[J]. J Affect Disord,2022,313:77-83. DOI:10.1016/j.jad.2022.06.059. 留永健,田欣伦,郭兮恒,等. 慢性阻塞性肺疾病合并焦虑抑郁患病调查[J]. 中国呼吸与危重监护杂志,2020,19(5):425-429. DOI:10.7507/1671-6205.202001049. CHRISTENSON S A,SMITH B M,BAFADHEL M,et al. Chronic obstructive pulmonary disease[J]. Lancet,2022,399(10342):2227-2242. DOI:10.1016/s0140-6736(22)00470-6. LIN L,SONG Q,DUAN J X,et al. The impact of impaired sleep quality on symptom change and future exacerbation of chronic obstructive pulmonary disease[J]. Respir Res,2023,24(1):98. DOI:10.1186/s12931-023-02405-6. 方紫妍,李雪兒,杨雪凝,等. 疲劳对慢性阻塞性肺疾病患者急性加重影响的前瞻性队列研究[J]. 中国全科医学,2023,26(3):287-292. DOI:10.12114/j.issn.1007-9572.2022.0342. 陶国芳,高露青,邢美园,等. 稳定期慢性阻塞性肺疾病患者营养管理的证据总结[J]. 中华护理教育,2021,18(12):1084-1091. DOI:10.3761/j.issn.1672-9234.2021.12.005. World Health Organization. WHO guidelines on physical activity and sedentary behaviour[EB/OL].(2020-11-25)[2022-06-05]. https://apps.who.int/iris/bitstream/handle/10665/336656/9789240032156-chi.pdf. CHEN L,CAI M,LI H T,et al. Risk/benefit tradeoff of habitual physical activity and air pollution on chronic pulmonary obstructive disease:findings from a large prospective cohort study[J]. BMC Med,2022,20(1):70. DOI:10.1186/s12916-022-02274-8. 梁振宇,王凤燕,陈子正,等. 2023年GOLD慢性阻塞性肺疾病诊断、管理及预防全球策略更新要点解读[J]. 中国全科医学,2023,26(11):1287-1298. DOI:10.12114/j.issn.1007-9572.2023.0052. HUANG J,BIAN Y J,ZHAO Y C,et al. The Impact of Depression and Anxiety on Chronic Obstructive Pulmonary Disease Acute Exacerbations:a prospective cohort study[J]. J Affect Disord,2021,281:147-152. DOI:10.1016/j.jad.2020.12.030. ALDABAYAN Y S. Mental health and sleep quality among patients with asthma and COPD[J]. Front Med,2023,10:1181742. DOI:10.3389/fmed.2023.1181742. 李莎,趙琴,周笑楠,等. 成都市社区老年人睡眠障碍与抑郁症状的相关性研究[J]. 现代预防医学,2023,50(9):1689-1693,1705. DOI:10.20043/j.cnki.MPM.202207448. MA X Q,JIANG C Q,XU L,et al. Sleep quality and cognitive impairment in older Chinese:Guangzhou Biobank Cohort Study[J]. Age Ageing,2019,49(1):119-124. DOI:10.1093/ageing/afz120. PAN R B,ZHANG Y,XU Z W,et al. Exposure to fine particulate matter constituents and cognitive function performance,potential mediation by sleep quality:a multicenter study among Chinese adults aged 40-89 years[J]. Environ Int,2022,170:107566. DOI:10.1016/j.envint.2022.107566. KOULOURIS N,DIMAKOU K,GOURGOULIANIS K,et al. Self-perceived quality of sleep among COPD patients in Greece:the SLEPICO study[J]. Sci Rep,2022,12(1):540. DOI:10.1038/s41598-021-04610-z. ADIR Y,HUMBERT M,CHAOUAT A. Sleep-related breathing disorders and pulmonary hypertension[J]. Eur Respir J,2021,57(1):2002258. DOI:10.1183/13993003.02258-2020. NEALE C D,CHRISTENSEN P E,DALL C,et al. Sleep quality and self-reported symptoms of anxiety and depression are associated with physical activity in patients with severe COPD[J]. Int J Environ Res Public Health,2022,19(24):16804. DOI:10.3390/ijerph192416804. SHAH A,AYAS N,TAN W C,et al. Sleep quality and nocturnal symptoms in a community-based COPD cohort[J]. COPD,2020,17(1):40-48. DOI:10.1080/15412555.2019.1695247. HIRATA R P,DALA POLA D C,SCHNEIDER L P,et al. Tossing and turning:association of sleep quantity-quality with physical activity in COPD[J]. ERJ Open Res,2020,6(4):370-2020. DOI:10.1183/23120541.00370-2020. SEJBUK M,MIRO?CZUK-CHODAKOWSKA I,WITKOWSKA A M. Sleep quality:a narrative review on nutrition,stimulants,and physical activity as important factors[J]. Nutrients,2022,14(9):1912. DOI:10.3390/nu14091912. HASAN F,TU Y K,LIN C M,et al. Comparative efficacy of exercise regimens on sleep quality in older adults:a systematic review and network meta-analysis[J]. Sleep Med Rev,2022,65:101673. DOI:10.1016/j.smrv.2022.101673. KALU?NIAK-SZYMANOWSKA A,KRZYMI?SKA-SIEMASZKO R,DESKUR-?MIELECKA E,et al. Malnutrition,sarcopenia,and malnutrition-sarcopenia syndrome in older adults with COPD[J]. Nutrients,2021,14(1):44. DOI:10.3390/nu14010044. JIANG H Y,YE L F,ZHANG S M,et al. The association between nutritional status and sleep quality of Chinese community-dwelling older adults[J]. Aging Clin Exp Res,2023,35(9):1945-1954. DOI:10.1007/s40520-023-02479-8. SUTANTO C N,LOH W W,TOH D W K,et al. Association between dietary protein intake and sleep quality in middle-aged and older adults in Singapore[J]. Front Nutr,2022,9:832341. DOI:10.3389/fnut.2022.832341. SIRAJ R A,MCKEEVER T M,GIBSON J E,et al. Incidence of depression and antidepressant prescription in patients with COPD:a large UK population-based cohort study[J]. Respir Med,2022,196:106804. DOI:10.1016/j.rmed.2022.106804. LONG J,OUYANG Y,DUAN H Z,et al. Multiple factor analysis of depression and/or anxiety in patients with acute exacerbation chronic obstructive pulmonary disease[J]. Int J Chron Obstruct Pulmon Dis,2020,15:1449-1464. DOI:10.2147/COPD.S245842. HAN Y Y,YAN Q,CHEN W,et al. Child maltreatment,anxiety and depression,and asthma among British adults in the UK Biobank[J]. Eur Respir J,2022,60(4):2103160. DOI:10.1183/13993003.03160-2021. 周晓苹,方荣华. 全科病房慢性阻塞性肺疾病患者焦虑抑郁状况调查及影响因素分析[J]. 中华全科医学,2022,20(6):1003-1006. DOI:10.16766/j.cnki.issn.1674-4152.002510. CHOI J S,KWAK S H,SON N H,et al. Sex differences in risk factors for depressive symptoms in patients with COPD:the 2014 and 2016 Korea National Health and Nutrition Examination Survey[J]. BMC Pulm Med,2021,21(1):180. DOI:10.1186/s12890-021-01547-x. VAN BEERS M,RUTTEN-VAN MOLKEN M P M H,VAN DE BOOL C,et al. Clinical outcome and cost-effectiveness of a 1-year nutritional intervention programme in COPD patients with low muscle mass:the randomized controlled NUTRAIN trial[J]. Clin Nutr,2020,39(2):405-413. DOI:10.1016/j.clnu.2019.03.001. MUSCARITOLI M. The impact of nutrients on mental health and well-being:insights from the literature[J]. Front Nutr,2021,8:656290. DOI:10.3389/fnut.2021.656290. VOLPATO E,FARVER-VESTERGAARD I,BRIGHTON L J,et al. Nonpharmacological management of psychological distress in people with COPD[J]. Eur Respir Rev,2023,32(167):220170. DOI:10.1183/16000617.0170-2022. (收稿日期:2024-01-02;修回日期:2024-03-12) (本文編辑:毛亚敏)

