基于18F-FDG PET 的帕金森病脑葡萄糖代谢特征的纵向研究
冯蓓,王蓉,李玲,刘莹,王会伟,董逸远,赵倩*
1.宁夏医科大学总医院核医学科,宁夏 银川 750000;2.武汉大学中南医院核医学科,湖北 武汉 430000;3.香港大学深圳医院皮肤科,广东 深圳 518000;*通信作者 赵倩 cecilia_hh@126.com
帕金森病(Parkinson's disease,PD)是一种进行性神经退行性疾病[1],其特点为与路易体相关的PD经典运动特征和黑质多巴胺能神经元丧失,如静息性震颤、强直、运动障碍和姿势不稳定[2]。了解PD疾病进展速度,特别是在早期阶段,对于评估潜在神经保护治疗方案至关重要。目前,PD诊断主要依赖临床症状,缺乏客观性,且PD早期临床症状常与几种相似的疾病重叠[3]。PET/CT是一种分子成像技术,可以无创跟踪各路神经元和精神疾病的脑病理、生理活动[4]。18FFDG PET已用于评估脑葡萄糖代谢,在脑代谢性疾病研究中具有实用价值。
准确、全面地描述PD自然病程和病理生理活动是评估其进展的关键。基于FDG PET利用机器学习预测PD患者认知能力下降具有较高价值[4]。部分研究将代谢特征与PD的运动和认知表现相关联,并且已有少量纵向研究提示PD进展[5],但对于其在疾病早期进展的研究较少。
本研究对早期PD患者进行4年纵向PET成像研究,确定与疾病进展相关的区域,分析不同时期感兴趣区(ROI)代谢活性与平均统一帕金森病评定量表(movement disorder society-sponsored revision of the unified Parkinson's disease rating scale,MDS-UPDRS)评分的关系;并与健康对照组比较,建立PD患者不同时期的糖代谢模式,分析目标ROI随时间的变化规律,探讨不同时期的ROI与认知或运动的关系。
1 资料与方法
1.1 研究对象 本研究使用的数据来自帕金森进展标志物研究项目数据库(PPMI,http://www.ppmiinfo.org/Data)。PPMI是一项针对早期PD的多中心观察性研究站,自2010年6月起招募参与者,经批准后可通过数据门户访问。PD纳入标准:①有最近的特发性PD诊断;②未接受PD治疗;③早期PD(发病时间1~4年);④无临床医师确诊的痴呆。排除标准:①PET影像数据或临床数据缺失;②其他脑部疾病;③服用药物或手术治疗。本研究的目的、方法和活动范围既往已公布[6],研究报告得到每个地点的机构审查委员会批准,参与者均提供书面知情同意书。本数据集于2022年9月17日下载。
为尽量减少头部运动的影响,PD患者在服用常规药物的同时进行研究(MDS-UPDRS Ⅲ为ON)。共纳入PD 42例,男27例,女15例,平均年龄(66.31±9.21)岁;健康对照者8例,男5例,女3例,平均年龄(68.15±6.52)岁。健康志愿者数据同样从PPMI数据库中获得。
1.2 临床评估 使用MDS-UPDRS I测量精神、行为和情绪障碍,Ⅱ、Ⅲ测量日常生活能力和运动检查的活动,得分为0~4。
1.318F-FDG PET成像及处理 受试者均完成临床评估和18F-FDG PET扫描[4]。本研究使用示踪剂注射后10 min的18F-FDG图像,在ROI和体素水平处理和分析下载的18F-FDG PET图像。
本研究中42例特发性PD分别于不同就诊时间接受18F-FDG PET扫描,共57个数据点纳入纵向分析:7例在基线就诊时行第一次扫描,15例在12个月就诊时行第一次扫描,15例在24个月就诊时行第一次扫描,12例在36个月就诊时行第一次扫描,8例在48个月就诊时行第一次扫描。
在MATLAB R2014a上运行统计参数映射(SPM)8。原始数据先使用MRIcro(www.mricro.com)从DICOM转换为ANALYZE格式,并将其放在SPM 8的标准PET模板上。所得体素大小为2 mm×2 mm×2 mm;然后用高斯滤波器(半最大值全宽度,FWHM 16 mm)对标准化数据进行平滑处理。
1.4 ROI测定 为研究不同解剖分割标准对ROI表现的影响,本研究使用自动解剖标记地图集和MRICRO Brodmann面积(BA)地图集进行单独分析。通过SPM 8实验发现,PD患者与健康对照组相比,尾状核、壳核、苍白球、小脑、前扣带回、后扣带回、黑质致密部和黑质网状部等ROI的FDG摄取减少,将其定义为靶区。
1.5 统计学分析 使用Matlab 2014a、SPSS 26.0和GraphPad Prism 9.5.0软件。符合正态分布的计量资料以±s表示,多组间比较采用方差分析;不符合正态分布者以M(Qr)表示。计数资料以例数表示,组间比较采用χ2检验。最初在SPM中,高度阈值T设为>3.01,P=0.025(经家族误差校正),范围阈值k设为50体素。利用Xjview软件识别差异脑代谢区,计算各组脑区体素值。然后将图像空间归一化,结果以代表性峰体素的Talairach坐标以及各自的K值、T评分和BA列出。
选择全脑作为参考区域,获得标准化摄取值比值图。所有区域均在自动解剖标记3.0中识别。采用相关分析探究PD患者8个脑区,5个时间点的扫描数据,评估各区域ROI变化与疾病进展的线性程度。使用Spearman检验估计PD患者在不同进展阶段与MDSUPDRS I、Ⅱ、Ⅲ评分的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 受试者基本信息 PD组和对照组的基本信息见表1。PD各组与健康对照组年龄和性别差异均无统计学意义(P均>0.05)。
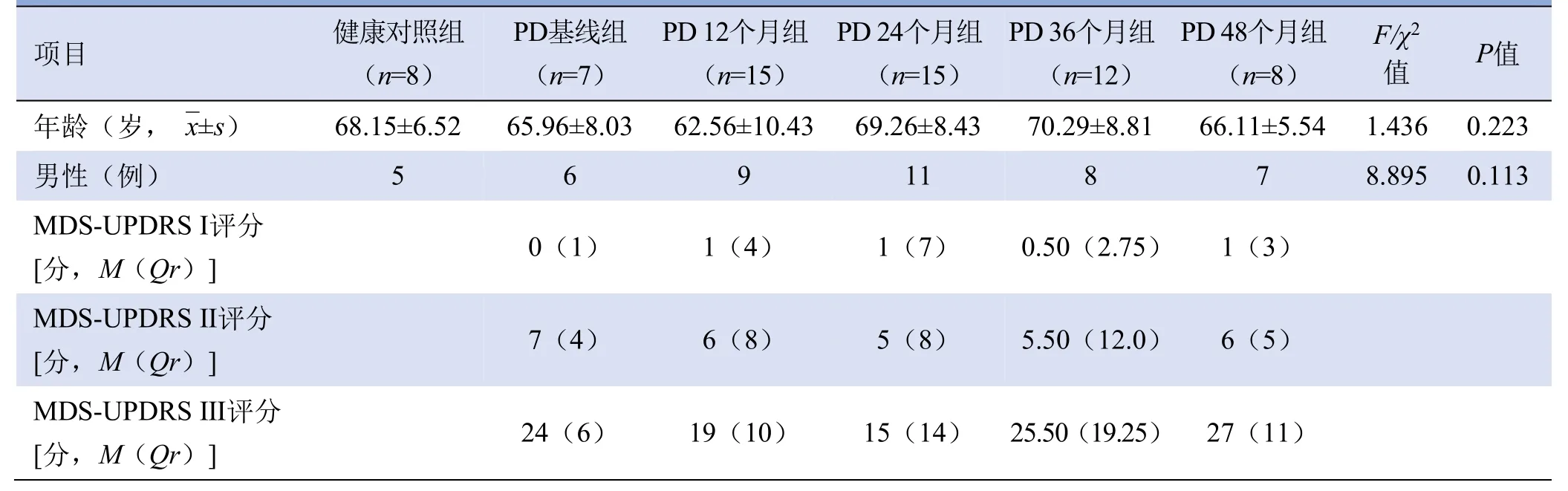
表1 PD患者与健康对照组的基本信息
2.2 PD组脑葡萄糖代谢随时间的变化模式 PD患者纵向脑葡萄糖代谢变化见图1、2和表2、3。与健康受试者相比,PD患者壳核或尾状核代谢在基线、12个月和24个月时显著增加;小脑代谢在基线和24个月时增加;楔前叶(BA31)和扣带回(BA32)代谢在基线、12个月和36个月时均有所增加;颞上回代谢在12个月和48个月时增加。前额叶、边缘叶和下顶叶代谢在不同时期减低。
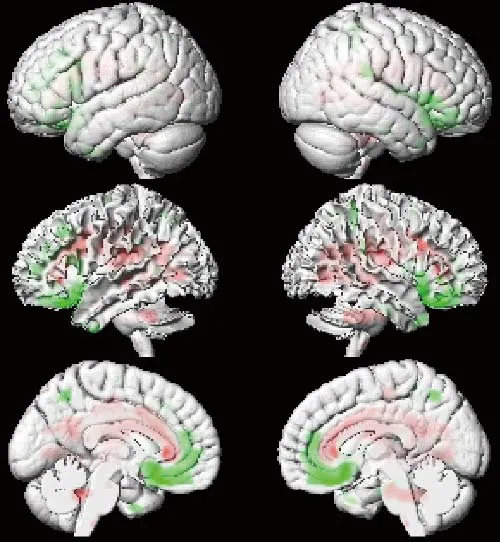
图1 PD基线患者与健康对照组脑葡萄糖代谢比较。红色和绿色分别为PD基线患者葡萄糖代谢增加和减少的区域
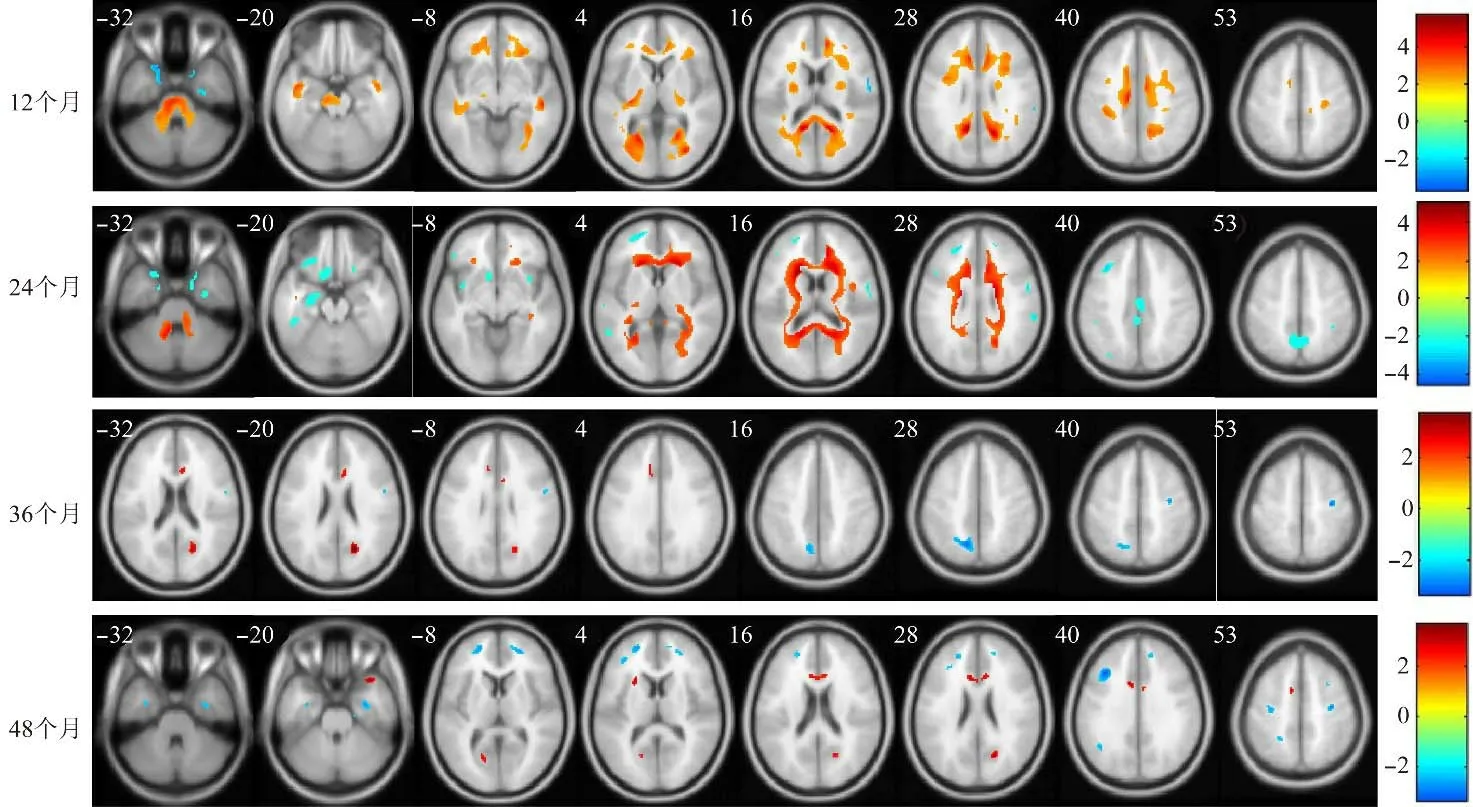
图2 健康对照组与PD组(12、24、36、48个月)体素差异的统计参数图。右侧颜色条表示T值,红色条带表示PD患者脑代谢增高的区域

表2 PD患者脑葡萄糖代谢增加的脑区
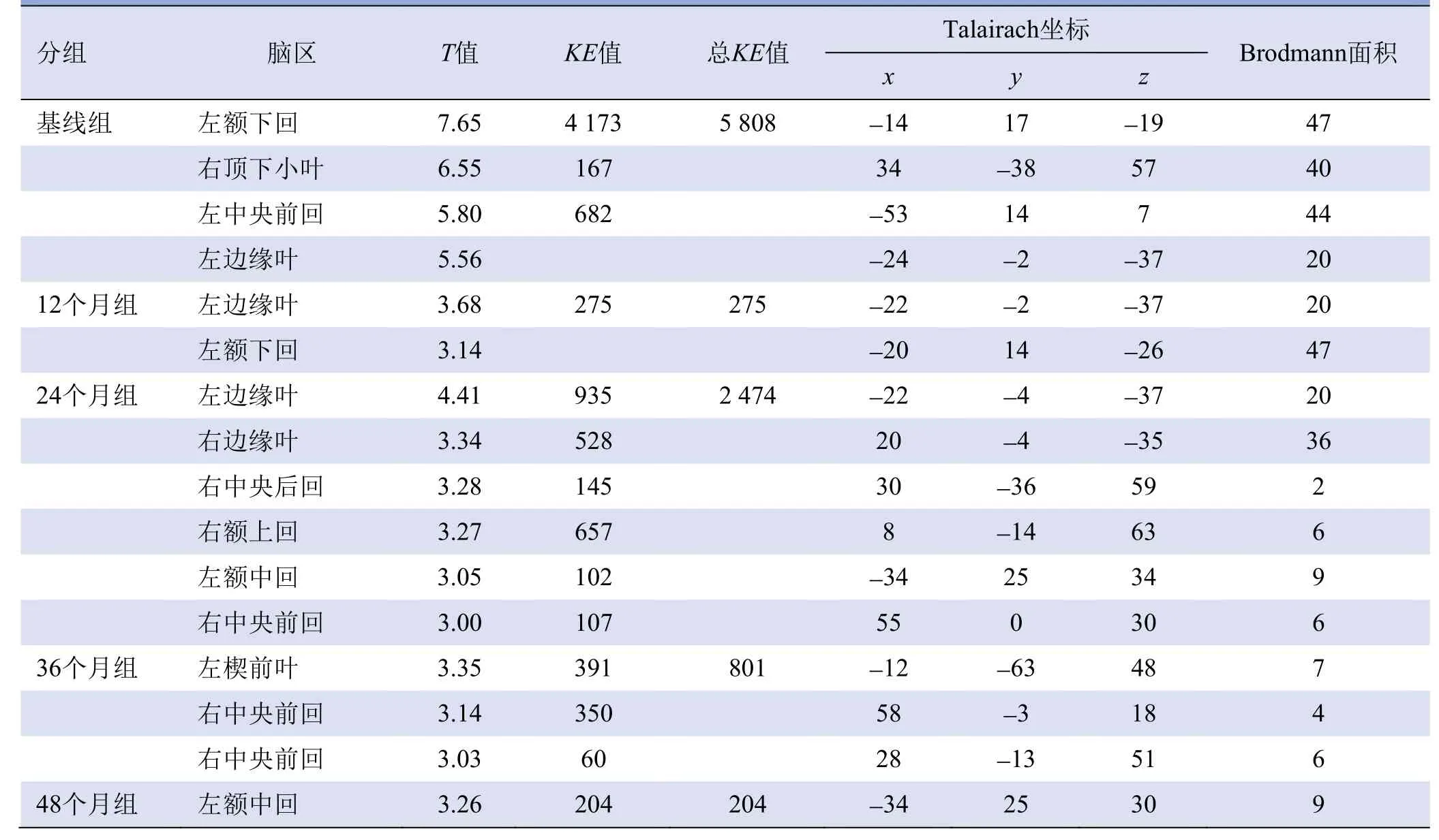
表3 PD患者脑葡萄糖代谢降低的脑区
2.3 PD组脑靶区ROI随病程变化规律 PD尾状核、壳核、苍白球和小脑的ROI均高于健康对照组。随着病情进展,除尾状核外,其余核团的ROI均不同程度下降,且均高于对照组(图3A~D)。前扣带回、后扣带回、黑质致密部和黑质网状部的ROI低于对照组,随着病程发展逐渐升高(图3E~H)。
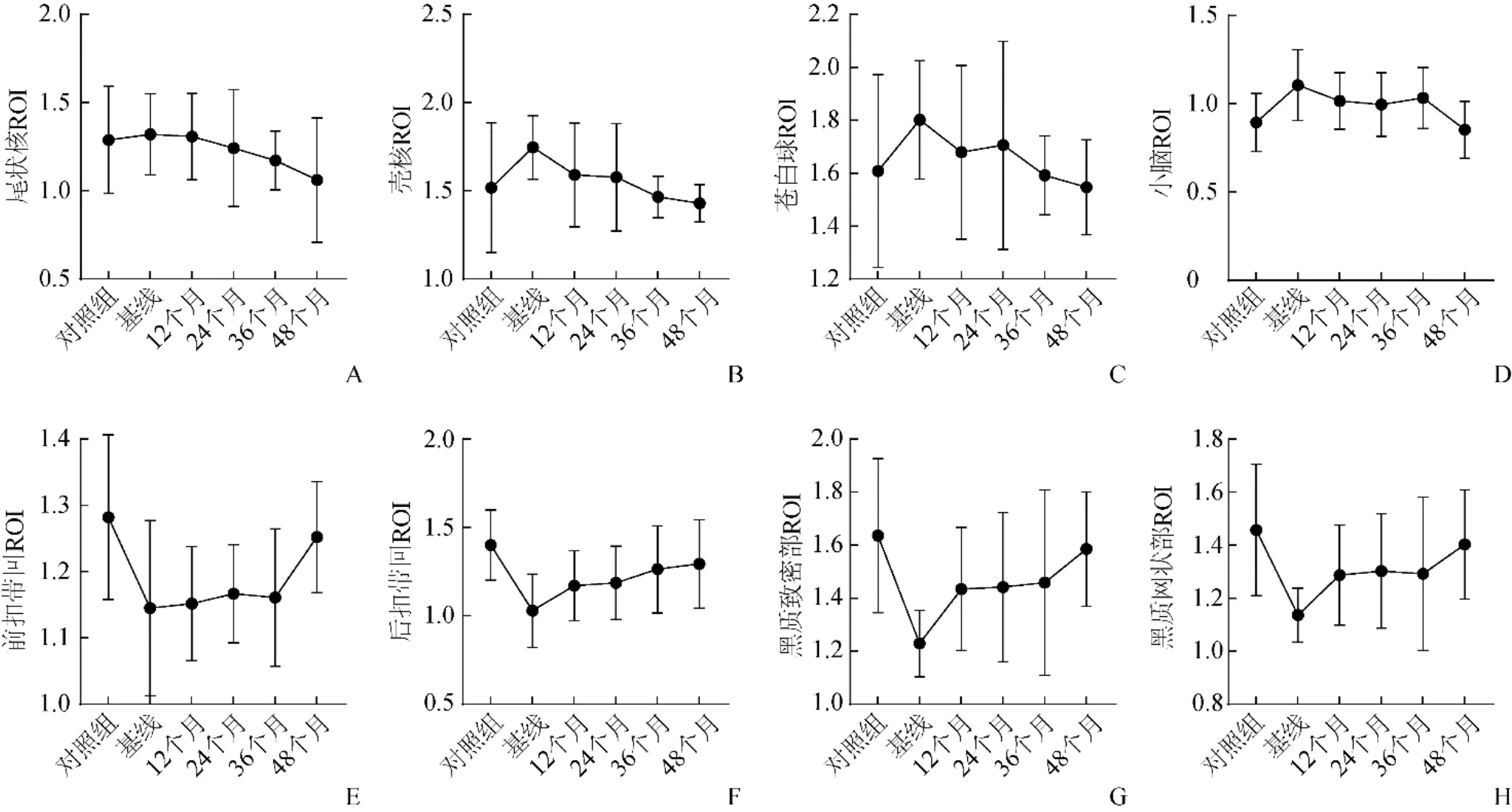
图3 PD组和健康对照组在基线、12、24、36和48个月时尾状核(A)、壳核(B)、苍白球(C)、小脑(D)、前扣带回(E)、后扣带回(F)、黑质致密部(G)和黑质网状部(H)的ROI
2.4 不同时期ROI代谢活性与MDS-UPDRS评分的相关性 壳核、苍白球和尾状核代谢活性在36个月时和基线时与MDS-UPDRS评分呈正相关(r=0.659 5、0.678 7、0.716 7,P均<0.05),在24个月时和基线时与MDS-UPDRS评分呈负相关(r=-0.541 8、-0.878 9、-0.887 6,P均<0.05);其余核团与MDS-UPDRS评分均无相关性。
3 讨论
本研究确定了早期PD患者不同阶段脑葡萄糖代谢模式,位于额叶和顶叶联合区的活动相对减少,而小脑、壳核和扣带回的活动相对增加。PD患者小脑的ROI始终高于正常组,壳核、苍白球和尾状核的ROI最初高于正常组,随后下降;而扣带回、黑质的ROI与之相反。尾状核、壳核和苍白球与MDS-UPDRS评分具有相关性。
3.1 脑葡萄糖代谢随疾病进展的变化 Cao等[7]研究显示与PD认知障碍相关的脑代谢/灌注异常表现为位于额叶和顶叶联合区活动相对减少,小脑活动相对增加,与本研究结果一致。该研究中,基线组、12个月组和24个月组的PD患者尾状核和壳核有不同程度增加。神经影像学研究发现,皮层下结构尤其是纹状体的代谢和功能变化与PD症状变异性有关[8]。纹状体是基底神经节回路中最重要的核团,主要由兴奋性皮层谷氨酸能传入、丘脑传入及来自中脑的调节性多巴胺能传入驱动[9-10],控制目标导向的行动选择、习惯学习和动机过程[11]。
PD患者小脑葡萄糖代谢在基线和24个月时增加。Quartarone等[12]报道与PD的运动症状相关的小脑过度活动以及肌张力障碍,并认为其与运动控制有关。此外,PD患者在基线、12个月和36个月时扣带回代谢增强。前扣带皮层与内脏运动、骨骼运动和内分泌流出有关,后扣带皮层与空间定位和记忆有关[13]。在12个月和48个月时,PD患者颞上回代谢显著降低。人类颞上回是提取语音输入中有意义语言特征的关键区域,还控制着习得知识和感知目标[14]。
此外,PD患者楔前叶脑代谢在基线和36个月时有所下降。楔前叶位于顶叶后部和内侧,是一个联合皮层,涉及运动和认知任务[15]。
执行功能障碍和思维障碍位于前额皮质[16]。本研究结果显示背外侧前额叶皮层(BA 9/46)和内侧前额叶区域(BA 25/32)激活。长期以来,研究者认为前额叶功能障碍与思维障碍有关[17],由于PD认知症状的任何病理生理学解释均须考虑前额叶功能障碍,PD影响的过程定位可能有助于深入了解其可能的机制。
3.2 靶区代谢的变化 本研究评估了与PD相关ROI活动的纵向变化。相关病理研究表明,1年后壳核背侧的多巴胺能标志物轻度损失,3年后出现中度至重度损失,而在诊断后4年及以后,后壳核背侧几乎完全失去染色,仅偶尔检测到异常的多巴胺能纤维[18]。这种变化趋势在脑葡萄糖代谢中具有类似的表现。顾惠芳等[19]选取PD患者深部灰质核团区进一步研究,发现磁敏感加权成像图和相位图均存在自回归模型纹理参数值变化。
Sanchez-Catasus等[20]研究表明,在黑质致密部,酪氨酸羟酶阳性神经元在研究的最早时间点已有50%~90%的损失,此后仅有少量额外损失。在PD患者中,黑质致密部多巴胺能神经元退化会引发一系列影响整个基底神经节网络的功能变化,如影响回路的输出核、内侧苍白球和黑质网状部,使其变得过度活跃。这种过度活跃由输出核从丘脑下核接收到的增强的谷氨酸能输入维持[21]。此外,黑质致密部的多巴胺能神经元变性会激活小胶质细胞,然后通过释放潜在的神经毒性因子(一氧化氮、细胞因子和活性氧),促进多巴胺能神经元变性。另一方面,基底神经节输出区(黑质网状部和苍白球)中的小胶质细胞也被激活,以响应过度活跃的丘脑底核突触释放的过量谷氨酸[22]。但本研究中未发现此差异性改变。
随着疾病进展,前期的临床恶化率可能比较慢,而以PET成像作为替代标志物的神经保护研究,最好在PD早期进行。
3.3 PD进展中MDS-UPDRS评分与靶区ROI的关系本研究结果显示,壳核和苍白球与36个月时的MDSUPDRS I评分呈正相关,与基线时的MDS-UPDRS Ⅱ评分呈负相关。尾状核与24个月时的MDS-UPDRS I评分呈负相关,与基线时的MDS-UPDRS Ⅲ评分呈正相关。
尾状核与认知缺陷有关,而壳核则更多地与运动缺陷有关[23]。Johansson等[24]研究发现壳核体积与疾病持续时间呈负相关,功能MRI研究也显示,壳核的功能缺陷与PD的运动症状有关。手部运动时壳核活性降低与更严重的运动缺陷有关[25]。
MDS-UPDRS可对疾病严重程度进行全面和详细的评定。Johansson等[24]认为,尾状核/壳核多巴胺转运蛋白结合的变化与运动MDS-UPDRS评分存在显著负相关。该研究表明,MDS-UPDRS数据和多巴胺转运蛋白结合数据在基线和评估的第1、2和4年具有相关性,这种相关性表明了一个非线性过程。通过简单的线性回归分析,所有纹状体亚区多巴胺能耗竭与MDS-UPDRS Ⅲ评分呈负相关。然而,经过多元线性回归分析,右侧前后壳核多巴胺能缺陷与MDSUPDRS Ⅲ评分相关[26]。程禹等[27]研究显示,左侧壳核的纹理特征与PD患者的认知功能有一定相关性。
MDS-UPDRS I、Ⅱ、Ⅲ具有心理测量学上的局限性,限制了对早期PD相关症状和影响的测量精度。这可能需要多方面的证据,如影像学、病理学和生物标志物,从而更客观地解释早期PD的纵向变化。
3.4 本研究的局限性 虽然本研究中随访患者数量相对较少,但总体进展数据相当稳健,部分研究结果仍需进一步验证。①本研究对PD患者的MDS-UPDRSⅢ评分进行评估,此类患者正在服用药物以避免运动对图像质量的负面影响,但药物本身可能会影响PD的进展速度,从而干扰真实结果。②本研究并非每例患者均有连续4次的自身对照数据,可能存在偏倚。
总之,本研究提供了PPMI研究的3个主要结果:在一组新诊断的PD患者中,脑代谢差异区ROI的纵向变化及与MDS-UPDRS评分的关联。本研究结果为设计PD患者临床和影像学方法相结合的研究提供了框架,临床医师可以使用其早期干预和减缓PD的进展。

