血清白细胞介素-1β、肿瘤坏死因子-α与脑梗死患者预后的关系研究
吴延华,郭江涛,赵广珍,李 艳,宋清扬
脑梗死是一种高致残、高死亡率的疾病,是因为人体内血液循环受阻,导致脑组织缺氧缺血,进而造成与之相对应神经区域功能发生障碍[1]。根据调研显示,近年来脑梗死发病率逐渐上升,其治疗周期长,不良预后较多,治疗后易并发各种中枢系统后遗症[2 - 3]。随着对脑梗死发病机理的进一步研究,脑缺血的炎性反应及其损伤逐渐并为人们所关注,多种因子在炎症反应中起到了关键的作用。血清白细胞介素-1β(interleukin-1,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)皆为关键性的炎性细胞因子,它们在人体内抵御有害因子的侵犯及炎性活动中都起着关键性的作用[4]。脑梗死发生后,人体内IL-1β的血清水平会上升,继而会使内皮细胞加速分泌细胞黏附分子,进一步分泌更多的炎性介质和自由基等,从而启动一系列级联反应,加速炎性反应的进展,导致脑损伤程度加剧,脑内梗死面积增大,TNF-α利用加速内皮细胞组织因子合成分泌,进一步地抑制纤溶系统,从而使得血栓形成[5]。前期研究发现,C-反应蛋白、中性粒细胞等炎性因子增加,会相应地使炎性反应进程加快,从而导致脑梗死的发生。因此早期发现脑梗死炎性反应与提高脑梗死患者预后水平十分重要。目前临床上关于炎性因子表达以及对于脑梗死的预后关系研究相对较少,本研究旨在研究IL-1β、TNF-α与脑梗死患者预后的关系。
1 对象与方法
1.1对象 选取2022年1月 ~ 12月于北京市隆福医院神经内科就诊的经影像学等临床检查确诊为急性脑梗死患者136例设为观察组。研究经北京市隆福医院医学伦理委员会审批通过(2019-19),所有患者或家属均对本研究治疗方案知情同意。
纳入标准:(1)诊断标准依据中华医学会1995年版诊断标准[6];(2)入组患者皆是临床首次卒中或既往曾有卒中病史,但未遗留后遗症;(3)所有患者都已接受头部MRI检查;(4)除外潜在的心源性栓子;(5)脑梗死急性期为发病24 h内,恢复期为入院治疗7 d以上。排除标准:(1)3月内有严重头部创伤或中风史、颅内及椎管内手术史;(2)有肝肾功能不全史;(3)有肿瘤病史;(4)有颅内出血史;(5)有活动性内脏出血;(6)受试期间不遵医嘱,依从性较差者。
另选取同期于本院进行体检的健康志愿者136例设为健康对照组。纳入标准:(1)没有严重临床、循环系统等异常病史;(2)体检前两周未服用任何药品;(3)年龄 >18周岁;(4)临床数据完整。
两组研究对象性别、年龄、疾病史等差异无统计学意义(P> 0.05),具有可比性。
1.2方法 (1)所有研究对象禁食8 h后采集清晨空腹静脉血,进行冷冻保存备用。使用酶联免疫吸附法(ELISA)进行检测IL-1β、TNF-α水平。(2)采用美国国立卫生研究所卒中量表(NIHSS)评分评价患者的预后[7]。评分 <4分为轻度神经功能障碍,4 ~ 15分为中度神经功能障碍,15分为重度神经功能障碍。
2 结果
2.1两组研究对象一般资料比较 两组研究对象在性别、年龄、疾病史等一般资料比较中差异无统计学意义(P>0.05)。见表1。
表1 两组研究对象一般资料对比[例
2.2两组研究对象IL-1β、TNF-α水平比较 观察组患者不同时期IL-1β、TNF-α水平高于健康对照组,差异有统计学意义(P<0.05)。脑梗死患者进入恢复期后,IL-1β、TNF-α水平逐渐回落,低于急性期,差异有统计学意义(P<0.05);NIHSS评分也低于急性期,差异有统计学意义(P<0.05),见表2。

表2 两组研究对象IL-1β、TNF-α水平及NIHSS评分比较
2.3预测影响脑梗死预后的多因素logistic回归分析 经logistic多因素回归分析显示,IL-1β、TNF-α升高是影响急性脑梗死预后的独立危险因素(P<0.05)。见表3。
2.4IL-1β、TNF-α对急性脑梗死预后诊断价值分析 ROC结果显示,IL-1β、TNF-α升高对急性脑梗死预后影响曲线下面积(AUC)分别为0.758、0.768,对应灵敏度分别为82.43%、65.13%,特异性分别为68.59%、94.11%。两者联合诊断的AUC为0.893,灵敏度和特异度分别为83.72%和94.13%。见表4。
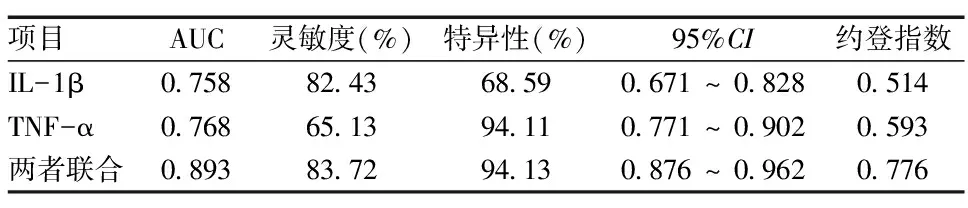
表4 IL-1β、TNF-α水平对急性脑梗死预后的诊断价值分析
3 讨论
中国脑血管病发病率高达320万,并呈现逐年递增的态势,其所造成的疾病负担已经高居首位,近年来研究发现,炎症反映在脑梗死发生发展中发挥了关键作用[8]。在急性期,由于脑部血液供应不足,脑部组织核心区细胞坏死,导致相当多炎症因子在脑部组织中大量的释放,引起了脑部组织的凋亡和炎症因子的积聚。急性期脑血流的突然中断导致脑缺血核心区细胞坏死,坏死细胞内物质的释放进一步诱导细胞凋亡和炎性细胞因子聚集,其可导致梗死附近的细胞死亡并加重脑损伤。在此过程中,氧化应激、钙离子过量及炎症的加剧等因素会引起血脑屏障(BBB)的破坏,相应脑组织进行解体,以及大脑自身抗原的暴露,从而引起免疫系统的活化,并促使其向中枢神经系统进行转移,加剧了大脑的局部炎症反应,进而进一步损伤脑组织[9]。一方面,脑梗死后炎症反应表现为脑内局部组织的损害,另一方面,还可诱发其他脏器出现炎症反应。对于脑梗死的预后,除了要对神经功能恢复程度进行评价外,还要对梗死后认知损伤的恢复进行关注,这给患者及其家属带来了相当沉重的负担,进一步引起了医学界的关注[10]。
IL-1β作为脑梗死损伤后出现的最早的促炎性细胞因子,主要是使得单核/巨噬细胞、中性粒细胞进行活化,并对它们的吞噬杀伤功能进行增强,从而促进它们释放炎性蛋白和炎症介质[18]。IL-1β可利用对T细胞进行刺激从而使得其释放白细胞介素-2(IL-2),同时针对性地抑制可保护脑组织的白细胞介素-4(IL-4)的表达,进而损伤脑组织。而IL-1β还可以通过激活内皮细胞中的黏附因子,促使白细胞与脑部微血管进行黏附,引发炎症反应,破坏BBB,加剧BBB损伤。脑梗死后6 ~ 24 h内,IL-1β水平显著增高,梗死区血流量增加,易导致缺血及再灌注损伤,严重时可出现出血转化。有研究表明,将IL-1β直接注射到脑缺血大鼠的脑室或脑组织中,会引起更严重的脑损伤[19]。急性缺血低氧状态下,小鼠前脑组织中IL-1β mRNA水平明显升高,在缺氧后4 h为最高值。而研究发现,将IL-1β受体拮抗剂基因导入小鼠脑室,可上调IL-1β受体拮抗剂的表达,改善小鼠脑组织缺血性损害。本研究显示,观察组的IL-1β水平与梗死严重程度成正比,IL-1β水平恢复期与急性期差异明显,同时与健康对照组比较,差异亦有统计学意义。logistic多因素回归分析显示,IL-1β水平升高是影响脑梗死患者预后的独立危险因素,提示IL-1β水平对于脑梗死预后预测有着一定的诊断价值。
小胶质细胞(microglia,MG)作为一种神经胶质细胞,约占大脑中的20%,与脑和脊髓中的巨噬细胞功能相似,在中枢神经系统起着第一道免疫防线的作用[11]。MG在炎症反应中发挥着重要作用,但其过度活化或不受控制会导致神经损伤。有研究报道称,MG除了参与炎症反应外,还参与调控神经元活性,在机体产生炎性反应后,其过度激活会产生大量促炎因子例如TNF-a,抑制炎症因子的释放,从而改善认知功能[12 - 13]。作为脑梗死后炎性反应中被广泛研究的炎性因子,TNF-α在脑梗死开始后1 ~ 3 h后浓度增加,并在24 ~ 36 h内达到峰顶,而后降低[14]。有研究发现,脑梗死后3个月血浆TNF-α浓度增高,与脑梗死后3个月的内皮损伤和预后差密切相关,并伴随着TNF-α浓度增高的脑梗死体积增大,从而发现TNF-a可为研究脑梗死发病机制提供依据,TNF-α可通过与血管内皮细胞相互作用,使其渗透性发生变化,并可引起血管内皮细胞和白细胞的黏附[15]。除此之外,有学者指出,TNF-α可以直接导致损伤多核白细胞进行大量聚集,同时释放炎症因子并使其活化,并通过黏附因子的释放与激活,进一步强化了该作用[16 - 17]。本研究显示,观察组TNF-α水平明显高于健康对照组,具有一定的差异性,且与梗死严重程度成正比。通过NIHSS评分可知,患者病情愈发好转,TNF-α水平越低,NIHSS评分越低,预后程度越好。logistic多因素回归分析显示,TNF-α水平升高是影响脑梗死患者预后的独立危险因素,提示TNF-α水平对于脑梗死预后预测有着一定的诊断价值。
本研究通过ROC曲线预测TNF-α水平、IL-1β水平对脑梗死患者预后的影响,结果发现,TNF-α水平、IL-1β水平预测脑梗死患者预后的AUC分别为0.758、0.768,提示TNF-α水平、IL-1β水平对脑梗死患者预后的预测有一定的诊断效能。为了更好地预测脑梗死患者的预后,本次研究观察了两者联合的诊断效能,结果显示,联合诊断的AUC为0.893,灵敏度和特异度分别为83.72%和94.13%,这也提示了TNF-α水平、IL-1β水平两者联合预测的价值较高于单独诊断,可有效提高对于脑梗死患者预后的预测。越来越多研究表明,炎症标记物与脑梗死预后相关,并有可能成为独立的预测因素,严密监测炎症标记物的动态反应对脑梗死具有重要预测价值[20]。
本研究尚有一定的局限性,因时间、空间及人力之限制,本研究样本规模较小,未来可以扩大样本进一步研究。本研究为多中心协作之长期追踪研究,未来可作更深入之探讨。

