维持性血液透析患者发生肌少症的危险因素分析
胡成云,金 莉,周舒梅
肌少症(sarcopenia)是以肌量和肌力进行性和广泛性减少为特征的临床综合征[1]。2016年10月,国际疾病分类ICD-10疾病编码正式纳入肌少症,认可其为一种独立的疾病。肌少症最显著的表现是肌肉无力、疼痛,行动受限,导致跌倒致伤、骨折致残和死亡等不良后果[2]。除与年龄相关的原发性肌少症外,能量或蛋白质摄入不足、长期久坐或卧床以及疾病均可导致继发性肌少症[3]。维持性血液透析(maintenance hemodialysis,MHD)患者普遍存在运动能力下降,而且MHD是一种不完全性肾功能替代疗法,不能完全纠正尿毒症的代谢紊乱和清除体内蓄积的毒性物质,使尿毒症患者更容易发生肌少症[4]。国外学者分析了MHD患者低肌肉质量、握力弱和步态速度慢与死亡率的关系,发现上述肌少症指标均是MHD患者死亡的独立危险因素[5]。此外,已有多项研究发现肌少症可显著增加透析患者心脑血管事件、住院等不良结局的发生风险[6 - 8]。虽然近年血液透析专科人员对肌少症的关注程度有所增加,但肌少症的早期表现不易被察觉。因此,了解MHD患者肌少症发生的影响因素,合理干预,对提高MHD患者生活质量,减少死亡等不良结局具有重要价值。
1 对象与方法
1.1对象 研究经六安市中医院医学伦理委员会审批通过。选取2021年1月 ~ 2023年2月于六安市中医院行血液透析患者151例。纳入标准:(1)年龄45 ~ 80岁;(2)透析龄 >3个月,每周3次;(3)四肢健全无畸形,功能正常;(4)签署知情同意书。排除标准:(1)有神经源性、肌源性肌肉萎缩病史;(2)脑卒中、心梗等严重心脑血管疾病既往史;(3)合并恶性肿瘤;(4)糖尿病足;(5)近期有手术史或长期卧床;(6)严重感染或心力衰竭,一般情况差;(7)体内有起搏器、人工关节等影响生物电阻抗试验。
1.2肌少症诊断
1.2.1肌肉质量测量 采用生物电阻抗分析(bioelectrical impedance analysis,BIA)原理的人体成分分析仪(韩国Jawon公司,型号X-Scan Plus Ⅱ,国械注进20162403045)测量。所有患者去除金属饰品或物品后双脚赤足踏在检测踏板足部电极上,双手握住手部电极,上肢需离开躯干,测量完成后,系统根据被测者身高、性别、年龄计算四肢骨骼肌质量指数(skeletal muscle mass index,SMI)。
1.2.2肌肉力量测量 使用电子握力计(广东香山衡器集团股份有限公司,型号EH102),测试者身体直立,双臂下垂,使用优势手(造瘘者使用非造瘘侧手)握住握力器,最大力量紧握,测试3次,取最大值为握力(HGS)值。
1.2.3肌肉功能测定 以6 m步行试验测定肌肉功能,用胶带在地面标记6 m的直线距离,被测者以正常步速沿着标记行走,记录行走6 m所用的时间。测试2次,取平均值,计算步速(GS)。
1.2.4诊断标准 采用亚洲肌少症工作组(AWGS)诊断标准[9]。(1)SMI:男 <7.0 kg/m2,女 < 5.7 kg/m2。(2)HGS:男 <28 kg,女 <18 kg。(3)GS <1.0 m/s。在符合(1)的基础上符合(2)或(3)均可诊断为肌少症。
1.3方法 收集患者性别、年龄、透析龄、吸烟状况、饮酒状况、每周规律运动及合并症等的一般资料。吸烟标准为每天吸卷烟1支以上,连续或累计6个月。饮酒标准为近3个月平均每天饮酒酒精量超过15 g。规律运动标准为每次运动30 min以上,每周运动3次以上。糖尿病由本院内分泌科、高血压由本院心内科分别依据指南进行诊断。使用改良定量主观整体评估问卷(modified quantitativesubjective global assessment,MQSGA)评估患者的营养状况。MQSGA包括7项:6个月内体重变化、饮食变化、活动能力、胃肠道症状、并发症、肌肉消耗表现、皮下脂肪减少程度。得分越低营养状况越好,得分 >10分为营养不良,≤10分为营养良好。
于肌少症诊断前后1周内采集患者透析前后静脉血,进行实验室指标检查。指标包括钙、磷、尿素氮、肌酐、血红蛋白、白蛋白、前白蛋白、总胆固醇、三酰甘油、铁蛋白、甲状旁腺素、超敏C反应蛋白(hs-CRP)、25-羟维生素D[25(OH)D]、二氧化碳结合力(CO2CP)等。
计算透析相关指标,其中单室尿素清除率(single pool urea clearance index,spKt/V)采用Daugirdas单室模型计算:Kt/V=-In(R-0.008 t)+(4-3.5R)×△BW/BW,R为透后尿素氮/透前尿素氮,t为治疗时间,△BW为超滤量,BW为透后体重。标准蛋白分解率(normalized protein catabolic rate,nPCR)=(透析前血尿素氮-透析后血尿素氮)×(0.045/两次透析间隔天数)。
根据患者是否出现肌少症分成两组,对肌少症组和无肌少症组的上述指标进行比较。
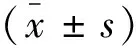
2 结果
2.1肌少症患病率 151例MHD患者中,共46例诊断为肌少症,患病率为30.46%。根据是否合并肌少症分成两组,无肌少症组105例,肌少症组46例。
2.2两组MHD患者一般特征与检测指标比较 肌少症组的BMI、白蛋白、前白蛋白、肌酐、CO2CP低于非肌少症组,年龄、糖尿病患者占比、MQSGA评估营养不良占比、hs-CRP高于非肌少症组,组间差异有统计学意义(P< 0.05),见表1。
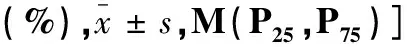
表1 两组MHD患者临床资料比较[例
2.3MHD患者发生肌少症的多因素分析 将单因素分析中存在统计学差异的指标进行logistic多因素回归分析并对指标进行校正。年龄、合并糖尿病、营养不良、超敏C反应蛋白、二氧化碳结合力是影响肌少症发生的独立危险因素(P< 0.05),见表2。
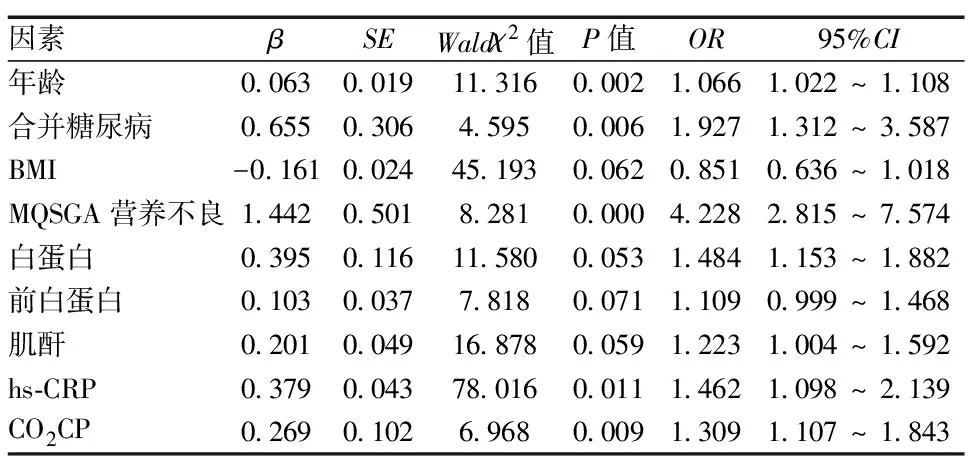
表2 MHD发生肌少症的logistic多因素回归分析
3 讨论
肌少症的患病率因诊断标准不同而出现差异,Papadopoulou等[10]根据欧洲老年肌少症工作组(EWGSOP)、亚洲肌少症工作组(AWGS)、国际肌少症工作组(IWGS)诊断标准对社区居民进行的调查结果发现男/女患病率分别为11%/10%、12%/11%、8%/5%。江涛等[11]对我国老年人群进行的荟萃分析显示,老年社区人群肌少症的患病率为11%。考虑到亚洲人群体形整体偏小,肌肉质量低,本研究采用了2019年修订的AWGS标准,结果显示MHD患者肌少症患病率为30.46%,再次证实MHD患者是肌少症高发人群。
进一步多因素回归分析显示年龄、合并糖尿病、营养不良、超敏C反应蛋白、CO2CP是影响肌少症发生的独立危险因素。增龄可导致肌肉流失加剧,随着年龄的增长肌纤维从Ⅱ型向Ⅰ型转变,脂滴浸润明显,提供速度、力量的快肌减少,导致肌肉质量和功能均降低。研究发现,人体肌肉质量在30岁左右达到顶峰,50岁开始明显减少,此后每年损失1%左右,80岁时肌肉质量可减少30%[12]。糖尿病也是发生肌少症的危险因素之一,糖尿病患者胰岛素抵抗,抑制胰岛素释放,骨骼肌是胰岛素的靶器官,胰岛素减少,骨骼肌细胞摄取、利用葡萄糖减少,糖代谢受损,可能导致P-AKT减少和肌肉消耗[13]。肌肉的合成和修复离不开蛋白质,亮氨酸还是肌肉蛋白质合成中最有效的刺激剂,营养不良摄入氨基酸蛋白质不足会直接影响肌肉质量[14]。尿毒症患者常有食欲减退,尿毒症相关胃肠道症状导致摄食减少,很容易发生营养不良。透析过程中还存在氨基酸丢失,而且尿毒症MHD患者肌肉蛋白平衡的调节机制更为复杂,微炎症反应、代谢性酸中毒等均影响肌肉蛋白代谢,溶解蛋白使患者骨骼肌降解[15]。营养不良在MHD患者中普遍存在,这可能也是本研究中肌少症组与非肌少症组白蛋白、前白蛋白、BMI等多个与营养相关指标存在差异的原因。微炎症状态在MHD患者中较为常见,早期阶段即可发现C反应蛋白、IL-6、TNF-α水平升高。这些炎症因子可通过诱导核因子κB通路活化,抑制肌细胞的分化,使肌肉迅速萎缩。此外,炎症反应在泛素-蛋白酶体系统活化中发挥重要作用,活化使可溶性的14 kDa的肌动蛋白片段断裂、蛋白溶解增加[16]。血清CO2CP水平反应体内代谢性酸中毒情况,代谢性酸中毒除诱导泛素-蛋白酶体系统活化外,也导致骨骼肌氨基酸过度氧化,天冬氨酸特异性半胱氨酸蛋白酶-3活性上调,会引起肌动蛋白片段增加,分解增加,肌细胞凋亡增加[17]。除增加蛋白降解外,代谢性酸中毒还可通过促进肌肉蛋白消耗等途径引起肌肉萎缩,研究表明,纠正酸中毒可降低蛋白质分解代谢速率,有助于改善患者肌肉减少[18]。
有研究发现,规律运动是肌少症的保护因素,有氧运动和抗阻运动均可降低促炎性细胞因子表达,抑制骨骼肌降解,抗阻运动还可通过激活骨骼肌磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号通路促进蛋白质合成,增大肌细胞体积[19]。但本组患者中坚持每周规律运动且运动时长达标患者偏少,两组间未能产生统计学差异。可以进一步通过扩大样本量、荟萃分析、多中心研究等方式弥补本研究局限性。
总之,年龄增加、合并糖尿病、营养不良、超敏C反应蛋白升高、CO2CP降低是影响MHD患者肌少症发生的独立危险因素,需根据MHD患者特点,尽早识别,实施个体化的干预方案。

