糖尿病足患者血清HIF-1α、Fetuin-A水平与下肢血管病变的相关性研究
李兴梅,贺璞流芳,胡 杰,李 蒙
糖尿病足综合征(DFS)是糖尿病(DM)最具破坏性的并发症之一,其常见临床特征包括溃疡、足部畸形、感染、神经病变、下肢动脉疾病(LEAD)、骨髓炎和坏疽,通常见于中晚期DM患者[1]。据统计,DFS约占非创伤性截肢手术的60%[2]。LEAD是糖尿病足创伤和截肢发展过程中最常见的合并症,高达50%的DFS患者患有潜在LEAD,因此早期识别LEAD风险,并由多学科团队提供适当的管理,可以降低不良结局的发生率[3 - 4]。迄今为止,DFS的发病机制尚未明确,通常认为它与周围神经病变、血管疾病和足部感染有关[5]。缺氧诱导因子-1α(HIF-1α)是一种转录因子,在低氧适应反应的发展中起着关键作用[6]。缺氧条件下活性氧自由基水平升高可抑制DM患者HIF-1α基因表达[7]。胎球蛋白-A(Fetuin-A)是一种在胎儿血清中含量较高的载体蛋白,通过抑制酪氨酸激酶降低胰岛素活性[8]。据报道,Fetuin-A在调节胰岛素敏感性、体重增加和脂肪积累方面发挥着重要作用[9]。最近的研究强调,HIF-1α、Fetuin-A水平与外周动脉疾病(PAD)间可能存在关联,而DFS是PAD在DM中最严重的后果之一[10 - 12]。尽管血清HIF-1α、Fetuin-A水平已被证明与DM和PAD有关,但关于血清Fetuin-A、HIF-1α水平与DFS发展之间的关系尚未见确切报道。因此,本研究探讨血清Fetuin-A、HIF-1α水平与DFS发展之间的可能关系。
1 对象与方法
1.1对象 选取2020年7月 ~ 2022年2月西安交通大学第一附属医院榆林医院内分泌科收治的98例2型糖尿病(T2DM)合并DFS患者作为DFS组。其中男性72例;年龄35 ~ 90岁,中位年龄68.5岁;Wagner分级1级34例、2级10例、3级25例、4级28例、5级1例;踝臂指数(ABI)为1.04(0.62,1.17);趾臂指数(TBI)为0.58(0.29,0.85)。按照年龄、性别、糖尿病病程相匹配的原则,1∶1比例选取同期本院就诊的102例单纯T2DM患者作为T2DM对照组,男性73例;年龄28 ~ 75岁,中位年龄55.0岁;无任何PAD或周围神经病变证据。
纳入标准:(1)成年人群;(2)所有参与者都进行75 g口服葡萄糖耐量试验,T2DM的诊断依据《中国2型糖尿病防治指南2020版》,且糖尿病病程持续10年以上[13];(3)DFS的诊断参照最新版《中国糖尿病足诊治指南》,根据Wagner分级,DFS至少达到Wagner 1级的全层皮肤破裂[14]。排除标准:患有恶性肿瘤、肝肾功能障碍、自身免疫性疾病、任何其他临床全身急性或慢性炎症性疾病、未经治疗的高血压、妊娠期糖尿病、1型糖尿病和糖尿病合并其他并发症的受试者。
另从本院体检中心招募100例非糖尿病人群作为健康对照组,无糖尿病以及其他任何PAD或周围神经病变证据,男性70例,年龄25 ~ 90岁,中位年龄75岁。
所有受试者均了解研究程序,并提供书面知情同意书。根据《赫尔辛基宣言》,研究由西安交通大学第一附属医院榆林医院医学伦理委员会批准(LL20200530)。
1.2方法 所有研究参与者都要接受完整的人口统计学和病史评估,包括年龄、糖尿病持续时间、治疗类型、吸烟、高血压。所有患者均接受完整的体检,包括身高、体重测量和体质量指数(BMI)计算。采用日立7020全自动生化分析仪检测血清空腹血糖(FPG)、肌酐(Cr)、总胆固醇(Chol)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。使用全自动血细胞分析仪(美国贝克曼,DxH800)测定红细胞压积(Hct)。用离子交换-高效液相色谱法(美国Bio-Rad VariantⅡ分析仪)测定全血HbA1c水平。对所有研究对象进行全面的糖尿病足检查,包括足部触压觉(10 g尼龙丝)、凉温觉、痛觉等检查,并评估振动感知阈值(VPT)、深部肌腱反射。眼底检查由眼科医生完成。
1.3LEAD评估 由两名具有5年以上彩色多普勒超声经验的放射科医生同时使用线性探头(12 MHz Logiq 9,美国GE Medical Systems)测量下肢动脉(股动脉、腘动脉、胫前/后动脉和足背动脉)、趾动脉、上臂肱动脉收缩压,计算踝臂指数(ABI)和趾臂指数(TBI)。下肢血管并发症包括动脉内膜增厚、动脉粥样硬化、斑块和狭窄。根据下肢血管病变的严重程度评估分级:正常0分,50% ~ 75%狭窄计1分,> 75%狭窄计2分,弥漫性斑块或血管完全闭塞计3分,总分20分[15]。将DFS患者分为下肢血管正常(总分0分)亚组(n=23)和LEAD亚组(n=75)。
1.4血清HIF-1α、Fetuin-A水平检测 夜间禁食后,在超声检查当天收集外周静脉血5 ml,以3 000 r/min速度,离心半径10 cm,离心10 min,取血清于-80 ℃低温保存。采用酶联免疫吸附试验法检测血清HIF-1α、Fetuin-A水平,试剂盒均购自武汉菲恩生物科技有限公司,批间和批内变异系数均低于9%。ELISA实验中所绘制标准曲线的相关系数R值分别为0.997和0.992。
1.5统计学处理 采用SPSS 26.0软件进行数据分析,计量资料进行Kolmogorov-Smirnov检验,偏态分布数据以中位数[四分位值(IQR)]表示,并使用Kruskal-WallisH检验和Mann-WhitneyU分析。使用(%)和卡方检验表示和检验二分类变量。相关性采用Spearman秩相关系数法分析。单因素及多因素logistic回归分析血清HIF-1α和Fetuin-A水平与DFS患者LEAD风险的关系。以P< 0.05为差异有统计学意义。
2 结果
2.13组受试者临床资料比较 3组受试者SBP、DBP、吸烟史、HbAlc、FPG、Cr、Chol、TG、HDL、LDL、Hct等比较,差异有统计学意义(P<0.05)。与健康对照组相比,DFS组和单纯T2DM组患者血清HIF-1α和Fetuin-A水平均显著升高,其中DFS组水平变化更显著,差异有统计学意义(P<0.05)。在对单纯T2DM组和DFS组年龄和体重指数(BMI)进行调整后,进行了多变量协方差分析,3组间血清HIF-1α和Fetuin-A水平差异仍有统计学意义(P<0.001),见表1。

表1 3组受试者一般临床资料比较[例
2.2DFS患者血清HIF-1α、Fetuin-A水平与疾病严重程度的关系 经Spearman秩相关系数分析,DFS组Wagner分级与血清Fetuin-A(rs=0.459,P< 0.001)和HIF-1α(rs=0.356,P< 0.001)水平呈正相关。而且Wagner分级与和超声检查结果也呈正相关(rs=0.417,P< 0.001)。
2.3DFS患者血清HIF-1α、Fetuin-A水平与LEAD发生的关系 经超声检查,53例DFS患者存在LEAD,发病率为54.08%。与下肢血管正常亚组相比,LEAD亚组DFS患者血清Fetuin-A[135.53(100.47,316.38)ng/mlvs. 83.18(55.74,104.40)ng/ml]、HIF-1α[422.67(338.90,561.71)pg/mlvs. 240.07(178.82,328.36)pg/ml]水平均显著升高,差异有统计学意义(Z=-5.899、-5.493,P< 0.001)。经单因素和多因素logistic回归分析,血清HIF-1α和Fetuin-A仍是DFS患者发生LEAD风险的独立预测因子(P< 0.05),见表2。
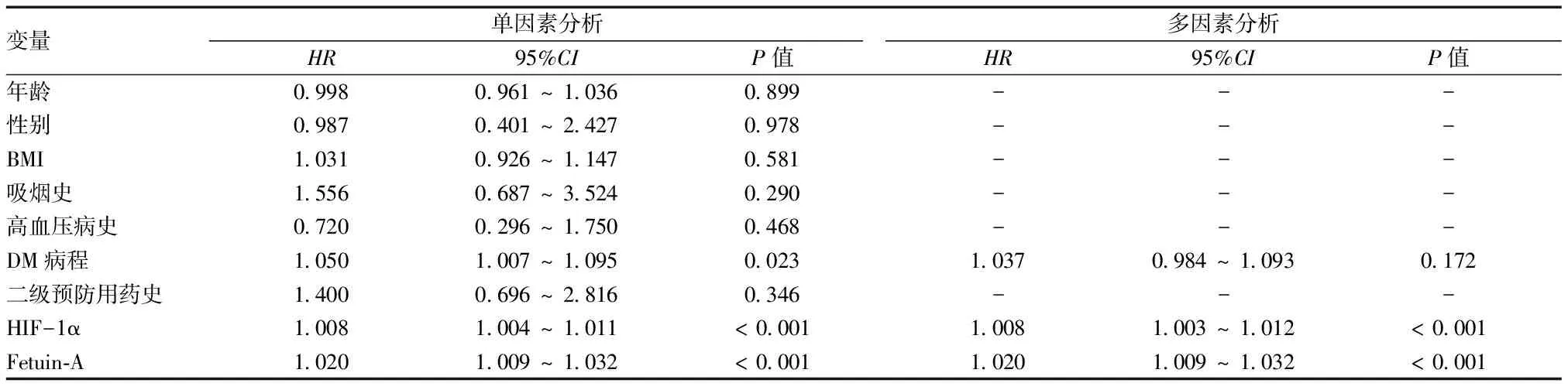
表2 血清HIF-1α和Fetuin-A水平与DFS患者LEAD风险的关系
2.4DFS患者血清HIF-1α、Fetuin-A水平与超声结果的关系 经Spearman秩相关系数分析,DFS组患者血清Fetuin-A、HIF-1α水平与下肢血管病变评分呈正相关(rs=0.533、0.516,P< 0.001)。血清Fetuin-A水平与TBI呈弱的负相关(rs=-0.194,P=0.048)。而血清HIF-1α与ABI、TBI均呈负相关(rs=-0.201、-0.347,P< 0.05)。
2.5多元线性回归分析 校正年龄、性别、BMI、糖尿病史、血糖因素后,经多元线性回归分析,DFS患者血清Fetuin-A水平仍与Wagner分级、下肢血管病变评分呈正相关性(β=0.004、0.013,t=3.337、3.423,P<0.05)。血清HIF-1α水平仍与Wagner分级、下肢血管病变评分呈正相关(β=0.002、0.007,t=3.491、3.510,P<0.05);与TBI呈负相关(β=0.001,t=-3.837,P< 0.001)。
3 讨论
DFS是与神经系统疾病和/或PAD相关的DM患者足部感染、溃疡或组织破坏,也是DM致残、致死的主要原因之一[1 - 2]。LEAD存在于约50%的DFS患者中,被认为是DFS预后不良的重要影响因素[3 - 4]。与没有LEAD的患者相比,患有LEAD的DFS患者愈合的可能性较小,并且截肢风险更高[4 - 7]。因此,早期识别下肢血管病变高风险的患者至关重要。本研究发现与健康对照组和单纯T2DM组相比,DFS组患者血清HIF-1α和Fetuin-A水平显著升高。而且在DFS患者中,LEAD亚组患者血清HIF-1α和Fetuin-A显著高于下肢血管正常亚组,提示血清HIF-1α和Fetuin-A水平与DFS患者LEAD风险密切相关,可作为重要生物标志物。
HIF-1α是一种氧浓度依赖性关键转录因子,在缺氧损伤后它可与特定的核辅助因子结合,调节包括血管内皮生长因子(VEGF)在内的多个靶基因,从而调控各种缺氧诱导的适应性反应,如血管生成、代谢和细胞凋亡[7]。有研究表明,HIF-1α参与了DFS足溃疡的愈合和血管生成,在DFS的血管生成中发挥重要调节作用[16]。同时,HIF-1α已被证明能够与内皮细胞中的HIF-1β亚基结合,以增加转录和与VEGF启动子的结合,提高VEGF的表达水平,从而引发一系列反应诱导血管生成并增加局部溃疡区的血液供应,促进DFS患者的伤口愈合[17 - 18]。Zhang 等[19]研究发现,20(S)-原人参二醇处理的足溃疡小鼠可以通过上调HIF-1α介导的VEGF的表达来刺激血管生成。既往研究还揭示过度表达的HIF-1α可以增强内皮细胞的增殖,促进足溃疡大鼠的伤口愈合[16]。本研究发现DFS患者血清HIF-1α明显上调,而DFS合并LEAD组血清HIF-1α水平升高更显著,提示高血清HIF-1水平与下肢血管病变高风险有关。从机制上讲,血清HIF-1α高表达可能是由局部组织的缺氧和缺血引起的,这激活了内源性防御和修复机制,导致对缺氧有反应的转录复合物HIF-1α的增加,从而影响糖代谢并上调HIF-1α诱导基因的表达,促进血管生成。既往研究也证实LEAD可导致外周组织缺氧,从而触发HIF-1α的转录[20]。Qin等[11]研究还显示HIF-1α在股动脉闭塞引起的外周动脉病变(PAD)大鼠的肌肉感觉神经中增加。这些研究结果表明HIF-1α表达与血管病变之间存在直接关系。
Fetuin-A是由肝细胞形成的糖蛋白,以高浓度分泌到血清中,它的血清浓度与胰岛素抵抗直接相关,因为Fetuin-A可以抑制胰岛素受体酪氨酸激酶的自身磷酸化,影响胰岛素信号传导,诱导胰岛素抵抗,其高水平与T2DM高风险的关联已有较多报道[9,11,21]。有趣的是,Fetuin-A还可以促进血管生成,类似于VEGF[7]。据报道,血清Fetuin-A水平升高与DM大血管并发症有关,有助于DFS的发展[22]。与上述研究相一致,本研究也发现DFS患者血清Fetuin-A水平显著升高,且与Wagner分级呈正相关,提示血清Fetuin-A与DFS发展有关。而且,本研究发现合并LEAD的DFS患者血清Fetuin-A进一步上调,提示高血清Fetuin-A与下肢血管病变风险的密切关联。Fetuin-A对血管结构的影响可能由两种机制引起。首先,高Fetuin-A水平已被证明会损害葡萄糖代谢[11,22]。它可能通过诱导胰岛素抵抗等参与DFS和LEAD的发展。有研究表明,Fetuin-A与心血管疾病风险之间存在显著关系,Fetuin-A升高会导致动脉粥样硬化性血管疾病[23]。Ozenc等[22]研究也表明,Fetuin-A水平的升高与PAD风险相关,这与本研究结果相似。其次,Fetuin-A可通过增加血清钙和磷的溶解度来调节异位钙磷沉积和血管钙化[9]。提示Fetuin-A在血管病变的发展中发挥重要作用,其高水平可能预示着下肢血管病变高风险。
本研究发现,与健康对照组相比,单纯T2DM组和DFS组患者HIF-1α、Fetuin-A均升高,且DFS组患者两种因子升高更显著,提示高血糖对HIF-1α和Fetuin-A有显著影响,且HIF-1α和Fetuin-A水平在DFS的发展中起重要作用,与血管病变有关。在DFS患者中,LEAD亚组患者血清HIF-1α和Fetuin-A显著高于下肢血管正常亚组。经logistic回归分析,血清HIF-1α和Fetuin-A时是DFS患者LEAD风险的独立预测因子。这些研究结果提示血清HIF-1α和Fetuin-A高水平与DFS患者下肢血管病变高风险有关。血清HIF-1α和Fetuin-A还与Wagner分级和下肢血管病变评分呈正相关,提示HIF-1α和Fetuin-A过表达可能预示着严重疾病。本研究结果表明,血清HIF-1α和Fetuin-A表达在长期高糖下会显著上调,与DFS患者LEAD的发生发展密切相关。
综上所述,血清HIF-1α和Fetuin-A水平与DFS患者LEAD风险密切相关,可作为下肢血管病变风险的可靠预测生物标志物。但是本研究也存在一定的局限性,例如患者人数较少、HIF-1α和Fetuin-A在下肢血管病变中具体机制尚未明确。

