血清同型半胱氨酸水平对脑小血管病总负荷的影响
崔 瑜,张沐源,孟清丽,高 欢,杨成程,郑 义
脑小血管病(cerebral small vessel disease,CSVD)除增加罹患脑卒中风险外,还可导致血管性痴呆、认知和精神障碍、排尿障碍以及步态异常等[1 - 2]。但由于缺乏特异性临床表现,且症状异质性较大,导致早期识别困难。尤其是慢性CSVD发病隐匿可无临床症状,多依靠影像学检查诊断[1]。2013年国际血管改变神经影像标准报告小组制定了CSVD的国际影像标准,CSVD的几种典型影像学表现并不是孤立存在的,有学者提出通过推测血管起源的白质高信号(white matter hy-perintensities,WMH)、血管周围间隙(perivascular spaces,PVS)、推测血管起源的腔隙(Lacunes)、脑微出血(cerebral mi-crobleed,CMB)这4项最典型CSVD的影像学表现进行CSVD影像学总负荷评分,以评估CSVD的总体影响[3]。同型半胱氨酸(homocysteine,Hcy)是反应性的血管损伤氨基酸,有研究报道,与大血管相比,小血管损伤与Hcy的相关性更强[4]。既往研究中,Hcy水平与CSVD患者脑白质高信号、腔隙性脑梗死的关系已有文献报道,但关于Hcy与影像学总负荷的研究较少[5 - 6]。因此,本研究观察血清Hcy水平对脑小血管病总负荷的影响。
1 对象与方法
1.1对象 筛选2018年1月 ~ 2022年11月经承德市中心医院神经内科确诊的CSVD患者242例。其中男性139例,女性103例;血管源性腔隙122例,CMB 89例,PVS 126例,WMH 101例。研究经承德市中心医院医学伦理委员会审核通过,且患者或家属对本研究治疗方案知情同意。
纳入标准:(1)临床资料及影像资料完整;(2)依据国际神经影像学血管性改变报告(STRIVE)诊断CSVD;(3)病因分型为小动脉硬化型;(4)年龄 >35岁。排除标准:(1)脑肿瘤、外伤等非血管源性病因导致的脑白质病变;(2)脑卒中既往史、颈动脉重度狭窄;(3)实验室检查前3个月服用过叶酸等影响Hcy水平的药物;(4)合并恶性肿瘤;(5)合并慢性炎症性疾病、自身免疫性疾病;(6)房颤既往史、中枢神经系统疾病既往史。
1.2方法 整理患者性别、年龄、既往史等一般资料。实验室检查选择MR检查前后2周内的空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、红细胞沉降率(ESR)、尿酸(UA)、肌酐(Cr)、Hcy等指标检测结果。影像学检查采用美国GE公司MR750 3.0 T磁共振机进行检查,扫描序列主要为:T1WI、T2WI、FLAIR成像、DWI和SWI,由两名主治以上医师,在无患者相关临床资料的情况下,根据STRIVE共识进行诊断分析,结果一致即为此最终结果,如两者诊断结果有差异,则由第3名高年资医师进行审核确定最终结果。WMH为侧脑室旁或深部脑白质区异常信号,T1WI呈低信号,T2WI及FLAIR均呈高信号。病变严重程度以Fazekas分级进行评估,侧脑室旁及深部白质无异常高信号时,均计为0分,侧脑室旁的帽状、铅笔样或深部白质的小斑片状病灶均计1分,侧脑室旁光滑晕圈样或深部少量融合病灶计2分,侧脑室旁斑片状且延伸至深部或深部白质大量融合的病灶计3分。PVS为位于基底节区或半卵圆中心区的点、线样水信号,FLAIR像病灶边缘无环形高信号。血管源性腔隙为位于基底节区、内囊、半卵圆中心或脑干区的圆形或卵圆形水样信号,FLAIR像呈边缘环形高信号,DWI信号不高,直径约3 ~ 20 mm。CMB为SWI上位于颅内各部位脑实质内直径 <5 mm、边界清晰的小圆形信号缺失灶。
CSVD总负荷计分方法:血管源性腔隙≥1个计1分、CMB≥1个计1分、中重度PVS计1分、Fazekas分级侧脑室旁白质高信号3分或脑深部白质高信号≥2分计1分,总分0 ~ 4分。根据CSVD总负荷评分进行分组,0 ~ 2分为低负荷组,3 ~ 4分为高负荷组。对两组的临床资料进行比较,分析血清Hcy水平与CSVD总负荷评分的相关性。
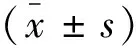
2 结果
2.1CSVD高负荷组与低负荷组比较 CSVD总负荷低负荷组115例,高负荷组127例。高负荷组年龄、TC、LDL-C、UA、Hcy水平均高于低负荷组,高血压、动脉粥样硬化占比均高于低负荷组,组间差异有统计学意义(P<0.05),见表1。
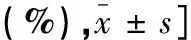
表1 CSVD高负荷组与低负荷组临床资料比较 [例
2.2CSVD总负荷影响因素的logistic分析 以CSVD总负荷为因变量,以年龄、高血压、动脉粥样硬化、TC、LDL-C、UA、Hcy为自变量,进行影响因素分析。年龄大、合并高血压、动脉粥样硬化、LDL-C、Hcy水平升高为CSVD总负荷增加的独立危险因素(P<0.05),见表2。

表2 CSVD总负荷影响因素的多因素回归分析
2.3Hcy水平与CSVD总负荷相关性 Spearman相关分析显示,Hcy水平与CSVD总负荷呈弱正相关(r=0.028,P=0.013)。
3 讨论
研究表明,脑内微动脉、小动脉、小静脉等小血管病变的病理过程存在共性影响因素,病变过程相似或相同,因此,应将CSVD视为全脑疾病来对待[7]。WMS、PVS、CMB等一系列表现,是全脑小血管受累的表现,且彼此之间是相互关联的,评估所有存在的脑小血管病变,能够得出更加全面、准确的结论。这也是本研究使用总负荷评估法对CSVD导致整体脑功能损害进行评估的原因。
有学者认为CSVD是老龄人群认知障碍、痴呆的重要罪魁祸首,约40%的痴呆由CSVD引起,但由于CSVD常与阿尔茨海默病、帕金森病等老年退行性疾病共病,其临床识别与干预往往是滞后的[8]。年龄、高血压等是CSVD的传统危险因素,本研究也得出同样结果。此外,本研究亦发现,Hcy水平升高是CSVD总负荷评分增高的独立危险因素。与本研究结果不同,邱宝山等[9]进行的研究未得出Hcy水平和高同型半胱氨酸血症是CSVD总体负荷增加的危险因素的结论。本研究认为造成差异的主要原因是样本数量,该研究高负荷组入组病例10例,本研究高负荷组入组127例,高负荷、低负荷组病例数均超过百例,能减少结果的偏倚。
Feng等[10]发现高Hcy对小血管损伤的敏感性比大血管更强。Hcy水平升高导致脑小血管损伤的机制可能包括:引起氧化应激使血小板活化、血栓形成;Hcy修饰的蛋白成为新抗原,激活炎性反应,引起循环巨噬细胞的激活,反复损伤血管内皮细胞;诱导基质金属蛋白酶9水平升高进而破坏血脑屏障;高Hcy使内皮型一氧化氮合酶失活,引起血管内皮舒张功能障碍,导致脑灌注调节功能障碍产生低灌注;损伤血管内皮使蛋白外渗;上调血管内皮细胞黏附因子,增加内皮细胞黏附,促进泡沫细胞及动脉斑块形成[11]。
高同型半胱氨酸血症是心脑血管病发生的重要危险因素,之前研究着重于大血管病变[12]。本研究发现其与CSVD严重程度亦具有相关性。多种因素可影响Hcy代谢酶的反应活性导致其升高。通过药物干预,降低Hcy水平是否可以延迟CSVD发生仍需进一步研究。但作为CSVD发生的独立危险因素,关注Hcy水平早期干预可以优化CSVD的防治方案。

