银屑病治疗方法的研究进展
常倩 杨仕平
DOI: 10.3969/J.ISSN.1000-5137.2024.01.009
收稿日期: 2023-11-01
基金項目: 国家自然科学基金重大研究计划培育项目(91959105)
作者简介: 常 倩(1997—), 女, 硕士研究生, 主要从事磁性四氧化三铁材料用于银屑病治疗等方面的研究. E-mail:1798713199@qq.com
* 通信作者: 杨仕平(1969—), 男, 教授, 主要从事磁共振成像造影剂的开发及其应用等方面的研究. E-mail:shipingy@shnu.edu.cn
引用格式: 常倩, 杨仕平. 银屑病治疗方法的研究进展 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):67?73.
Citation format: CHANG Q, YANG S P. Research progress on treatment methods for psoriasis [J].Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):67?73.
摘 要: 银屑病是一种免疫介导的炎症性皮肤病,涉及角质形成细胞与免疫细胞的相互作用. 根据患者的病情严重程度,银屑病的治疗方法可以分为3种类型,即局部治疗、光疗和全身治疗. 局部治疗主要针对轻中度银屑病患者,但是有皮肤渗透性差、药物皮肤滞留率低等问题;此外,通过口服或肠外给药的全身治疗也存在一些不足之处,包括肝毒性以及需要医疗保健专业人员给药等. 为了解决上述治疗方法存在的问题,研究人员设计了一种基于微针(MNs)的药物输送系统. MNs可以破坏皮肤最外面的角质层,将药物输送到更深的皮肤区域,通过调整针头高度来局部或全身递送抗银屑病药物,而不会产生任何疼痛. 因此,MNs被认为是一种具有应用前景的治疗系统. 文章综述了局部治疗、光疗和全身治疗等治疗方法及其局限性,介绍了MNs的5种类型,即固体MNs、空心MNs、包衣MNs、溶解和水凝胶MNs,并对其进行了展望.
关键词: 银屑病; 治疗; 微针(MNs); 研究进展
中图分类号: O 611 文献标志码: A 文章编号: 1000-5137(2024)01-0067-07
Abstract: Psoriasis is an immune-mediated inflammatory skin disease involving the interaction between keratinocytes and immune cells. Depending on the severity of the patients condition, psoriasis treatment can be categorized into three types: topical treatment, phototherapy, and systemic treatment. Topical treatment is primarily targeted at patients with mild to moderate psoriasis. However, it faces challenges such as poor skin permeability and low drug retention rates on the skin. Furthermore, systemic treatments administered orally or through parenteral routes also have some drawbacks, including hepatotoxicity and the need for healthcare professionals for administration. To address the issues associated with existing treatment methods, researchers have designed a microneedle-based drug delivery system. Microneedles (MNs) can disrupt the outermost layer of the skin, allowing drug delivery to deeper skin regions. By adjusting the height of the needles, the system can deliver anti-psoriatic drugs locally or systemically without causing any pain. Therefore, MNs are considered a promising therapeutic system. This article provides a comprehensive review of various psoriasis treatment methods, including topical, phototherapy, and systemic treatments, along with their limitations. It introduces five types of MNs: solid MNs, hollow MNs, coated MNs, dissolving MNs, and hydrogel-forming MNs, offering prospects for their future applications.
Key words: psoriasis; treatment; microneedles(MNs); research progress
0 引 言
银屑病是一种由免疫介导的慢性炎症性疾病,会在皮肤上造成红色、厚厚的鳞状斑块. 银屑病影响了全球2%~3%的人口[1],具有角质细胞增生和炎症细胞在皮肤上浸润的特点[2]. 银屑病的治疗方法取决于其严重程度和部位等,目前的治疗方法分为3种类型,即局部治疗、光疗和全身治疗[3]. 轻度至中度银屑病患者将接受局部治疗,而中度至重度银屑病患者将接受光疗和全身治疗. 在局部治疗中,各种抗银屑病药物通过不同的递送载体(如凝胶、软膏等)局部递送到患病的皮肤上[4]. 全身治疗主要是通过口服和肠外途径将抗银屑病药物输送到体循环中[5]. 然而,上述治疗方法存在一些缺点,如外用载体的皮肤渗透性差、缺乏长期控释(数天至数周)导致频繁给药、肝毒性和胃肠道紊乱.
因此,需要开发一种缺点更少、成本更低的新型给药系统. 微针(MNs)是第三代透皮给药系统,能够破坏皮肤最外层的角质层,将药物(小分子和大分子)输送到更深的皮肤区域,以达到局部或全身治疗效果. 与凝胶、软膏等其他外用制剂不同,MNs系统由于其生物利用度的提高,可以用更少的剂量达到所需的治疗效果. 这些优点大大降低了整体治疗成本,从而改善了其他治疗的缺点,为银屑病提供了新的治疗方案,展现了更广阔的应用前景.
1 局部治疗
轻中度银屑病采用局部治疗的方法,将各种治疗剂,如钙调磷酸酶抑制剂、维生素D类似物、皮质类固醇等,通过凝胶、软膏等常规配方用于受影响的皮肤上. 钙调磷酸酶抑制剂(如他克莫司、吡美莫司等)通过抑制钙调磷酸酶的激活抑制T细胞活化[6],从而进一步阻碍炎症细胞因子的产生,预防银屑病. 维生素D类似物与细胞内维生素D受体结合,可以调节参与角化细胞过度增殖的基因[7]. 皮质类固醇(如倍他米松、氯倍他索等)可以通过减少前列腺素、白三烯以及炎症细胞因子的产生,进而发挥抗炎作用[8]. 这些药物可以作为单一疗法或与其他局部药物(如类维生素A、维生素D类似物等)联合治疗,以提高抗银屑病的效果.
但是,凝胶、软膏等输送载体不能有效地穿透最外层的皮肤屏障,阻碍了药物深入真皮层,降低了治疗效果[9]. 此外,凝胶、软膏等输送载体具有黏稠性高、质地油腻、渗透皮肤缓慢、患者缺乏依从性等缺点,限制了局部治疗的应用.
2 光 疗
光疗是通过诱导表皮T细胞和角化细胞凋亡,以减少银屑病斑块的形成,从而达到治疗效果的方法. 光疗主要针对轻中度银屑病患者,根据吸收波长可以分为3类,即窄带紫外B (NB-UVB) (311 nm)、准分子灯/激光(308 nm)和补骨脂素加紫外A(PUVA)(320~400 nm)[10]. 虽然使用光疗的费用比使用生物制剂的更加便宜[11],但是前往医疗中心接受光疗对患者来说很不方便,而且光疗存在一些副作用.
3 全身治疗
全身治疗主要用于中重度银屑病患者,主要是通过口服或肠外途径给药(小分子和大分子),以实现银屑病的治疗. 有些患者的患病皮肤位于耳朵、生殖器、头皮等部位,这时局部治疗和光疗是不适用的. 在这种情况下,患者就需要进行全身治疗. 在少数严重银屑病病例中,还建议同时使用3种疗法(局部、全身和光疗). 抗银屑病药物通过口服途径进入体循环,就可以到达身体的各个部位,比局部给药途径治疗效果更好. 治疗银屑病的常用口服药物包括环孢素[12]、甲氨蝶呤[13]、富马酸酯[14]、阿普雷米司特[15]等. 它们都是小分子,口服后具有更好的全身效果. 但是许多有效的生物制剂不能通过口服途径给药,且口服药物的生物利用度差,溶解度和渗透性低,相关副作用的风险高. 肠外给药虽然可以产生最好的治疗效果,但患者对注射感到不舒服,且可能无法承担生物制剂的费用.
生物制剂可以抑制免疫系统产生的各种细胞因子,从而切断诱导银屑病的炎症级联反应[16]. 到目前为止,已有11种生物制剂被用于治疗中重度银屑病. 它们被分为4类,即TNF-α抑制剂、IL-17抑制剂、IL-23抑制剂和IL-12/23抑制剂. TNF-α抑制剂是最早的一种通过选择性抑制TNF-α细胞因子的生物制剂. 常规用于治疗银屑病的TNF-α抑制剂有英夫利昔单抗、阿达木单抗和依那西普等. IL-17抑制剂是另一类仅抑制IL-17细胞因子家族的生物制剂,包括IL-17A,IL-17C,IL-17F,IL-17RA,IL-17E或IL-25. 目前,有3种IL-17抑制剂(brodalumab,ixekizumab和secukinumab)被批准用于治疗银屑病及其关节炎. 其次,IL-23抑制剂(risankizumab,guselkumab和tildrakizumab)是唯一被批准用于治疗中重度银屑病患者的. 这些生物制剂能够特异性抑制IL-23的p19亚基,导致TH17通路活性降低[17]. Ustekinumab则是IL-12/23抑制剂类别中唯一一种通过阻碍p40亚基,进而选择性抑制IL-12和IL-23细胞因子的药物[18].
这些生物制剂需要通过非肠道途径给药,如皮下和靜脉注射,以达到全身治疗的作用. 然而,这种给药方式会给患者带来痛苦,也需要专业的医疗保健人员. MNs贴片可以通过增加皮肤局部药物含量来改善银屑病治疗效果,药物加到MNs贴片中可以实现高效递送,使用方便,可以随时给药与终止给药. 装载抗银屑病生物制剂的MNs可以通过透皮途径递送生物制剂,从而克服上述缺点[19].
4 MNs治疗银屑病
MNs是一种独特的贴片状系统,表面布满了装着药液的凹槽和微小针头,能够穿过皮肤的角质层,将药物输送到人体的皮下细胞. 由于角质层里没有痛觉神经,因此MNs穿过时基本不会感到疼痛. 根据制作方法以及功能,MNs可以分为5种类型,即固体MNs、空心MNs、包衣MNs、溶解MNs和水凝胶MNs.
4.1 固体MNs
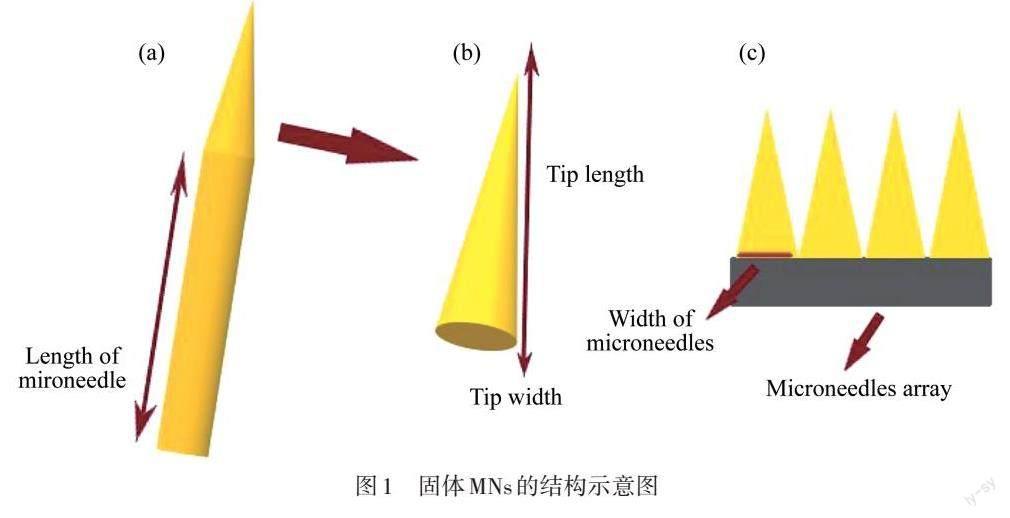
如图1所示,固体MNs的大小、形状和功能各不相同,但都可以替代传统的皮下注射针等以往的注射方式. 固体MNs的主要作用是穿刺表皮[20],通常使用的材料有玻璃、金属、硅和聚合物等,具有易制且坚固的优点,已被应用于生物医学. 固体MNs分为两部分向人体输送药物. 首先,将MNs按压于患者的皮肤上,穿透皮肤的最外层,形成较多较深的微孔;其次,通过贴片将药物输送到患病皮肤.

图1 固体MNs的结构示意图
4.2 空心MNs
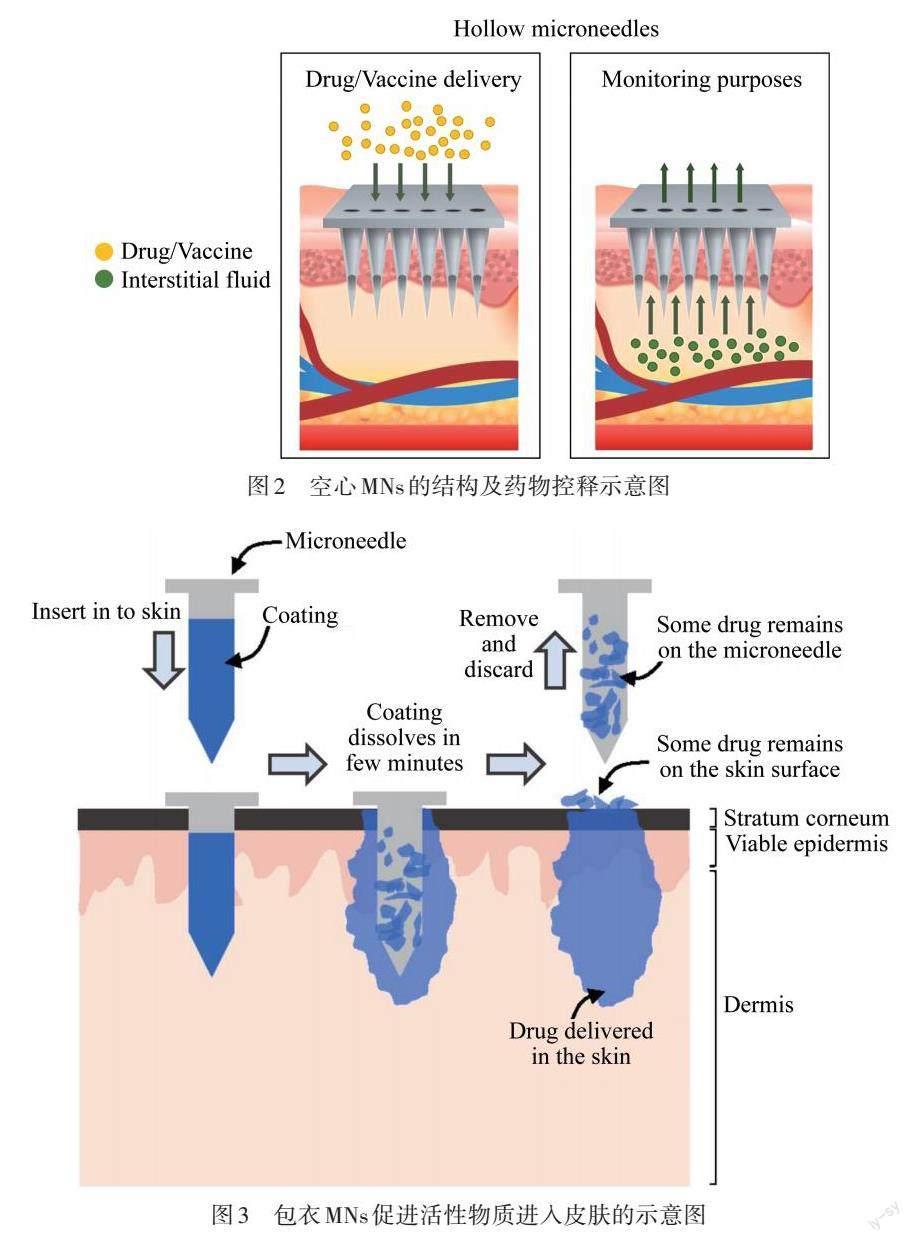
空心MNs通常由金属材料或无机材料等制成[21],类似于微米级的微型注射器. 如图2所示,针尖刺穿皮肤后,针腔内的药物在浓度梯度或外界压力的驱动下释放到人体内. 由于药物的输送依赖于MNs的流速,因此针头在插入时易被皮肤组织堵塞,且在压力较大的情况下MNs可能会断裂.

圖2 空心MNs的结构及药物控释示意图
4.3 包衣MNs
包衣MNs通常由金属或聚合物制成[22],将药物以固体薄膜的形式涂覆在MNs表面. 如图3所示,当涂有涂层的MNs插入皮肤时,几分钟内涂层就会溶解,之后MNs就可以被取出. 为了确保所需剂量的药物能够输送到体内,这些MNs通常被包裹在其他增稠剂或表面活性剂中. 包衣MNs使用的大多数化学物质为刺激物,存在局部炎症的风险.

图3 包衣MNs促进活性物质进入皮肤的示意图
4.4 溶解MNs
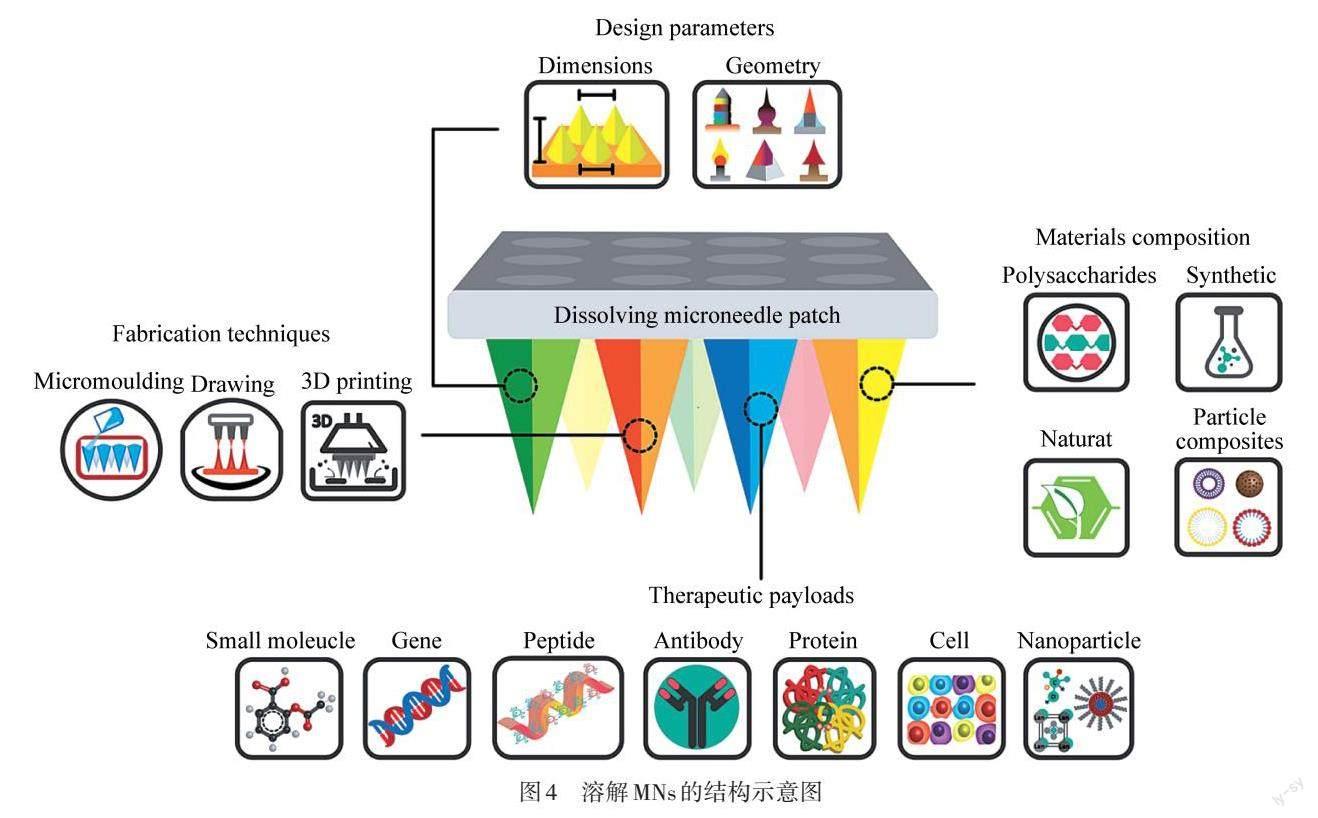
如图4所示,溶解MNs由含有药物的聚合物共混物制备[23],在刺入皮肤后,负载在其中的药物会随着材料的降解或溶胀逐步释放. 响应性MNs由生理响应性材料制得,能根据疾病的病理特征在如高血糖、酸性环境等特定生理条件下,或是在光、热等外界刺激下实现药物的可控释放,因其精准高效的释药性能近年来得到了广泛关注.

图4 溶解MNs的结构示意图
4.5 水凝胶MNs
水凝胶MNs是将聚合物形成水凝胶后再通过一定的方法注入微针模具制成的. 在有组织液存在的情况下,MNs能够膨胀传递药物而不溶解,因此,在药物完全释放后,它们可以从皮肤上分离出来. MNs贴片与光热治疗联用能够起到更好的治疗效果,WU等[24]开发了一种新型水凝胶MNs贴片,MNs内部包封了生物制剂单克隆抗体和碳化铌材料(MXene),如图5所示. 透明质酸(HA)水凝胶作为皮肤细胞外基质的主要成分,已被应用于制造MNs[25],具有无痛、无创、高效给药的优点,可以将药物输送到皮下组织并显著提高治疗效果. MXene是一种新兴的2D生物降解材料,具有优异的光热转换性能和优越的生物相容性[26]. 随着温度的变化,MXene水凝胶可以实现快速的膨胀、收缩和融化[27]. HA水凝胶具有网状结构,能够有效包裹IL-17单克隆抗体. MXene可以在近红外照射下提高MNs贴片局部温度,使MNs快速溶解,并在插入皮肤后释放IL-17单克隆抗体. 将装载IL-17单抗的MNs应用于病变部位,可以阻断IL-17及其下游受体与炎症通路的相互作用,从而减弱表皮增生以及炎症细胞因子的产生. MXene与MNs的集成是一种新型智能单克隆抗体释放系统,可以有效治疗银屑病.

图5 HA水凝胶MNs贴片治疗机理图及效果图
3 结 论
传统的银屑病治疗技术虽然有一定的治疗效果,但同时有一定的副作用,容易影响身体健康. 基于MNs的药物传递系统在相对低剂量的银屑病治疗中优于传统的局部治疗方法(凝胶,软膏和乳膏). 透皮MNs贴片对银屑病的治疗效果比口服药物更显著,因此MNs有可能克服当前治疗的复杂性,取代目前的治疗方法. 然而,MNs贴片也有一些缺点,比如药物负载量低,难以将MNs应用于耳朵、生殖器、头皮等区域. 为了克服药物负载量低的问题,建议使用低浓度的高效抗银屑病药物. 尽管许多研究已经探索了MNs将大分子输送到体循环中的潜力,但尚未有研究报道使用MNs系统输送抗银屑病生物制剂,并且需要在更能反映人类状况的先进银屑病临床前模型上进一步验证MNs的治疗效果. 相信随着科学技术的蓬勃发展以及研究的继续深入,这些治疗方案能够实现临床转化.
参考文献:
[1] RAPOSO I, TORRES T. Palmoplantar psoriasis and palmoplantar pustulosis: current treatment and future prospects [J]. American Journal of Clinical Dermatology, 2016,17:349-358.
[2] ALBANESI C, MADONNA S, GISONDI P, et al. The interplay between keratinocytes and immune cells in the pathogenesis of psoriasis [J]. Frontiers in Immunology, 2018,9:1549.
[3] MASON A R, MASON J M, CORK M J, et al. Topical treatments for chronic plaque psoriasis of the scalp: a systematic review [J]. British Journal of Dermatology, 2013,169(3):519-527.
[4] BALAK D M W, GERDES S, PARODI A, et al. Long-term safety of oral systemic therapies for psoriasis: a comprehensive review of the literature [J]. Dermatology and Therapy, 2020,10:589-613.
[5] BARREA L, SAVANELLI M C, DI SOMMA C, et al. Vitamin D and its role in psoriasis: an overview of the dermatologist and nutritionist [J]. Reviews in Endocrine and Metabolic Disorders, 2017,18:195-205.
[6] DATTOLA A, SILVESTRI M, BENNARDO L, et al. Update of calcineurin inhibitors to treat inverse psoriasis: a systematic review [J]. Dermatologic Therapy, 2018,31(6):e12728.
[7] DEVAUX S, CASTELA A, ARCHIER E, et al. Topical vitamin D analogues alone or in association with topical steroids for psoriasis: a systematic review [J]. Journal of the European Academy of Dermatology and Venereology, 2012,26(Suppl. 3):52-60.
[8] CASTELA E, ARCHIER E, DEVAUX S, et al. Topical corticosteroids in plaque psoriasis: a systematic review of efficacy and treatment modalities [J]. Journal of the European Academy of Dermatology and Venereology, 2012,26(Suppl. 3):36-46.
[9] PAUDEL K S, MILEWSKI M, SWADLEY C L, et al. Challenges and opportunities in dermal/transdermal delivery [J]. Therapeutic Delivery, 2010,1(1):109-131.
[10] WONG T, HSU L, LIAO W. Phototherapy in psoriasis: a review of mechanisms of action [J]. Journal of Cutaneous Medicine and Surgery, 2013,17(1):6-12.
[11] ARMSTRONG A W, READ C. Pathophysiology, clinical presentation, and treatment of psoriasis: a review [J]. JAMA, 2020,323(19):1945-1960.
[12] MAZA A, MONTAUDI? H, SBIDIAN E, et al. Oral cyclosporin in psoriasis: a systematic review on treatment modalities, risk of kidney toxicity and evidence for use in non-plaque psoriasis [J]. Journal of the European Academy of Dermatology and Venereology, 2011,25(Suppl. 2):19-27.
[13] ROENIGK H H, FOWLER-BERGFELD W, CURTIS G H. Methotrexate for psoriasis in weekly oral doses [J]. Archives of Dermatology, 1969,99(1):86-93.
[14] ATWAN A, INGRAM J R, ABBOTT R, et al. Oral fumaric acid esters for psoriasis [J]. Cochrane Database of Systematic Reviews, 2015(8). DOI: 10.1002/14651858.CD010497.pub2.
[15] DEL ROSSO J Q, KIRCIK L. Oral apremilast for the treatment of plaque psoriasis [J]. Journal of Clinical and Aesthetic Dermatology, 2016,9(9):43-48.
[16] ARMSTRONG A W, MEHTA M D, SCHUPP C W, et al. Psoriasis prevalence in adults in the United States [J]. JAMA Dermatology, 2021,157(8):940-946.
[17] BACHELEZ H. Interleukin 23 inhibitors for psoriasis: not just another number [J]. The Lancet, 2017,390(10091):208-210.
[18] TORRES T, PUIG L, VENDER R, et al. Drug survival of IL-12/23, IL-17 and IL-23 inhibitors for psoriasis treatment: a retrospective multi-country, multicentric cohort study [J]. American Journal of Clinical Dermatology, 2021,22(4):567-579.
[19] LIM D J, VINES J B, PARK H, et al. Microneedles: a versatile strategy for transdermal delivery of biological molecules [J]. International Journal of Biological Macromolecules, 2018,110:30-38.
[20] TARIQ N, ASHRAF M W, TAYYABA S. A review on solid microneedles for biomedical applications [J]. Journal of Pharmaceutical Innovation, 2022,17(4):1464-1483.
[21] C?RCAMO-MART?NEZ ?, MALLON B, DOM?NGUEZ-ROBLES J, et al. Hollow microneedles: a perspective in biomedical applications [J]. International Journal of Pharmaceutics, 2021,599:120455.
[22] ROHAN S J I, HARVINDER S G. Microneedle coating methods: a review with a perspective [J]. Journal of Pharmacology and Experimental Therapeutics, 2019,370(3):555-569.
[23] ALI M, NAMJOSHI S, BENSON H A E, et al. Dissolvable polymer microneedles for drug delivery and diagnostics [J]. Journal of Controlled Release, 2022,347:561-589.
[24] WU D, SHOU X, YU Y, et al. Biologics-loaded photothermally dissolvable hyaluronic acid microneedle patch for psoriasis treatment [J]. Advanced Functional Materials, 2022,32(47):2205847.
[25] YAO S, CHI J, WANG Y, et al. Zn-MOF Encapsulated antibacterial and degradable microneedles array for promoting wound healing [J]. Advanced Healthcare Materials, 2021,10(12):2100056.
[26] JAMIL F, ALI H M, JANJUA M M. MXene based advanced materials for thermal energy storage: a recent review [J]. Journal of Energy Storage, 2021,35:102322.
[27] YANG X, ZHANG C, DENG D, et al. Multiple stimuli-responsive mxene-based hydrogel as intelligent drug delivery carriers for deep chronic wound healing [J]. Small, 2021,18(5):2104368.
(責任编辑:郁慧,顾浩然)

