硼基复合材料在肿瘤诊疗中的研究进展
成语彤 田启威 杨仕平
DOI: 10.3969/J.ISSN.1000-5137.2024.01.011
收稿日期: 2023-08-09
基金项目: 国家自然科学基金重大研究计划培育项目(91959105)
作者简介: 成语彤(1999—), 女, 硕士研究生, 主要从事无机纳米材料用于癌症诊疗等方面的研究. E-mail: chengyt139@163.com
* 通信作者: 田启威(1983—), 男, 教授, 主要从事智能生物材料的开发及其在生物领域的应用等方面的研究. E-mail:tianqw@sumhs.edu.cn; 杨仕平(1969—), 男, 教授, 主要从事磁共振成像造影剂及其应用等方面的研究. E-mail:shipingy@shnu.edu.cn
引用格式: 成语彤, 田启威, 杨仕平. 硼基复合材料在肿瘤诊疗中的研究进展 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):81?88.
Citation format: CHENG Y T, TIAN Q W, YANG S P. Progress in boron-based compounds for tumor diagnosis and treatment [J]. Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):81?88.
摘 要: 在世界卫生组织(WHO)宣布硼(B)是人类“可能的必需元素”之后,硼基复合材料成为生物医学领域新的研究热点. 研究结果表明:硼及其衍生物在多方面呈现抗癌特性,包括放射性治疗、聯合治疗、调节细胞信号表达和生化过程等. 此外,美国食品药品监督管理局(FDA)批准的5种含硼药物极大地影响了硼及其衍生物在药物化学、化学生物学、药物输送、生物材料探索、药理改进和营养方面的应用. 文章综述了多种类型的硼基材料以及它们在制药和肿瘤治疗方面的潜在应用,有助于含硼化合物的进一步开拓和创新.
关键词: 硼化学; 硼中子俘获疗法(BNCT); 金属-硼复合材料; 肿瘤治疗
中图分类号: TB 333; R 730.5 文献标志码: A 文章编号: 1000-5137(2024)01-0081-08
Abstract: After the World Health Organization (WHO) declared that boron (B) is a “possible essential element” for human beings, boron-based composites have become a new research hotspot in the biomedical field. The results show that boron and its derivatives exhibit anticancer properties in many directions, including radiotherapy, combined therapy, regulation of cell signal expression, and biochemical processes. In addition, five boron-containing drugs approved by Food and Drug Administration(FDA) in the United States have greatly affected the application of boron and its derivatives in medicinal chemistry, chemical biology, drug delivery, biomaterial exploration, pharmacological improvement, and nutrition. In this paper, various types of boron-based materials and their potential applications in pharmacy and tumor treatment are reviewed in order to contribute to the further development and innovation of boron-containing compounds.
Key words: boron chemistry; boron neutron capture therapy(BNCT); metal-boron composites; tumor therapy
0 引 言
硼(B)作为一种重要的微量元素,在维持机体结构完整性、控制活性氧(ROS)等方面起着至关重要的作用[1]. 在哺乳动物体内,硼主要以硼酸盐的形式发挥功能,参与生长发育、能量利用、免疫调节等过程,能够维持骨骼健康、大脑功能和降低癌症风险. 此外,硼补充剂通过抑制一种使维生素D代谢失活的酶来弥补维生素D缺乏. 一项关于大鼠的实验表明,硼酸(BA)致死剂量(2 660 mg·kg-1)与食盐的致死剂量(3 000 mg·kg-1)相当[1-2],这些数据共同反映了硼元素在生命系统中的重要性.
硼及其化合物可作为多种蛋白酶抑制剂,发挥抗凝血、抗细菌、抗真菌、抗病毒、抗肿瘤、调节激素等作用[3]. 如具有1,4-萘醌的拟肽硼酸盐或BA衍生物,作为蛋白酶抑制剂,实现对多种实体癌细胞增殖的抑制作用[4-5],而在一项大鼠肝癌细胞实验中发现,硼能够部分逆转肝细胞损伤,调节超氧化物歧化酶(SOD)阈值以改善氧化应激条件下的抗氧化防御机制,提高肿瘤坏死因子(TNF)和血清干扰素γ的表达,进而负向诱导肝癌细胞的分裂增殖[6]. 另外,在肿瘤治疗方面,硼中子俘获疗法(BNCT)以其双靶向性、无创治疗、低毒高效的优势受到了广泛关注,成为恶性脑胶质瘤、头颈部复发性肿瘤和皮肤黑色素瘤等疾病的一种有效的治疗方法[7-8]. 这些研究结果表明:含硼化合物在医学应用和生物有机化学方面具有巨大的潜力. 硼不是解决所有医学问题的关键,但它将是药物化学工具箱中一个重要的补充. 近年来已经有很多文献报道了硼化学及其应用的进展[9-10],本文综述了多种类型的硼基材料,以及它們分别在制药和肿瘤治疗方面的潜在应用,有助于含硼化合物的进一步研究和创新.
1 硼及其衍生药物
硼化合物包括金属硼酸盐、BA、氧化硼和硼酸酯. 人类通常以BA或硼酸盐的形式接触硼,大多数摄入的硼化合物被水解,并以BA的形式存在于血液、尿液和其他生物体液中,对人体神经系统、内分泌系统、钙和维生素D代谢、骨骼发育、肝脏代谢等生理活动有优化作用[11]. 同时,BA暴露在前列腺、黑色素瘤、乳腺癌细胞系中,可抑制细胞增殖并刺激细胞凋亡[12-13]. TNF信号通路是重要的肿瘤抑制基因,BA激活并上调B淋巴细胞瘤-2(BCL-2)基因群、B淋巴细胞瘤-2基因相关启动子(BAD)、TNF和肿瘤坏死因子配体超家族成员(8TNFSF8)的基因表达水平,从而启动TNF信号通路介导的细胞凋亡机制,诱导SW-480细胞凋亡[13]. 此外,高浓度BA会导致细胞内谷胱甘肽(GSH)水平、过氧化氢酶(CAT)活性和SOD活性显著降低,脂质氧化水平(MDA)和总氧化状态(TOS)显著升高,轻微诱导细胞发生氧化应激[14-15].
1.1 硼基药物
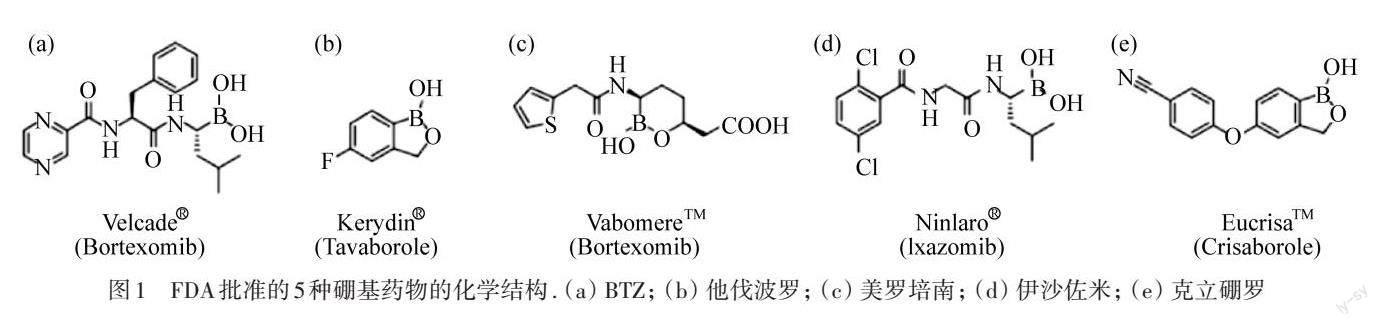
BA是目前应用最广泛的含硼化合物,是一种温和而稳定的路易斯酸,由2个可交换的羟基组成,这种与合适的目标分子形成共价键的可逆性为BA的多种应用奠定了基础[16]. 在过去的20年中,美国食品药品监督管理局(FDA)批准了5种硼基药物,包括硼替佐米(bortezomib 2003,BTZ)、他伐硼罗(tavaborole 2014)、伊沙佐米(ixazomib 2015)、克立硼罗(crisaborole 2016)和美罗培南(vaborbactam 2017),如图1所示[2]. BTZ是首个用于治疗多发性骨髓瘤的蛋白酶体抑制剂[17-18],通过与26S蛋白酶体的氨基酸残基结合,阻止癌细胞中促凋亡蛋白的降解,进而导致癌细胞周期停滞和凋亡,在多发性骨髓瘤的治疗中具有不可替代的作用. 伊沙佐米被批准为治疗骨髓瘤的第二代口服可逆蛋白酶体抑制剂,其抑制机制与BTZ类似,通过结合并抑制20S蛋白酶体的β5亚基而发挥作用,与来那度胺和地塞米松联合用于治疗至少接受过一种治疗的多发性骨髓瘤患者[19]. 他伐硼罗是首个基于硼的抗真菌药物,通过与细胞质亮氨酰胺酰基转移RNA(tRNA)合成酶形成双齿加合物来阻止细胞蛋白质合成,发挥其抗真菌活性[20]. 克立硼罗是治疗轻度至中度特应性皮炎的药物,其结构中包含的一个硼原子,有助于渗透皮肤,并与抑制磷酸二酯酶4 (PDE4)来停止炎症反应[2]. 美罗培南是基于环状BA药效团的β-内酰胺酶抑制剂,用作催化丝氨酸的可逆共价调节剂,体现了硼化合物抗菌活性,用于治疗患有复杂尿路感染的成年患者[17]. 因此,硼化学在制药研究领域获得了巨大的进展.

图1 FDA批准的5种硼基药物的化学结构. (a) BTZ; (b) 他伐波罗; (c) 美罗培南; (d) 伊沙佐米; (e) 克立硼罗
1.2 硼基药物的作用机制
有研究者报道,硼的化合物可作为多种蛋白酶抑制剂,发挥抗凝血、抗细菌、抗真菌、抗病毒、抗肿瘤、调节激素等多种作用[3]. 以BA为结构的选择性肽类化合物,作为蛋白酶抑制剂,对60种人肿瘤细胞株生长具有抑制作用[2]. 其中,BTZ作为第一种含硼蛋白酶体抑制剂,具有显著的抗肿瘤活性,在临床与科研中被广泛使用,常用于治疗血液系统恶性肿瘤,特别是多发性骨髓瘤和一些实体瘤[21].
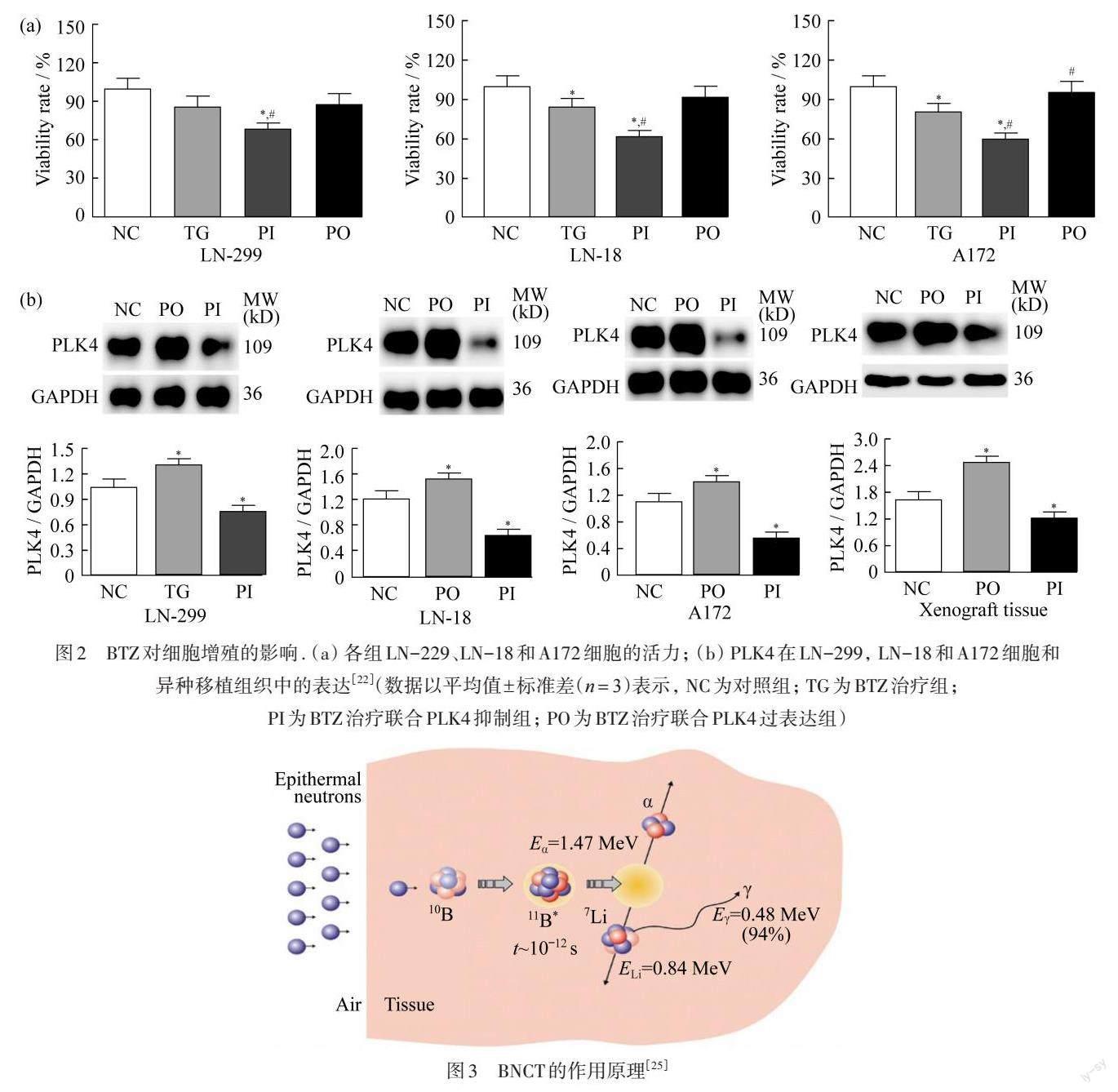
WANG等[22]将BTZ和 Polo样丝氨酸/苏氨酸蛋白激酶(PLK)抑制剂联合,用来治疗胶质母细胞瘤(GBM). 研究者在LN-18,A172和LN-229细胞中建立了PLK4敲低和过表达的细胞模型,发现敲低PLK4表达可增强BTZ的抗肿瘤作用. 如图2所示,通过Western Blot实验进一步验证,这种作用可能是由PTEN/PI3K/AKT/mTOR信号通路介导的[22]. 在BTZ处理后,细胞凋亡和氧化应激过程被激活,而基质金属蛋白酶(MMPs)的表达下调,导致肿瘤微环境的重新配置,从而抑制肿瘤细胞的增殖. 在体外活体实验中也观察到类似的现象. 为了验证这些效应不是由PLK4缺失或过表达单独引起的,研究者在没有BTZ治疗的胶质瘤细胞上进行了关键实验,发现所有实验组都没有明显变化. 研究表明,抑制PLK4增强BTZ可能是GBM的一种新的治疗策略.

图2 BTZ对细胞增殖的影响. (a) 各组LN-229、LN-18和A172细胞的活力; (b) PLK4在LN-299, LN-18和A172细胞和异种移植组织中的表达[22](数据以平均值![]() 标准差(
标准差(![]() )表示, NC为对照组; TG为BTZ治療组;PI为BTZ治疗联合PLK4抑制组; PO为BTZ治疗联合PLK4过表达组)
)表示, NC为对照组; TG为BTZ治療组;PI为BTZ治疗联合PLK4抑制组; PO为BTZ治疗联合PLK4过表达组)
BA作为目前最广泛应用的含硼化合物,其重要特性支持其在一些肿瘤治疗中表现出蛋白酶抑制剂的作用,例如前列腺癌、乳腺癌、结肠癌和肝癌等[23]. KAHRAMAN等[23]提出BA能以剂量和时间依赖性的方式降低肝癌细胞系的存活率、集落形成能力、迁移能力,诱导细胞凋亡、自噬和形态改变. PI3K/AKT通路是参与细胞凋亡和存活的重要细胞信号传导途径,活化AKT水平的升高诱导细胞周期的进展、细胞凋亡的抵抗和信号转导的启动,进而导致致癌转化. 因此,AKT通路是抑制癌性转化所必需的信号转导通路. BA处理可以抑制HCC细胞系中AKT的磷酸化,通过抑制AKT信号通路诱导HCC细胞株凋亡,并且仅在AKT磷酸化被BA抑制的细胞中观察到肝癌细胞的抗癌生物学反应.
此外,对人类结肠癌,BA同样具有诱导癌细胞凋亡的作用. SEVIMLI等[13]设置了单层(二维)和球形(三维)培养条件,经BrdU细胞周期分析发现,BA在2种条件下都导致细胞周期阻滞,并抑制细胞的增殖. 通过qRt-PCR研究发现,SW-480细胞的凋亡过程与TNF信号通路有关. BA在二维培养中上调BAD,BCL2L10(BCL-B),BCL2L11(BIM),HTRA2,TNF和TNFSF8基因的表达,在三维培养中上调MCL1,REL,TNFRSF10A基因的表达. 并且线粒体凋亡途径在这一过程中也十分活跃,BA可作为结肠癌治疗的潜在抗癌药物,进行更深入的研究.
2 BNCT
硼基化合物应用的进步主要始于BNCT,用于癌症治疗[10]. BNCT是一种放射疗法,基于核俘获和裂变反应的二元治疗方式,当稳定的同位素10B被中子照射时,会产生高能α粒子和后坐性7Li原子核,如图3所示. α粒子的破坏作用仅限于含硼细胞,由于它们在组织中的路径长度非常短(5~9 μm),理论上BNCT提供了一种选择性破坏恶性细胞和保留周围正常组织的方法,使其成为理想的放射治疗类型[24]. 理想的含硼剂应满足以下要求:(1) 全身毒性低;(2) 肿瘤中10B的质量分数约为30 ?g·g-1;(3) 肿瘤摄取高,正常组织摄取低;(4) 在BNCT期间,正常组织快速清除,但肿瘤组织持续存在[10].

图3 BNCT的作用原理[25]
2.1 用于临床的BNCT试剂
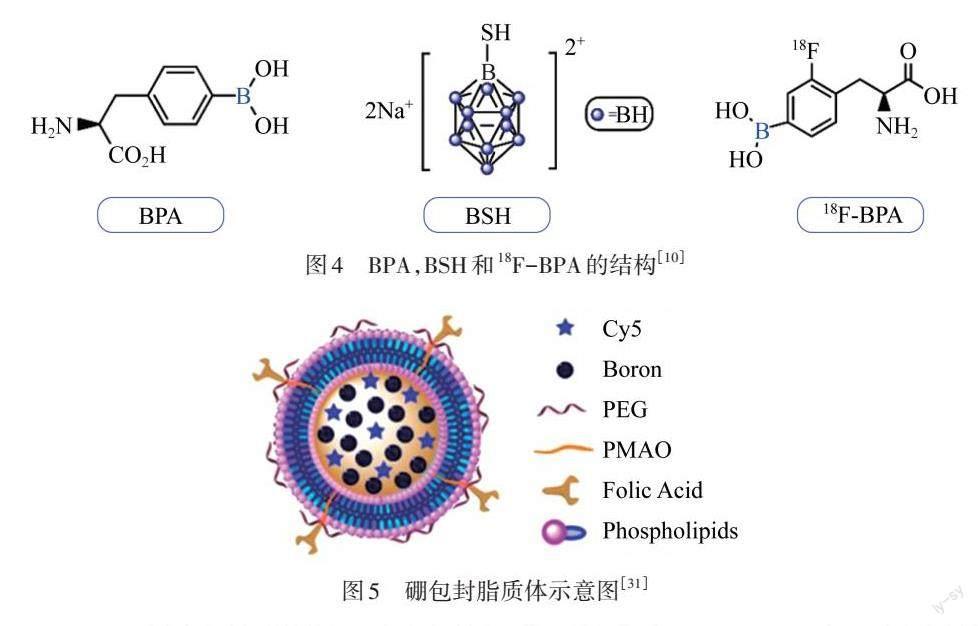
为了使BNCT产生效果,必须使足够的硼到达肿瘤细胞. 已有2种药物被用作硼递送剂用于临床治疗,即巯基十氢十硼烷(BSH)和硼苯丙氨酸(BPA)[7],其结构如图4所示. 然而,在高级别胶质瘤患者的输送系统中,BPA,BSH或两者结合的理想剂量尚未确定,HOPEWELL等[26]尝试了延长BPA的输注时间以期获得更好的效果. 然而,由于BSH和BPA的硼转移能力较差,BNCT在临床应用中受到一定阻碍[27],研究者们将正电子发射断层扫描(PET)与BNCT结合,利用双模态剂来解决这一问题,对患者肿瘤内的硼积累实时监测[10]. 4-硼-2-18F-氟苯丙氨酸(18F-BPA)是双模态BNCT剂的应用,它是BPA的放射性标记衍生物,如图4所示. 头颈部癌症对18F-BPA的摄取与对18F-氟脱氧葡萄糖的摄取相关[28]. 18F-BPA也被报道用于多种类型的肿瘤,如恶性黑色素瘤、恶性胶质瘤等各种头颈癌[28].

图4 BPA,BSH和18F-BPA的结构[10]
2.2 新型BNCT药物的开发
近年来,研究人员对许多基于小分子硼基化合物的硼载体进行了临床前的实验,然而,由于其在肿瘤细胞中的硼积累不足,临床研究受到限制[29]. 研究人员试图通过开发含硼纳米颗粒来解决这些问题,一些新开发的含硼纳米颗粒显著提高了硼对肿瘤细胞的递送效率,可以将至少2×10-5的硼输送到肿瘤细胞中[10],并且具有更好的选择靶向性,在动物模型中表现出良好的肿瘤破坏作用.
纯硼纳米颗粒中含有大量的硼,被认为是潜在的、有应用价值的硼载体,常用的合成方法包括热解、化学气相沉积(CVD)、热等离子体、溶液还原、球磨和电弧放电等[30]. SINGH等[31]采用油包水乳化法合成纯硼纳米颗粒,其表面含有聚乙二醇(PEG)和聚马来酸酐-1-十八烯(PMAO),包裹着硼纳米颗粒(3PCB)和Cy5近红外荧光染料,如图5所示. 为了改善硼在癌细胞中的积累和靶向递送,将肿瘤特异性靶向配体叶酸(FA)偶联到PEG上,产生FA功能化脂质体(FA-3PCB). 通过荧光显微镜监测细胞摄取,证实了FA偶联脂质体的靶向能力. 电感耦合等离子体质谱(ICP-MS)定量证实了硼在癌细胞中积累到足够的浓度,能获得治疗效果. 这些脂质体在生理条件下具有血脑屏障(BBB)穿越能力,以及良好的稳定性和低的细胞毒性,被认为是BNCT的新型替代剂.

图5 硼包封脂质体示意图[31]
另一种广泛使用的含硼纳米材料氮化硼纳米颗粒(BNNPs)/纳米管(BNNTs)是碳材料的结构类似物,其中碳原子被硼原子和氮原子交替取代[29]. BNNPs是可降解的,比其碳对应物有更好的生物相容性和更低的细胞毒性,并且由于硼含量高,其被认为是BNCT硼输送剂的可靠选择. ZHANG等[32]报道了用聚甘油接枝的10 nm以下富含硼的纳米颗粒(h-10BN-PG),用于通过BNCT将硼高效输送到肿瘤中,以根除肿瘤. h-10BN-PG纳米颗粒具有合适的粒径和较高的隐身效率,可延长小鼠CT26结肠肿瘤的血液循环时间,瘤内10B质量分数高达102.1 μg·g-1. 由于硼能有效地传递到肿瘤中,BNCT包括单次注射h-10BN-PG纳米颗粒和随后的一次性中子照射,几乎可以根除皮下CT26肿瘤. 就其机制而言,肿瘤组织中的炎症免疫反应除了对肿瘤细胞的DNA直接损伤外,还对肿瘤抑制起着非常关键的持续性作用.
3 硼基-金属复合材料
大量临床前和临床研究表明:由于癌症患者个体差异和癌细胞耐药程度不同,单药治疗效果有限,难以完全根除恶性肿瘤. 在此基础上,多种方式联合疗法能产生协同效应,并显示出更加优秀的治疗效果[10]. 研究者试图将BNCT与光热疗法(PTT)结合,制备出一些硼金复合材料[29]. PULAGAM等[33]报道了同时用PEG和富硼阴离子钴二(二羰基)功能化的金纳米粒子,用124I放射性标记,并进行正电子发射断层扫描. ICTEN [34]进行的另一项研究涉及制备碳硼烷氨基衍生物的金纳米团簇的自组装,用于肿瘤细胞靶向成像. 基于上述各点,这些设计的材料可以作为BNCT和PTT的候选材料.
金属硼酸盐具有多种化学结构,如磷酸盐和硅酸盐,并且可以由廉价的氧化物材料制备. 此外,这些金属硼酸盐具有不同的结构,如沃里克矿、诺伯矿和方解石,都含有三角形或四方硼单元[35]. 硼酸铁是目前研究较多的硼酸盐类型,其通式为Fe2+Fe3+OBO3,Fe2+Fe3+O2BO3,Fe33+O3BO3和Fe3+BO3. 一般来说,二价铁离子和三价铁离子位于氧配位三角形(FeO6)的八面体边缘中心,硼离子位于氧配位三角形的中心,每个角都是不同八面体的角[36]. 硼酸盐结构因其溶解性、生物半衰期短、生物相容性和根据应用可调性而受到人们的关注. ICTEN[34]合成了不同形貌的硼酸铁(Fe3BO6和FeBO3),并在这些硼酸铁表面涂覆聚多巴胺(PDA),以提高其在水介质中的溶解度和生物相容性. 然后,在硼酸铁表面沉积金纳米粒子,并在808 nm近红外激光下研究了金修饰和钯包覆的硼酸铁(Fe3BO6@PDA-Au和FeBO3@PDA-Au)的光热性能,如图6所示. 900 s辐照后,Fe3BO6@PDA-Au和FeBO3@PDA-Au纳米粒子的分散体温度分别达到45.8 ℃和43.2 ℃. 此外,計算出其中每毫克纳米粒子的硼原子数量分别为1.23×1018和2.79×1018,由于其硼含量充分,可用于PTT和BNCT联合治疗.

图6 Fe3BO6@PDA-Au和FeBO3@PDA-Au的合成路线示意图[34]
4 总结与展望
FDA批准的5种含硼化合物临床应用让研究者们将目光投向了探索更多硼基化合物的抗癌疗法,寻找靶向肿瘤的新型硼基纳米药物成为生物医学领域的热点. 硼基纳米药物在肿瘤治疗中的基本作用以及对癌症患者生理环境中蛋白酶的调节已在临床前和临床实验中得到充分证明. 作为一个新兴的研究热点,硼基纳米药物作为抗癌药物和肿瘤造影剂的开发取得了重大进展. 基于稳定的同位素10B被中子照射后的能量反应,BNCT提供了一种选择性破坏恶性细胞和保留周围正常组织的方法. 利用10B的放射性,硼基材料能够兼具治疗剂和造影剂的功能. 同时,由于硼基材料其亲和性、优秀的配位能力,以及能够与金属原子配位,将PTT和BNCT结合,能发挥“1+1>2”的效果[10]. 此外,许多硼基化合物,例如BTZ和BA,本身就是优秀的蛋白酶体抑制剂,具有显著的抗肿瘤活性. 随着纳米技术、硼化学等的发展,将有更多的硼基药物被开发出来,硼基化合物材料在肿瘤治疗方面的应用也将在以下几个主要方面得到进一步的提高和发展:
(1) 合成更有效的含硼药物,使其能单独使用或与其他药物联合使用,向癌细胞输送所需量的硼.
(2) 优化含硼剂对癌细胞的递送和细胞微分布,以促使其吸收,特别是对不同亚群的癌细胞.
(3) 与靶向剂偶联,对残留癌细胞中硼含量进行半定量估计方法.
(4) 对于硼药的安全性和有效性,需要经过随机临床试验.
参考文献:
[1] INCE S, KUCUKKURT I, CIGERCI I H, et al. The effects of dietary boric acid and borax supplementation on lipid peroxidation, antioxidant activity, and DNA damage in rats [J]. Journal of Trace Elements in Medicine and Biology, 2010,24(3):161-164.
[2] CHATTERJEE S, TRIPATHI N M, BANDYOPADHYAY A. The modern role of boron as a “magic element” in biomedical science: chemistry perspective [J]. Chemical Communications, 2021,57(100):13629-13640.
[3] LESNIKOWSKI Z J. Challenges and opportunities for the application of Boron clusters in drug design [J]. Journal of Medicinal Chemistry, 2016,59(17):7738-7758.
[4] LIU H, WU J, GE Y, et al. Novel aromatic sulfonyl naphthalene-based boronates as 20S proteasome inhibitors [J]. Bioorganic & Medicinal Chemistry, 2018,26(5):1050-1061.
[5] GE Y, LI A, WU J, et al. Design, synthesis and biological evaluation of novel non-peptide boronic acid derivatives as proteasome inhibitors [J]. European Journal of Medicinal Chemistry, 2017,128:180-191.
[6] BHASKER T V, GOWDA N K, MONDAL S, et al. Boron influences immune and antioxidant responses by modulating hepatic superoxide dismutase activity under calcium deficit abiotic stress in Wistar rats [J]. Journal of Trace Elements in Medicine and Biology, 2016,36:73-79.
[7] BARTH R F, ZHANG Z, LIU T. A realistic appraisal of boron neutron capture therapy as a cancer treatment modality [J]. Cancer Communications, 2018,38(1):36.
[8] HIRATSUKA J, KAMITANI N, TANAKA R, et al. Boron neutron capture therapy for vulvar melanoma and genital extramammary Pagets disease with curative responses [J]. Cancer Communications, 2018,38(1):38.
[9] QIAN E A, WIXTROM A I, AXTELL J C, et al. Atomically precise organomimetic cluster nanomolecules assembled via perfluoroaryl-thiol SNAr chemistry [J]. Nature Chemistry, 2017,9(4):333-340.
[10] ALI F S, HOSMANE N, ZHU Y. Boron chemistry for medical applications [J]. Molecules, 2020,25(4):828-852.
[11] YILMAZ SARIALTIN S, USTUNDAG A, MHLANGA CHINHEYA R, et al. Cytotoxicity, genotoxicity, oxidative stress, apoptosis, and cell cycle arrest in human Sertoli cells exposed to boric acid [J]. Journal of Trace Elements in Medicine and Biology, 2022,70:126913.
[12] GALLARDO-WILLIAMS M T, CHAPIN R E, KING P E, et al. Boron supplementation inhibits the growth and local expression of IGF-1 in human prostate adenocarcinoma (LNCaP) tumors in nude mice [J]. Toxicologic Pathology, 2004,32(1):73-78.
[13] SEVIMLI M, BAYRAM D, OZGOCMEN M, et al. Boric acid suppresses cell proliferation by TNF signaling pathway mediated apoptosis in SW-480 human colon cancer line [J]. Journal of Trace Elements in Medicine and Biology, 2022, 71:126958.
[14] YALCIN C O, ABUDAYYAK M. Effects of boric acid on cell death and oxidative stress of mouse TM3 Leydig cells in vitro [J]. Journal of Trace Elements in Medicine and Biology, 2020,61:126506.
[15] HACIOGLU C, KAR F, KACAR S, et al. High concentrations of Boric acid trigger concentration-dependent oxidative stress, apoptotic pathways and morphological alterations in DU-145 human prostate cancer cell line [J]. Biological Trace Element Research, 2020,193(2):400-409.
[16] GROLEAU R R, JAMES T D, BULL S D. The Bull-James assembly: efficient iminoboronate complex formation for chiral derivatization and supramolecular assembly [J]. Coordination Chemistry Reviews, 2021,428:213599.
[17] FERNANDES G F S, DENNY W A, DOS SANTOS J L. Boron in drug design: recent advances in the development of new therapeutic agents [J]. European Journal of Medicinal Chemistry, 2019,179:791-804.
[18] TRIPPIER P C, MCGUIGAN C. Boronic acids in medicinal chemistry: anticancer, antibacterial and antiviral applications [J]. RSC Medicinal Chemistry, 2010,1(3):183-198.
[19] SHIRLEY M. Ixazomib: first global approval [J]. Drugs, 2016,76(3):405-411.
[20] MARKINSON B, GHANNOUM M, WINTER T, et al. Examining the benefits of the Boron-based mechanism of action and physicochemical properties of tavaborole in the treatment of onychomycosis [J]. Journal of the American Podiatric Medical Association, 2018,108(1):12-19.
[21] TSUBAKI M, TAKEDA T, MATSUDA T, et al. Activation of serum/glucocorticoid regulated kinase 1/nuclear factor-kappa B pathway are correlated with low sensitivity to bortezomib and ixazomib in resistant multiple myeloma cells [J]. Biomedicines, 2021,9(1):33.
[22] WANG J, REN D, SUN Y, et al. Inhibition of PLK4 might enhance the anti-tumour effect of bortezomib on glioblastoma via PTEN/PI3K/AKT/mTOR signalling pathway [J]. Journal of Cellular and Molecular Medicine, 2020,24(7):3931-3947.
[23] KAHRAMAN E, GOKER E. Boric acid exert anti-cancer effect in poorly differentiated hepatocellular carcinoma cells via inhibition of AKT signaling pathway [J]. Journal of Trace Elements in Medicine and Biology, 2022,73:127043.
[24] BARTH R F, CODERRE J A, VICENTE M G H, et al. Boron neutron capture therapy of cancer: current status and future prospects [J]. Clinical Cancer Research, 2005,11(11):3987-4002.
[25] DYMOVA M A, TASKAEV S Y, RICHTER V A, et al. Boron neutron capture therapy: current status and future perspectives [J]. Cancer Communications, 2020,40(9):406-421.
[26] HOPEWELL J W, GORLIA T, PELLETTIERI L, et al. Boron neutron capture therapy for newly diagnosed glioblastoma multiforme: an assessment of clinical potential [J]. Applied Radiation and Isotopes, 2011,69(12):1737-1740.
[27] OLID D, N??EZ R, VI?AS C, et al. Methods to produce B─C, B─P, B─N and B─S bonds in boron clusters [J]. Chemical Society Reviews, 2013,42(8):3318-3336.
[28] TANI H, KURIHARA H, HIROI K, et al. Correlation of 18F-BPA and 18F-FDG uptake in head and neck cancers [J]. Radiotherapy and Oncology, 2014,113(2):193-197.
[29] LI L, LI J, SHI Y, et al. On-demand biodegradable Boron nitride nanoparticles for treating triple negative breast cancer with Boron neutron capture therapy [J]. ACS Nano, 2019,13(12):13843-13852.
[30] ZHU Y, HOSMANE N S. Nanostructured Boron compounds for cancer therapy [J]. Pure and Applied Chemistry, 2018, 90(4):653-663.
[31] SINGH A, KIM B K, MACKEYEV Y, et al. Boron-nanoparticle-loaded folic-acid-functionalized liposomes to achieve optimum Boron concentration for Boron neutron capture therapy of cancer [J]. Journal of Biomedical Nanotechnology, 2019,15(8):1714-1723.
[32] ZHANG Y, KANG H G, XU H Z, et al. Tumor eradication by Boron neutron capture therapy with 10B‐enriched hexagonal Boron nitride nanoparticles grafted with poly(glycerol) [J]. Advanced Materials, 2023,35(35):2301479.
[33] PULAGAM K R, GONA K B, GOMEZ-VALLEJO V, et al. Gold Nanoparticles as Boron carriers for Boron neutron capture therapy: synthesis, radiolabelling and in vivo evaluation [J]. Molecules, 2019,24(19):3609.
[34] ICTEN O. The design of gold decorated iron borates (Fe3BO6and FeBO3) for photothermal therapy and Boron carriers [J]. European Journal of Inorganic Chemistry, 2021,2021(21):1985-1992.
[35] ATTFIELD J P, BELL A M T, RODRIGUEZ-MARTINEZ L M, et al. Electrostatically driven charge-ordering in Fe2OBO3 [J]. Nature, 1998,396(6712):655-658.
[36] YAGUPOV S, STRUGATSKY M, SELEZNYOVA K, et al. Development of a synthesis technique and characterization of high-quality iron borate FeBO3 single crystals for applications in synchrotron technologies of a new generation [J]. Crystal Growth and Design, 2018,18(12):7435-7440.
(責任编辑:郁慧,包震宇)

