RNA切割型脱氧核酶在生物医学领域中的研究进展
郑洪 成雨纯 陈楠

DOI: 10.3969/J.ISSN.1000-5137.2024.01.017
收稿日期: 2023-11-01
基金项目: 国家自然科学基金(21974089)
作者简介: 郑 洪(2000—), 女, 硕士研究生, 主要从事核酸纳米复合材料在RNA调控等方面的研究. E-mail:1838460180@qq.com
* 通信作者: 陈 楠(1979—), 女, 研究员, 主要从事纳米生物效应、 纳米荧光探针及纳米药物等方面的研究. E-mail:Nchen@shnu.edu.cn
引用格式: 郑洪, 成雨纯, 陈楠. RNA切割型脱氧核酶在生物医学领域中的研究进展 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):129?136.
Citation format: ZHENG H, CHENG Y C, CHEN N. Advances in RNA-cleaving DNAzyme for biomedical field [J].Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):129?136.
摘 要: RNA切割型脱氧核酶(RCD)是一类具有催化活性的单链DNA分子,具有灵活的可编程性、优异的稳定性、强底物特异性和高催化活性等优点,因而在生物医学领域展现出了良好的应用前景. 基于RCD对于特定辅助因子的依赖和对于靶标RNA的特异性识别和切割,其被广泛应用于一系列生物分子靶标的检测以及多种临床疾病的基因治疗. 文章介绍了RCD的物理化学特性,并对其在生物医学领域的研究现状进行了总结,聚焦于RCD在生物传感和癌症治疗等方面的应用进展. 此外,还对该领域面临的挑战及未来的发展方向进行了讨论.
关键词: RNA切割型脱氧核酶(RCD); 核酸纳米复合物; 生物传感; 癌症治疗
中图分类号: Q 786 文献标志码: A 文章编号: 1000-5137(2024)01-0129-08
Abstract: RNA-cleaving DNAzyme(RCD) is a type of single-stranded DNA with catalytic activity, which has many advantages such as flexible programmability, excellent stability, strong substrate specificity, and high catalytic activity. Therefore, it has shown potential application in the field of biomedicine. Because of its selectivity on specific cofactors and recognition and cleavage of target RNAs, RCD is widely used in the detection of a range of biological molecules and gene therapy for various clinical diseases. This review introduces the physicochemical properties of RCD, summarizes its current research status in the biomedical field, and focuses on the application progress of RCD in biosensing and cancer treatment. In addition, the challenges and future development in this field are discussed.
Key words: RNA-cleaving DNAzyme(RCD); nucleic acid nanocomposites; biosensing; cancer treatment
0 引 言
脫氧核酶(DNAzyme)是通过特定的指数富集配基系统进化筛选技术(SELEX)获得的一类具有酶活性的单链DNA分子,能够在辅助因子的作用下发挥特定的催化功能[1-2]. 1994年,BREAKER等[3]等首次在铅离子(Pb2+)存在的条件下,筛选得到了一种具有RNA裂解能力的单链DNAzyme. 此后,越来越多具有不同结构和功能的DNAzyme被报道. 根据功能的不同,可以将DNAzyme大致分为七类:(1) 具有RNA切割活性的脱氧核酶(RCD);(2) 具有DNA连接酶活性的DNAzyme;(3) 具有卟啉金属化酶和过氧化酶活性的DNAzyme;(4) 具有DNA水解活性的DNAzyme;(5) 具有DNA激酶活性的DNAzyme;(6) 具有N糖基化酶活性的DNAzyme;(7) 具有DNA戴帽活性的DNAzyme[4]. 其中,针对RCD的研究和应用最为广泛和成熟. RCD具有特异性的辅助因子依赖性和强大的催化能力,通过整合多种信号转导和放大机制,可以将其广泛用于金属离子、代谢物以及生物大分子的高灵敏度和特异性检测. 此外,可以通过设计底物结合臂来构建靶向特定RNA的RCD,选择性地切割病毒RNA或疾病相关基因的RNA,调节相应蛋白的表达,达到治疗目的. 与其他基因治疗工具相比,RCD具有成本低廉、设计灵活、稳定性高、底物特异性好以及高效的RNA切割能力等诸多优势,在病毒分析和癌症临床治疗中均展示出了强大的应用潜力[1]. 本文对RCD的物理化学特性进行了介绍,并总结了目前RCD在生物传感和癌症治疗方面的研究进展.
1 RCD的物理化学特性
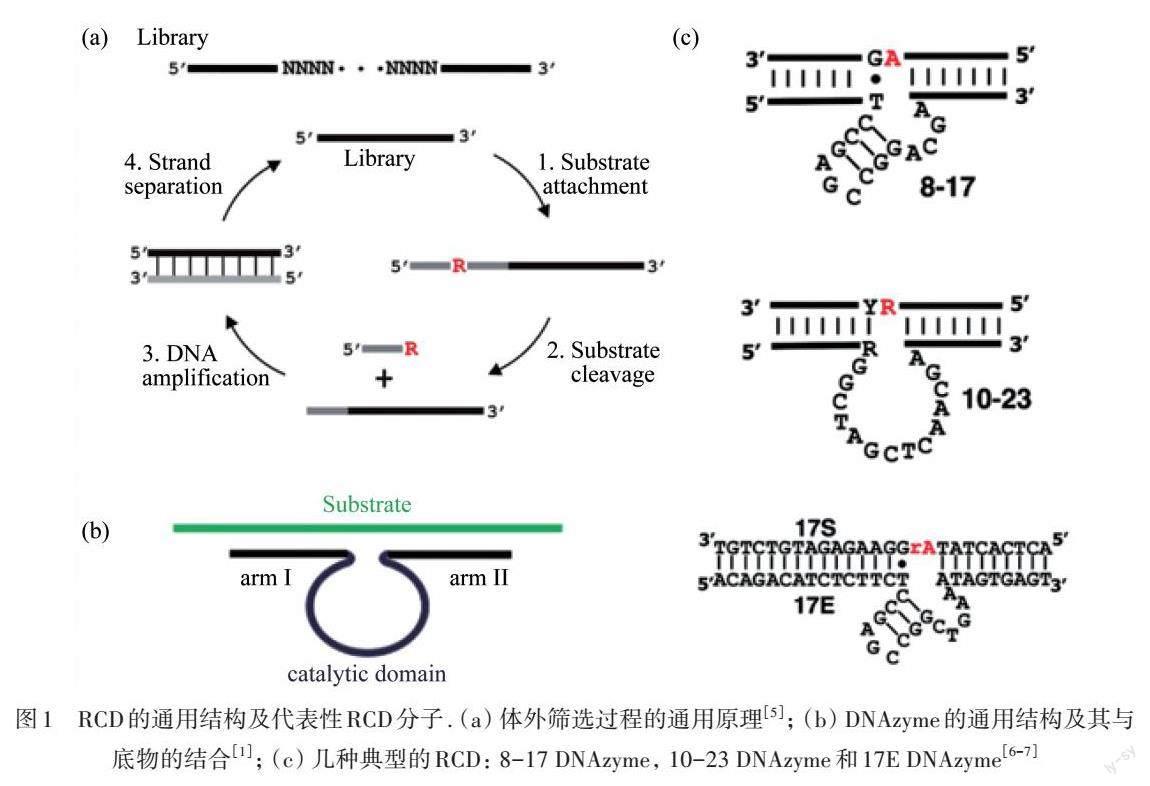
1.1 RCD的通用结构及代表性RCD分子
迄今为止,研究者们尚未发现天然的具有催化功能的DNAzyme. 几乎所有的DNAzyme都是利用SELEX技术在体外筛选分离获得的,如图1(a)所示. 该技术主要由制备筛选文库、与辅助因子孵育、分离切割产物、聚合酶链式反应(PCR)扩增及再合成文库等步骤的多轮循环构成[5].
在所筛选获得的具备不同催化能力的DNAzymes中,RCD是最典型、研究最为充分的一类分子. 一般来说,RCD由3部分组成:催化域、结合臂Ⅰ和结合臂Ⅱ[1] ,如图1(b)所示. 结合臂Ⅰ和结合臂Ⅱ分别位于催化域的两侧,可以通过碱基互补配对原则识别并结合相应的RNA底物;而催化域通常位于中部环区,在特定辅助因子存在的情况下,折叠形成活性结构,通过破坏磷酸二酯键来切割RNA底物[5].

图1 RCD的通用结构及代表性RCD分子. (a) 体外筛选过程的通用原理[5]; (b) DNAzyme的通用结构及其与底物的结合[1]; (c) 几种典型的RCD: 8-17 DNAzyme, 10-23 DNAzyme和17E DNAzyme[6-7]
目前,最具代表性RCD主要包括:SANTORO等[6]篩选得到的8-17 DNAzyme(从约1×1014个随机序列中进行体外筛选时,所得到的第8轮循环第17个克隆)和10-23 DNAzyme(从约1×1014 个随机序列中进行体外筛选时,所得到的第10轮循环第23个克隆)[4]. 8-17 DNAzme的经典结构包含有14个核苷酸构成的催化域序列,其中9个形成发夹结构,其余5个呈单链. 最初被认定的8-17 DNAzyme底物切割位点为A~G,后来扩展为N~G(N=A,U,C或G)[1, 4]. 8-17 DNAzyme家族中有一个值得注意的成员是17E DNAzyme[7],如图1(c)所示. LI等[7]在锌离子(Zn2+)的存在下筛选获得了17E DNAzyme,并针对其对于多种金属离子的响应进行了深入研究. 结果表明:17E DNAzyme在Zn2+存在下活性非常强,在等浓度二价锰离子(Mn2+)和钴离子(Co2+)存在下活性较强,在镉离子(Cd2+)、镍离子(Ni2+)、镁离子(Mg2+)、钙离子(Ca2+)和锶离子(Sr2+)存在下活性中等. 进一步研究表明:17E DNAzyme在铅离子(Pb2+)作为辅助因子的条件下活性最强,这种活性差异为其在多维检测平台中的应用提供了基础. 10-23 DNAzyme也是迄今为止发现的最为高效的DNAzyme之一,在Mg2+高物质的量浓度(10 mmol·L-1或以上)的情况下,10-23 DNAzyme在由kcat/Km(kcat表示单位时间内一个酶分子催化底物转化的最高速率,Km表示酶促反应速度达到最大反应速度一半时所对应的底物浓度)定义的催化效率方面可以与蛋白酶竞争,kcat约为10 min-1;同时在模拟生理条件即Mg2+物质的量浓度低于5 mmol·L-1时,该DNAzyme的kcat 仍然达到0.1 min-1左右[8]. 10-23 DNAzyme的另一个优势是可以切割所有的嘌呤-嘧啶连接,这使对靶向RNA序列中特定位点的选择具有极大的灵活性,大大拓展了其适用范围. 研究者们进一步对10-23 DNAzyme的4个裂解位点AC,AU,GC和GU的切割效率进行了比较,发现它们的裂解效率差异如下:GU>AU>GC>AC[1]. 基于以上特性,8-17DNAzyme和10-23 DNAzyme是目前最常见的被应用于生物传感和癌症治疗的代表性RCD分子.
1.2 常用的RCD的底物
RCD在辅助因子存在下,对底物链具有切割的能力,其底物链必须是RNA分子或切割位点为RNA碱基的嵌合DNA/RNA分子. 最初,利用RCD进行基因调控的主要目标是通过切割病毒的RNA来抑制病毒复制. 随着研究的深入,更多的RCD被应用于切割一些参与重要生理病理过程的基因的mRNA或调节性RNA,如微小RNA(microRNA)[1,9-12],从而为肿瘤等疾病的基因治疗药物开发提供了新型的核酸工具.
mRNA负责将遗传信息从DNA传递到核糖体,在核糖体中,mRNA作为蛋白质合成模板,决定蛋白产物的氨基酸序列[1]. 由于mRNA直接调控蛋白质的表达,某些mRNA的表达水平失调是多种疾病发展的直接原因,特异性地对mRNA水平进行调控一直是基因治疗的重点和难点. 与其他调控手段相比,RCD设计灵活,且其作为单链DNA分子,很容易通过碱基互补等方式与其他DNA工具相结合,实现特定mRNA的识别、检测或切割.
microRNA是近年来被发现广泛存在于动物、植物和病毒中的内源性、非编码RNA分子,其长度约为22个核苷酸,在RNA沉默和基因调控中发挥重要作用[13]. 通过与靶标RNA分子发生完全或不完全互补的碱基配对,microRNA可以降解或阻断靶mRNA的翻译,从而调节蛋白表达. 越来越多的研究证据表明:microRNA的异常表达与多种癌症和其他病理状况的发生密切相关[14]. 例如,microRNA-21水平的异常与恶性肿瘤的增殖、凋亡、侵袭和迁移密切相关,并且经常在慢性淋巴细胞白血病、宫颈癌、肺癌、乳腺癌和前列腺癌中过度表达[13]. 因此,microRNA现在被认为是重要细胞过程的关键调节因子. 目前,基于RCD针对microRNA分子进行检测和调控的工作尚在起步阶段,其应用前景非常广阔.
1.3 激活RCD催化功能所需的辅助因子
RCD的催化域序列只有在辅助因子的协助下,才能折叠形成活性构象,发挥对底物RNA的切割功能. RCD所需的辅助因子种类繁多,常见的辅助因子包括金属离子[15-16]、代谢物小分子[17]、生物大分子[18-19]等. 基于RCD对辅助因子的选择性和依赖性,可以设计以辅助因子为开关的检测平台,将RCD应用于辅酶因子特异性识别和检测[4],将RCD转化为高灵敏度和选择性的荧光、比色、电化学和电化学发光传感器. 另一方面,对于RCD在细胞内或体内的应用,特别是将其用于内源RNA分子的切割和基因调控时,由于内源性辅助因子的生理浓度达不到充分激活RCD所需的浓度,导致其体内催化活性较低,制约了其进一步应用.
2 RCD在生物医学领域的应用
RCD作为一种功能核酸,具有辅助因子响应的RNA切割特性以及成本低、稳定性强、催化效率高等特点,在生物医药领域展现出广阔的应用前景. 一方面,由于RCD的激活依赖某种特定条件,如金属离子[20-21]、中性分子[22-23] 以及生物大分子[24-25]等,才能切割底物分子,其自身既是生物识别元件,又可以作为信号发生器,常常被应用于构建生物传感器进行辅助因子的检测[5]. 另一方面,可以通过设计RCD的结合臂序列,实现对于特定RNA的切割,下调某些致病基因的表达,因此RCD作为一种新兴的基因表达抑制剂或调节剂备受关注. 以下将重点讨论RCD在生物传感以及肿瘤治疗方面的应用.
2.1 RCD应用于生物传感平台的构建
2.1.1 金属离子传感
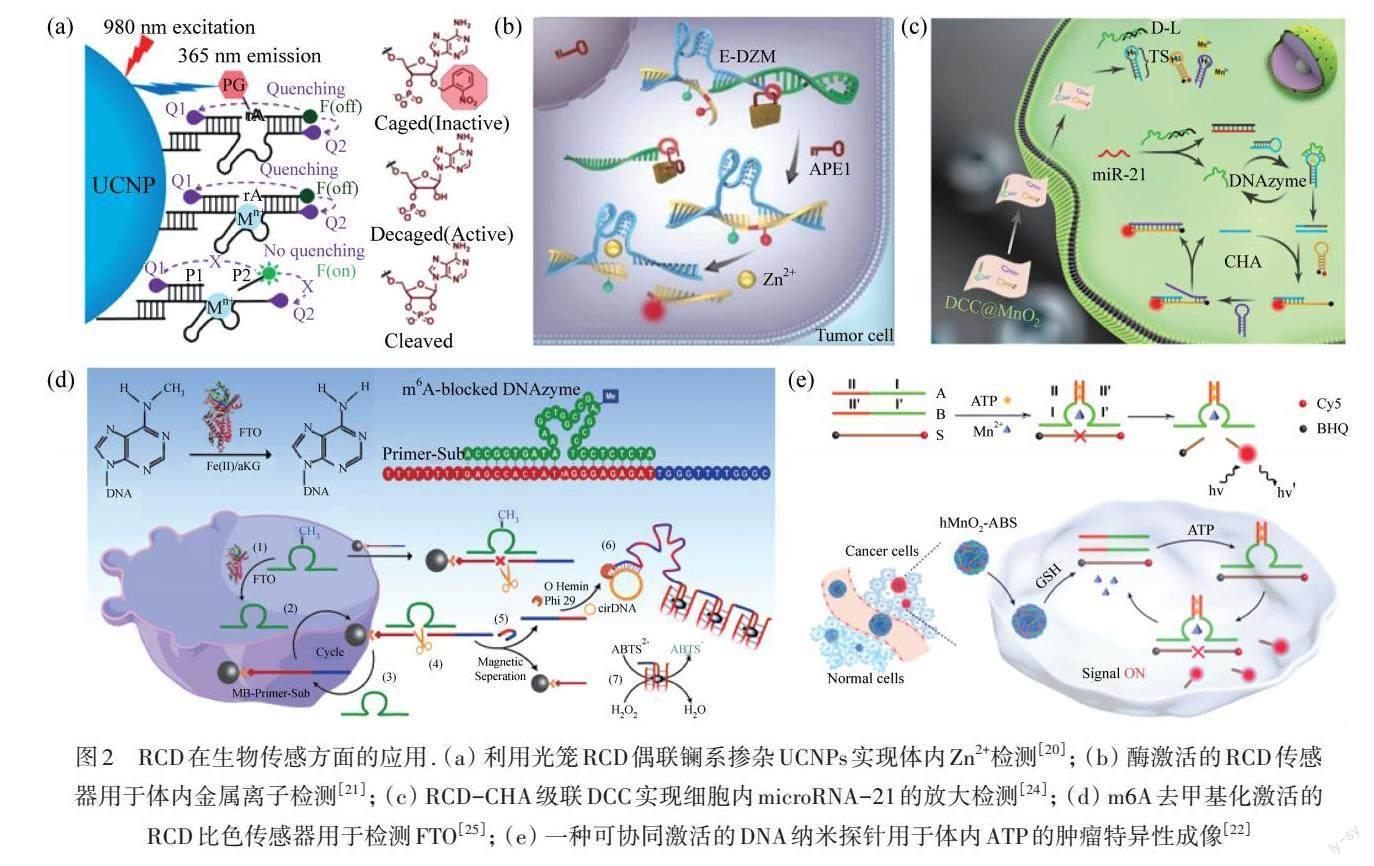
众所周知,金属离子在从细胞到生态系统层面的各级系统中都发挥着至关重要的作用. 例如,金属离子浓度失调与多种疾病的发生有关,包括渗透压失衡、神经功能障碍和癌症等[20]. 因此,对特定金属离子的灵敏检测具有重要的应用价值. 与针对金属离子的诸多小分子探针相比,体外筛选获得的RCD提供了一个普适性的设计平台,且具有易于合成、可编程性高、灵敏度高等优点[8]. 因此,利用RCD检测环境样品、生物基质和生物系统中的金属离子一直是许多研究人员关注的重点. 例如,YANG等[20]开发了光笼Zn2+特异性的RCD-上转换纳米粒子(UCNP)纳米探针,用于斑马鱼早期胚胎的实时金属离子示踪和时空控制,如图2(a)所示. UCNP能够将980 nm的红外激发光上转换为365 nm的紫外发射光,紫外光能够有效地裂解底物链上修饰的对硝基苄基基团,随后,Zn2+特异性的RCD就可以裂解底物,释放出含有FAM荧光基团的底物片段链,这样就实现了对于活细胞或斑马鱼体内Zn2+的光激活检测. 然而,由于光对活体组织的渗透有限,光激活传感的方法在进一步的应用中始终存在困难. 在另一项研究中,YI等[21]构建了一种内源性酶APE1激活的RCD传感器,可以在体内鉴别肿瘤细胞和正常细胞中的金属离子信号. 与传统的RCD传感器相比,其阻断序列包含一个可被癌细胞的细胞质内特异性高表达的酶APE1切割的位点,从而可以选择性地恢复了对癌细胞中金属离子的感知能力,其检测限为0.6 μmol·L-1,如图2(b)所示.
2.1.2 核酸传感
核酸在生物体中发挥着多种重要作用,包括遗传信息的编码、传递和调控等.特定核酸分子的表达失衡往往与疾病发生发展相关. 例如,多种miRNA的异常表达被证明与癌症的发生发展密切相关,因而被认为是癌症早期诊断的生物标志物. HUANG等[24]设计了一种基于RCD级联催化发夹组装(CHA)的纳米系统(DCC),实现了活细胞内miRNA的放大成像检测. 这种无酶扩增的DCC基于RCD的扩增和CHA的顺序激活,使低丰度的靶miRNA能够激活大量的RCD,并形成大量的CHA触发序列(TS),从而实现靶标miRNA的放大检测,其检测限为5.4 pmol·L-1,是传统的CHA系统的1/18. 这种稳定、灵敏的DCC在miRNA的临床诊断和其他相关生物医学应用方面均具有巨大潜力,如图2(c)所示.
2.1.3 蛋白質传感
蛋白质是生物组织的主要结构元素和功能分子. 蛋白质检测可以评估样品中蛋白质的浓度和种类,这对于了解它们的生理和病理功能、识别疾病的生物标志物等至关重要. 例如,最近的研究表明:脂肪量和肥胖相关蛋白(FTO)与儿童和成人的肥胖、2型糖尿病以及乳腺癌等多种恶性癌症的发生和发展有关,因此 FTO 可以作为新的癌症检测标志物和新型的治疗靶点[2]. SHI等[25]开发了一种m6A去甲基化激活的RCD比色传感器,用于灵敏地检测FTO.m6A阻断的RCD生物传感器可以被FTO打开,引发底物裂解,通过RCD的催化循环产生多个引物,然后通过滚环扩增(RCA)生成G-四聚体/血红素RCD,催化2,2-氮基-双-(3-乙基苯-并噻唑啉-6-磺酸(ABTS)氧化,可以肉眼观察到颜色变化,检测限低至69.9 fmol·L-1,其灵敏度明显高于以往报道的,如图2(d)所示.
2.1.4 其他分析物传感
一些中性的代谢物小分子如三磷酸腺苷(ATP)、组氨酸等也可以作为RCD传感的方向底物. 其中ATP作为重要的小分子,是生物体内一切生命活动所需能量的直接来源,在调节生物体内许多生化合成和代谢过程中起着不可或缺的作用[2]. 因此,开发灵敏和特异的ATP 识别和成像方法对于生化研究和临床诊断均具有重要意义. ZHOU等[22]设计了一种分裂适配体-RCD的组合探针,用于ATP的荧光检测,如图2(e)所示. 两条适体酶序列分别由分裂的ATP 适体模块和分裂的RCD模块组成,利用蜂窝二氧化锰(hMnO2)纳米材料作为递送载体,将其递送进入细胞. 随后,细胞内ATP触发分裂的ATP适体模块整合形成完整的适体酶,切割底物释放荧光,特异性地对肿瘤细胞中的ATP进行成像. RCD传感器还可以用于组氨酸检测,组氨酸是一种半必需氨基酸, 具有多种生理学作用,比如组氨酸能降低胃液酸度、缓和胃肠手术时的疼痛等. YU等[23]开发了一种基于RCD的微型热泳动(MST)方法,利用RCD进行组氨酸的识别和酶催化,导致分子结构改变和MST荧光信号的显著变化,从而实现组氨酸的灵敏检测,其检测限为3.9 μmol·L-1. 值得指出的是,该传感策略具有较好的普适性,有望在多种代谢物分子的检测中得到广泛应用.

图2 RCD在生物传感方面的应用. (a) 利用光笼RCD偶联镧系掺杂UCNPs实现体内Zn2+检测[20]; (b) 酶激活的RCD传感器用于体内金属离子检测[21]; (c) RCD-CHA级联DCC实现细胞内microRNA-21的放大检测[24]; (d) m6A去甲基化激活的RCD比色传感器用于检测FTO[25]; (e) 一种可协同激活的DNA纳米探针用于体内ATP的肿瘤特异性成像[22]
2.2 RCD应用于癌症治疗
除了用于构建生物传感器外,RCD在癌症治疗方面的应用也是目前的研究热点,特别是在癌症治疗中的转移和耐药性等治疗难点上[26].
2.2.1 抑制血管生成和肿瘤转移
转移是肿瘤发展进程中最危险的阶段,也是导致病人死亡的最主要原因之一[27],血管生成是肿瘤转移的条件和重要过程. 控制肿瘤血管生成和促进癌细胞转移的关键转录因子包括VEGFR和EGR-1等[26]. 因而,抑制这些转录因子的表达对于抑制癌细胞的转移至关重要,也是目前临床癌症治疗的重要研究方向. 例如,LIU等[28]合成了铜离子(Cu2+)和 RCD 通过配位相互作用共组装成的纳米复合物Cu-RCD,能够同时有效地递送Cu2+和RCD进入癌细胞,进行联合催化治疗,如图3(a)所示. 其中,RCD可有效地催化裂解VEGFR2 mRNA,实现基因沉默,从而抑制血管生成,增强纳米复合物的抗肿瘤效果. 在另一项研究工作中,PENG等[29]开发了一种多功能的MnO2纳米片修饰PEI后吸附RCD的纳米器件MnO2-PEI-RCD(MnPDs),能够实现自给自足的基因沉默,如图3(b)所示. MnPDs进入细胞后,释放的RCD分别能够有效切割早期生长反应因子-1(EGR-1)mRNA 和存活蛋白(Survivin)mRNA,实现两种基因的同时下调,从而能够在引发肿瘤细胞凋亡的同时,抑制血管生成和转移,达到协同基因治疗的效果.
2.2.2 逆转肿瘤耐药性
肿瘤耐药性是指癌细胞对化疗、放疗和热疗等的耐受性增加,导致治疗效果下降. 肿瘤的多药耐药性(MDR)是人类癌症化疗失败的最主要原因,严重威胁着人类健康[26]. 因此,开发一种高效的策略来逆转肿瘤MDR,重建肿瘤细胞对药物的敏感性是肿瘤治疗的关键. 近几年来,利用RCD靶向MDR相关基因被认为是一种有潜力的治疗策略,可以显著提高癌症治疗的效果. 例如,LIANG等[30]通过滚环扩增(RCA)策略构建了P-糖蛋白(P-gp)靶向的RCD纳米花(RCD NFs)应用于阿霉素(Dox)的递送,如图3(c)所示. RCD能够特异性地降解癌细胞中的P-gp mRNA,P-gp水平的下调能够减少癌细胞将Dox或其他抗癌药物运输出细胞,从而逆转MDR效应,因此该纳米复合物能够有效地消融原本具有Dox 抗性的乳腺癌. 体外和体内结果表明:RCD NFs不仅具有较高的载药量(69.21%)和酸响应的细胞内降解能力,还能有效抑制P-gp的表达,大大增强乳腺癌细胞对Dox的敏感性.
光热疗法(PTT)是一种新兴的癌症治疗方法,但随之产生的肿瘤细胞的耐热性极大地限制了其临床应用. 相关研究表明:热应激引发肿瘤细胞中热休克蛋白(HSPs)的异常上调,特别是HSP70和HSP90,是赋予癌细胞较高耐热性的关键因子[26, 31]. 基于此特性,XI等[32]开发了一种花状MnO2包覆的聚多巴胺(PDA@MnO2)核殼纳米平台,并在其表面吸附靶向HSP70 mRNA的RCD,如图3(d)所示.体内外分析结果表明:RCD确实能够有效地下调HSP70 mRNA的表达,逆转肿瘤细胞的耐热性,从而使PTT的功效显著增强,在激光照射下可实现肿瘤的完全消除.

图3 RCD在癌症治疗方面的应用.(a)靶向VEGFR2 mRNA的RCD纳米平台,用于增强肿瘤治疗[33];(b)一种具有双基因沉默特性的多功能纳米复合材料,用于高效的基因治疗[29];(c)RCD NFs靶向P-gp mRNA逆转肿瘤MDR[30];(d)靶向HSP70 mRNA的RCD纳米平台克服肿瘤耐热性,实现增强的PTT[32]
3 结论与展望
本文系统介绍了RCD的物理化学特性,重点介绍了近几年来RCD在生物传感和癌症治疗中的应用. 由于RCD具有特异性的辅助因子依赖性以及高稳定性、高催化活性、易合成、易修饰等优势,通过整合其他的信号转导和放大机制,适用于构建针对金属离子、代谢物小分子和生物大分子等多种物质进行高灵敏度和特异性监测的传感平台. 基于RCD的生物传感系统的进一步应用仍然面临许多挑战,例如,目前基于RCD生物传感系统的应用仍然主要集中在实验室中体外样品的测试上,其体内检测应用仍受到生物递送和生物降解困难、内源性靶标分子的生理浓度较低等诸多因素的限制. 目前的RCD生物传感器很少能达到其他类型的传感器(如基于酶和抗体的传感器)的应用水平,未来还需要在提高传感体系的抗干扰能力、提高RCD在体内的稳定性和放大信号等方面展开更深入的研究.虽然多种RCD已经被用于癌症基因治疗领域,但是其递送效率有限,特别是体内辅助因子的含量降低和选择性较差等问题阻碍了RCD在临床应用中的发展,寻找和利用新的肿瘤特异性因子作为RCD的体内调控开关是解决这一问题的一种新思路.
參考文献:
[1] FAN H, ZHANG X, LU Y. Recent advances in DNAzyme-based gene silencing [J]. Science China Chemistry, 2017,60(5):591-601.
[2] ZHOU W, DING J, LIU J. Theranostic DNAzymes [J]. Theranostics, 2017,7(4):1010-1025.
[3] BREAKER R R, JOYCE G F. A DNA enzyme that cleaves RNA [J]. Chemistry Biology, 1994,1(4):223-229.
[4] FAN S, CHEN J, JI B, et al. DNAzymes in biological detection and gene therapy [J]. Chinese Science Bulletin, 2018, 64(10):1027-1036.
[5] ZHENG X, MA M, CUI L, et al. Advances in RNA-cleaving DNAzymes for environmental analysis [J]. Chemistry Bulletin, 2022,85(7):770-780.
[6] SANTORO S W, JOYCE G F. A general purpose RNA-cleaving DNA enzyme [J]. Biochemistry, 1997,94(9):4262-4266.
[7] LI J, ZHENG W, KWON A H, et al. In vitro selection and characterization of a highly efficient Zn(Ⅱ)-dependent RNA-cleaving deoxyribozyme [J]. Nucleic Acids Research, 2000,28(2):481-488.
[8] MCCONNELL E M, COZMA I, MOU Q, et al. Biosensing with DNAzymes [J]. Chemical Society Reviews, 2021,50(16):8954-8994.
[9] CHEN Y, ZHAO R, LI L, et al. Upconversion luminescence‐boosted escape of DNAzyme from endosomes for enhanced gene‐silencing efficacy [J]. Angewandte Chemie:International Edition, 2022,61(34):1-6.
[10] ZHAO Y, LI R, SUN J, et al. Multifunctional DNAzyme-anchored metal-organic framework for efficient suppression of tumor metastasis [J]. ACS Nano, 2022,16(4):5404-5417.
[11] LIU Y, LIU Z, LIU R, et al. A MnO2 nanosheet-mediated photo-controlled DNAzyme for intracellular miRNA cleavage to suppress cell growth [J]. The Analyst, 2021,146(10):3391-3398.
[12] LEI Y, TANG J, HE X, et al. In situ modulating dnazyme activity and internalization behavior with acid-initiated reconfigurable DNA nanodevice for activatable theranostic [J]. Analytical Chemistry, 2021,93(13):5629-5634.
[13] GAO Y, ZHANG S, WU C, et al. Self-protected DNAzyme walker with a circular bulging DNA shield for amplified imaging of miRNAs in living cells and mice [J]. ACS Nano, 2021,15(12):19211-19224.
[14] KARKHANE M, LASHGARIAN H E, HORMOZI M, et al. Oncogenesis and tumor inhibition by micrornas and its potential therapeutic applications:a systematic review [J]. MicroRNA, 2020,9(3):198-215.
[15] LI Y, LIU K, WANG B, et al. Engineering DNAzyme strategies for fluorescent detection of lead ions based on RNA cleavage-propelled signal amplification [J]. Journal of Hazardous Materials, 2022,440:129712.
[16] QING M, XIE S, CAI W, et al. Click chemistry reaction-triggered 3D DNA walking machine for sensitive electrochemical detection of copper ion [J]. Analytical Chemistry, 2018,90(19):11439-11445.
[17] KONG R M, ZHANG X B, CHEN Z, et al. Unimolecular catalytic DNA biosensor for amplified detection of l-Histidine via an enzymatic recycling cleavage strategy [J]. Analytical Chemistry, 2011,83(20):7603-7607.
[18] ZHANG L, KAN A, WANG S, et al. DNAzyme walker induced DNAzyme working cascade signal amplification strategy for sensitive detection of protein [J]. Sensors and Actuators B:Chemical, 2021,333:129551.
[19] SHENG C, ZHAO J, DI Z, et al. Spatially resolved in vivo imaging of inflammation-associated mRNA via enzymatic fluorescence amplification in a molecular beacon [J]. Nature Biomedical Engineering, 2022,6(9):1074-1084.
[20] YANG Z, KANG Y L, CHU Y T, et al. Optical control of metal ion probes in cells and zebrafish using highly selective DNAzymes conjugated to upconversion nanoparticles [J]. Journal of the American Chemical Society, 2018,140(50):17656-17665.
[21] YI D, ZHAO J, LI L. An Enzyme‐activatable engineered DNAzyme sensor for cell-selective imaging of metal ions [J]. Angewandte Chemie: International Edition, 2021,60(12):6300-6304.
[22] ZHOU Y, ZOU L, LI G, et al. A cooperatively activatable DNA nanoprobe for cancer cell-selective imaging of ATP [J]. Analytical Chemistry, 2021,93(41):13960-13966.
[23] YU H, ZHAO Q. DNAzyme-based microscale thermophoresis sensor [J]. Analytical Chemistry, 2023,95(4):2152-2156.
[24] HUANG X, LI Z, TONG Y, et al. DNAzyme-amplified cascade catalytic hairpin assembly nanosystem for sensitive MicroRNA imaging in living cells [J]. Analytical Chemistry, 2023,95(31):11793-11799.
[25] SHI L, MA X, XIE H, et al. Engineering m6A demethylation-activated DNAzyme for visually and sensitively sensing fat mass and obesity-associated protein [J]. Biosensors and Bioelectronics, 2023,222:115007.
[26] GAO X, LIU Y, HUO W, et al. RNA-cleaving DNAzymes for accurate biosensing and gene therapy [J]. Nanoscale, 2023,15(27):11346-11365.
[27] LAMBERT A W, PATTABIRAMAN D R, WEINBERG R A. Emerging biological principles of metastasis [J]. Cell, 2017,168(4):670-691.
[28] LIU C, CHEN Y, ZHAO J, et al. Self-assembly of copper-DNAzyme nanohybrids for dual-catalytic tumor therapy [J]. Angewandte Chemie: International Edition, 2021,60(26):14324-14328.
[29] PENG W, LI S, ZHANG Y, et al. A double DNAzyme-loaded MnO2 versatile nanodevice for precise cancer diagnosis and Self-Sufficient synergistic gene therapy [J]. Chemical Engineering Journal, 2022,450(3):138138.
[30] LIANG L, HUO W, WANG B, et al. DNAzyme-based nanoflowers for reversing P-glycoprotein-mediated multidrug resistance in breast cancer [J]. Journal of Colloid and Interface Science, 2022,608:2985-2993.
[31] WU J, CAI X, WILLIAMS G R, et al. 2D antimonene-integrated composite nanomedicine for augmented low-temperature photonic tumor hyperthermia by reversing cell thermoresistance [J]. Bioactive Materials, 2022,10:295-305.
[32] XI Y, XIE X, PENG Y, et al. DNAzyme-adsorbed polydopamine@MnO2 core-shell nanocomposites for enhanced photothermal therapy via the self-activated suppression of heat shock protein 70 [J]. Nanoscale, 2021,13(9):5125-5135.
(責任编辑:郁慧,包震宇)

