三苯基膦盐在肿瘤诊断和治疗中的应用
张海峰 安璐
DOI: 10.3969/J.ISSN.1000-5137.2024.01.018
收稿日期: 2023-11-01
基金项目: 国家自然科学基金(22377078)
作者简介: 张海峰(1998—), 男, 硕士研究生, 主要从事碘化铜簇合物在癌症治疗等方面的研究. E-mail:1739045156@qq.com
* 通信作者: 安 璐(1987—), 女, 高级实验师, 主要从事生物无机材料的设计合成及其生物安全性评价等方面的研究. E-mail:anlu1987@shnu.edu.cn
引用格式: 张海峰, 安璐. 三苯基膦盐在肿瘤诊断和治疗中的应用 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):137?145.
Citation format: ZHANG H F, AN L. Application of triphenylphosphonium salt in tumor diagnosis and treatment [J].Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):137?145.
摘 要: 针对靶向亚细胞器的治疗是肿瘤治疗的一个新兴研究方向,其机理是通过损伤亚细胞器或影响亚细胞器周围的环境,使细胞凋亡. 而在众多的亚细胞器中,线粒体是亚细胞的能量工厂,可以为亚细胞的各项生命活动提供能量,因此靶向线粒体治疗是亚细胞器治疗的热点之一. 此外,线粒体还参与细胞分化、细胞信息传递和细胞凋亡等过程. 诱导线粒体损伤或者影响线粒体内表达物质的正常供应关系,对亚细胞生存状态有巨大的影响. 三苯基膦(TPP)盐可以利用线粒体膜电位差来实现线粒体靶向功能,是最广为接受和应用较多的线粒体靶向小分子. 为了进一步增加其功能的多样性,往往会在TPP烷基链的尾端进行设计,实现肿瘤的高效诊断和治疗. 文章综述了近年来TPP盐在肿瘤诊断和治疗领域中的研究进展,以及在未来所面对的挑战.
关键词: 三苯基膦(TPP)盐; 线粒体靶向; 肿瘤诊断; 肿瘤治疗
中图分类号: O 614 文献标志码: A 文章编号: 1000-5137(2024)01-0137-09
Abstract: Subcellular targeted therapy is a new research direction of tumor therapy. It can cause apoptosis by first damaging subcellular organelles or affecting their surrounding environment. Among numerous subcellular organelles, mitochondria are the energy factories of subcellular cells, which can provide energy for various life activities of subcellular cells. Therefore, targeted mitochondrial therapy is one of the hot spots in subcellular organelle therapy. In addition, mitochondria are also involved in processes such as cell differentiation, cell information transmission, and cell apoptosis. It can be seen that inducing mitochondrial damage or affecting the normal supply of substances expressed within mitochondria has a huge impact on the subcellular survival status. Triphenylphosphonium (TPP) salt is the most widely accepted and widely used mitochondrial targeting small molecule, which uses mitochondrial membrane potential difference to achieve mitochondrial targeting function. In order to further increase its functional diversity, the tail end of TPP alkyl chain is often designed to achieve efficient diagnosis and treatment of tumors. This article reviews the research progress of TPP salt in the field of tumor diagnosis and treatment in recent years, as well as the challenges it faces in the future.
Key words: triphenylphosphonium(TPP); mitochondrial targeting; tumor diagnosis; tumor therapy
0 引 言
癌症一直是对人类健康威胁最大的疾病之一,具有极高的致死率和病变部位转移性的特性,治疗难度极大. 这促使着人们研究更为先进的治疗方式,包括放疗(RT)[1]、光热治疗(PTT)[2]和光动力治疗(PDT)[3]等. 这几种方式主要是利用选择性侵入和特异性治疗的方式进行肿瘤治疗,并在临床应用方面已经取得了极大的进展[4]. 在治疗的过程中会面临射线辐射、光穿透力较弱等问题,一定程度上影响了治疗的效果. 通过深入研究肿瘤微环境(TME)与正常细胞器的关系,研究人员发现内源性刺激是肿瘤治疗中的一个新概念. 内源性刺激主要是打破TME或癌细胞内部的动态平衡,如酸性pH值、葡萄糖、谷胱甘肽(GSH)和一些特定的酶等,导致癌细胞凋亡.
利用亚细胞器靶向技术促进内源性刺激是目前的研究热点之一. 亚细胞靶向技术的作用途径大致可分为两方面:一方面是将纳米粒子带入到亚细胞器中,增强内源性刺激,提升其治疗效果;另一方面是直接破坏亚细胞器的结构或者功能来提高治疗效果. 根据亚细胞器的种类,亚细胞靶向技术大致也可以分为溶酶体靶向治疗、细胞核靶向治疗、线粒体靶向治疗和内质网靶向治疗等. 线粒体是能量工厂,有很多重要的细胞参数是由线粒体所决定的,如果能影响其参数变化,必将会影响到细胞的能量供应、细胞信号传递和细胞凋亡等,因此线粒体靶向治疗是热点之一. 三苯基膦(TPP)盐可以利用自身的正电荷与线粒体膜的负电位之间的电位差进行靶向,使其在线粒体膜表面富集. 随后,TPP盐会影响线粒体能量的产生,干扰线粒体膜的结构和功能,并可能导致线粒体的损伤. 在某些情况下,它可以诱导线粒体向坏死或凋亡途径转化,促进细胞死亡. 因此,TPP 盐可以作为一种线粒体靶向分子,为治疗肿瘤提供了新方向[5].
1 TPP盐靶向线粒体的作用原理
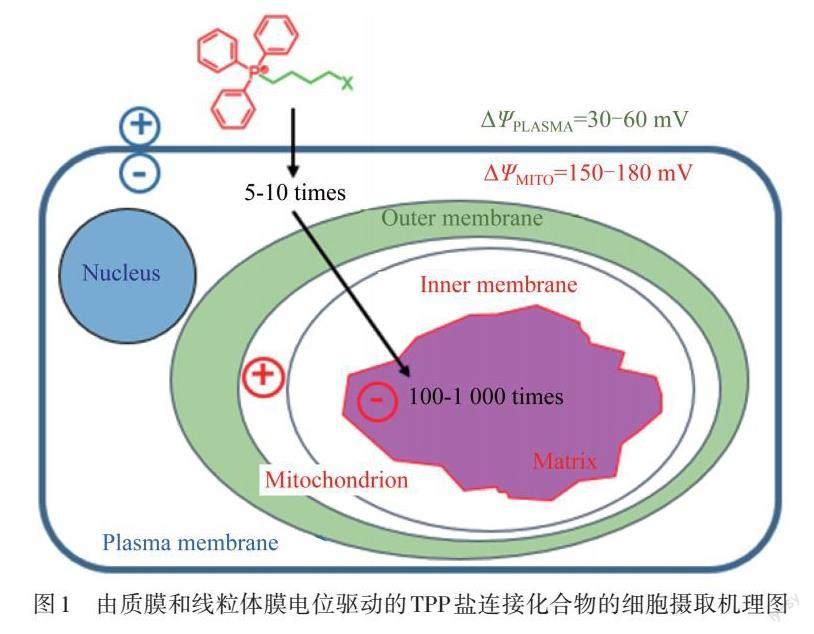
线粒体是由两层膜包被的细胞器,其直径在0.5~1.0 μm. 线粒体膜由磷脂双分子层组成,分别是起到细胞器界膜作用的线粒体外膜(OMM)和负担生化反应的线粒体内膜(IMM)[6]. 而IMM的膜电位高达150~180 mV(内部为负)[7]. 根据线粒体膜的特点,想要进入线粒体就需要具备亲脂性和阳离子两个条件. 因此,亲脂性阳离子材料可以很容易地通过磷脂双层,达到膜电位响应,积聚到线粒体基质中[8]. TPP盐在生物磷脂膜上的作用机理已经被广泛研究. TPP盐的化学结构中含有3个苯基,使整个分子具有很强的脂溶性. 同时,TPP盐中的磷原子带有的正电荷可以离域到3个苯环上,形成离域正电荷,促使TPP盐穿越磷脂膜. 这两大特征使其成为实现线粒体靶向的基本结构单元[9].
靶向线粒体的大致机理如图1所示,与细胞外介质相比,质膜电位(通常为30~40 mV)导致胞质中阳离子浓度增加3~5 倍. 线粒体膜电位(120~180 mV)进一步使线粒体基质中的阳離子浓度增加100~1 000倍. 因此,与细胞外介质相比,阳离子化合物在线粒体基质中的浓度可以是100~1 000倍或更多[10].

图1 由质膜和线粒体膜电位驱动的TPP盐连接化合物的细胞摄取机理图
2 TPP盐在肿瘤检测中的应用
肿瘤具有复杂性、多样性和异质性,肿瘤的精确检测一直是一个难题. 随着医学影像技术的快速发展,如荧光成像(FI)、核磁共振成像(MRI)、超声成像(US)、计算机断层扫描成像(CT)、拉曼(Raman)成像等技术,使肿瘤的精确定位与检测成为可能[11].
2.1 FI
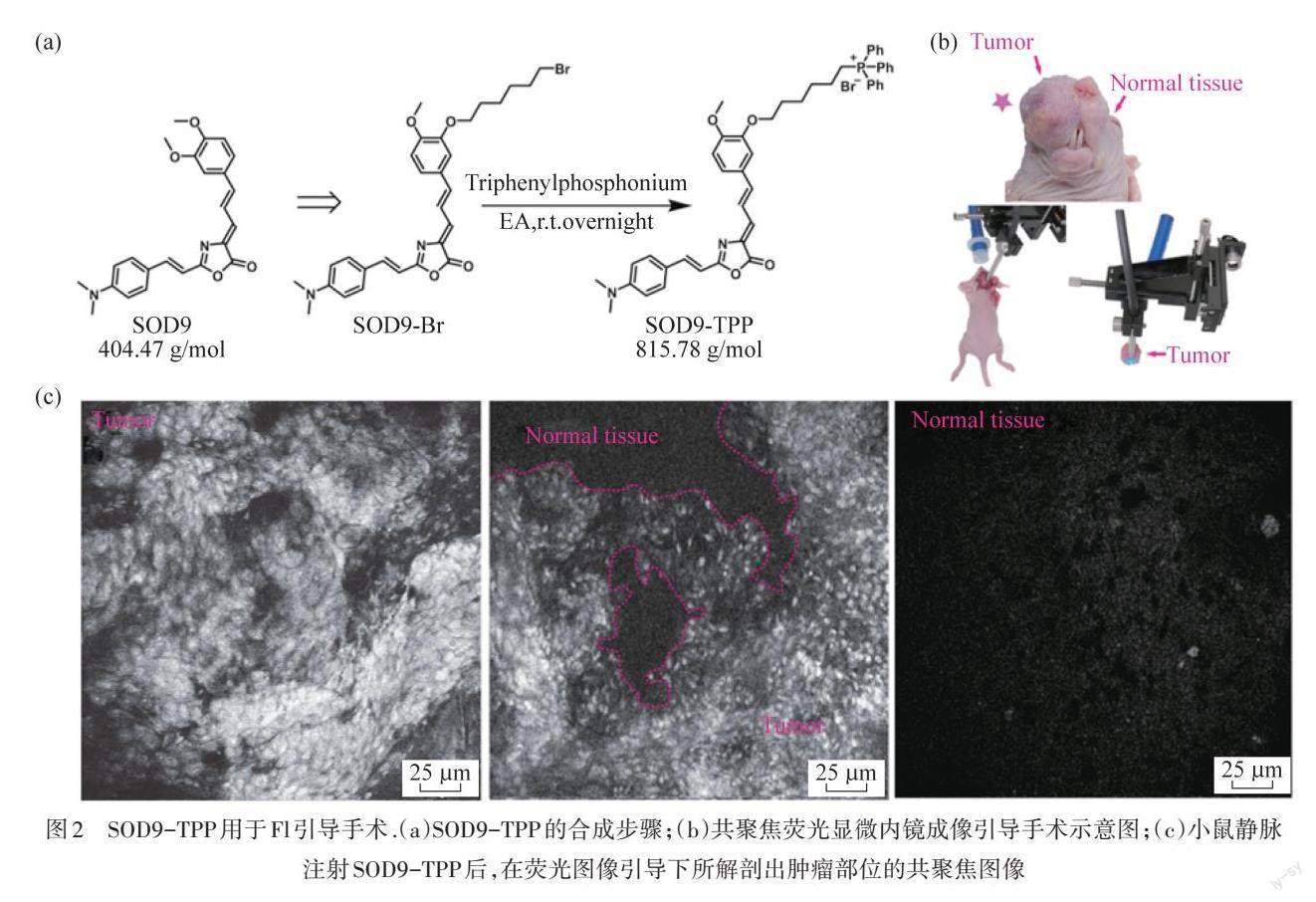
FI已广泛应用于临床前生物医学研究、临床病理学检查和FI引导的外科手术,具有成本低、易于实施、对生物样品的光损伤小和检测灵敏度高的特性. FI的生物医学应用高度依赖于荧光染料的发展[12]. 荧光染料的最关键特征是吸收/发射分布、吸收系数、量子产率、斯托克斯位移、化学性质和光化学稳定性. CHEN等[13]设计并合成了一系列具有近红外发射(>650 nm)、长斯托克斯位移(136~198 nm)和小分子量(<450 Da)的苯乙烯恶唑酮(SODs)染料,其中苯乙烯恶唑酮染料9(SOD9)表现出快速肾排泄和血脑屏障通过性质. 通过SOD9和TPP盐的偶联得到SOD9-TPP,可用于活细胞中线粒体进行染色,如图2(a)所示. 利用正常细胞膜电位(-140 mV)与肿瘤细胞膜电位(-220 mV)之间天然膜电位差,使SOD9-TPP在肿瘤细胞特异性积累,形成肿瘤细胞的特异性成像. 这项工作将SOD9-TPP静脉注射入小鼠体内,用激光共聚焦内窥镜确定手术边界来精确的判断肿瘤组织的边界,以减少手术中的创伤,如图2(a)和2(b)所示.

图2 SOD9-TPP用于Fl引导手术.(a)SOD9-TPP的合成步骤;(b)共聚焦荧光显微内镜成像引导手术示意图;(c)小鼠静脉注射SOD9-TPP后,在荧光图像引导下所解剖出肿瘤部位的共聚焦图像
2.2 拉曼成像
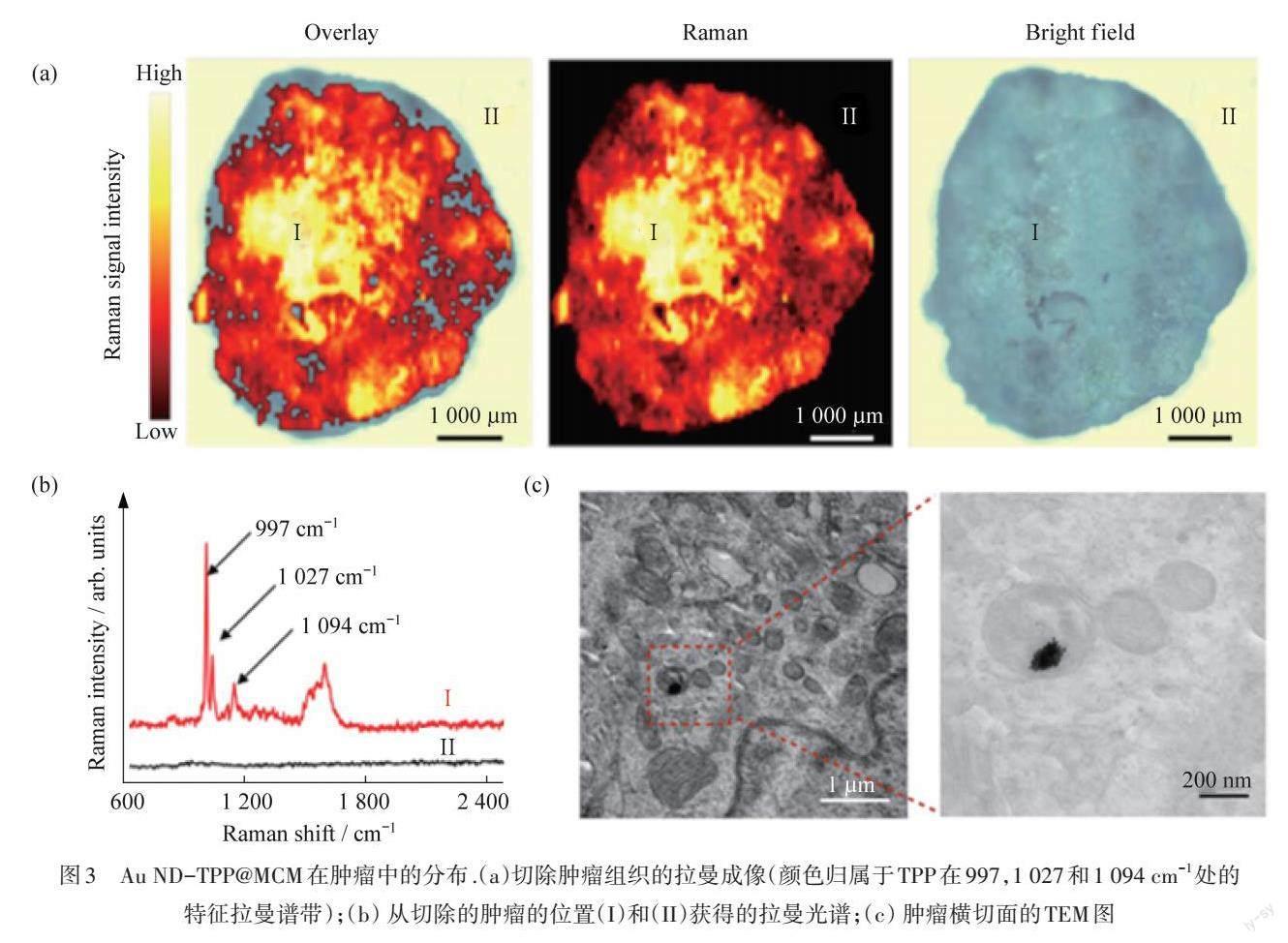
表面增强拉曼散射(SERS)技术在化学、物理、生物学和医学等许多领域都具有重要的科学和实践意义[14]. SERS具有独特的指纹振动谱和超窄的峰宽等优势,检测范围十分宽泛,可以实现从简单的芳香族分子到复杂的生物系统的检测[15-16]. TPP盐苯环在997,1 027和1 094 cm-1处具有强拉曼特征峰,使基于SERS的拉曼成像成为可能. SUN等[17]用巨噬细胞膜(MCM)包裹偶联TPP盐的金纳米枝晶(Au ND),构建了一个纳米治疗诊断平台(Au ND-TPP@MCM). MCM可以与人乳腺癌细胞MDA-MB-231选择性的相互作用;TPP盐修饰后的纳米粒子会在线粒体积累,将PTT和PDT协同所产生的剧毒的单线态氧(1O2)带入到线粒体中,使线粒体受到损伤,从而导致细胞凋亡. 在肿瘤的成像实验中,肿瘤的拉曼图像如图3(a)所示,在肿瘤内观察到强拉曼信号分布. 位置I(肿瘤内)的拉曼光谱在997,1 027和1 094 cm-1处显示3个特征峰,而在位置II(肿瘤外)并没有检测出特征峰,如图3(b)所示. 为了进一步验证拉曼成像的准确性和TPP盐的靶向效果,用透射电子显微镜(TEM)拍摄具有强拉曼信号分布的肿瘤组织样品,在线粒体中发现Au ND-TPP@MCM,验证了损伤线粒体细胞器导致细胞死亡的推论,如图3(c)所示.

图3 Au ND-TPP@MCM在肿瘤中的分布.(a)切除肿瘤组织的拉曼成像(颜色归属于TPP在997,1 027和1 094 cm-1处的特征拉曼谱带);(b) 从切除的肿瘤的位置(I)和(II)获得的拉曼光谱;(c) 肿瘤横切面的TEM图
3 TPP盐在肿瘤治疗中的应用
相对于单一治疗方式,协同治疗方式起到“1+1>2”的治疗效果,已经被广泛的应用. 具有线粒体靶向的TPP盐,可以在其烷基链的尾端偶联肿瘤治疗药物或者无机纳米粒子,从而表现出不同的功能[18-19]. 近年来,TPP盐相关的材料已经应用于PTT、PDT、免疫原性细胞死亡(ICD)等众多的协同治疗方式[20].
3.1 PTT
PTT是利用高光热转换效率的材料汇聚到肿瘤细胞中,在红外光的照射下将光能转换为热能,产生局部高温杀死癌细胞. PTT的效果主要取决于材料的光热转换效率,同时还需要考虑材料的吸收波长和激光的选择. 组织会影响激光的穿透率,往往会影响光热效果. Au纳米粒子是最常用的光热材料之一,因为其在近红外区有强烈的吸收,在此区间激光有一定的穿透力[21]. 如PAN等[22]以金纳米星-树突聚甘油(GNSs)为中心,在外表面偶联上己糖激酶2(HK2)抑制剂3-溴丙酮酸(3BP)、TPP盐、透明质酸(HA)3种物质,得到GNSs-dPG-3BP/TPP/HA复合纳米颗粒. 如图4所示,该纳米复合颗粒利用HA可以与乳腺癌干細胞(CSCs)中过表达细胞表面标记物CD44特异性的结合,提高CSCs摄取纳米复合颗粒的能力,再利用TPP盐的线粒体靶向性能将3BP带到线粒体附近,与OMM结合的HK2结合,通过抑制CSCs的糖酵解能力,从而抑制线粒体的正常代谢,并通过增加细胞色素C的释放,进一步诱导细胞凋亡. 同时,增强了GNSs所介导的PTT治疗效果,从而达到协同抑制肿瘤的效果,在影响CSCs基因表达的同时还清除CSCs. 这项研究所开发的纳米复合颗粒中,通过线粒体靶向和PTT协同治疗的方式,为根除CSCs提供了一种新的策略.

图4 GNSs-dPG的合成步骤、在CSCs中靶向和代谢抑制及PTT协同治疗示意图
3.2 PDT
PDT是在光照下使用光敏剂将氧气(O2)转变为剧毒的活性氧(ROS),因其具有一定的选择性且对正常的组织影响较小而受到关注. 但在TME中本来就是缺氧的状态,O2含量不足会导致PDT疗效较差. 如何解决这个关键性问题,是提高PDT效果的关键. YUAN等[23]开发了一种线粒体靶向的O2节省器(Mito-oxe)来减轻肿瘤缺氧,以增强PDT. 如图5所示,该O2节省器由卟啉IX光敏剂(Pplx)用亲水聚乙二醇和TPP盐修饰,制备生物相容性线粒体靶向光敏剂(Mito-pss),再负载线粒体氧化磷酸化抑制剂阿托伐醌(ATO)制备而成. 利用TPP盐的靶向能力,Mito-oxe可以在细胞摄取后选择性地在线粒体中积累,在ATO的参与下,抑制线粒体复合物,阻断氧化磷酸化的电子传递,线粒体呼吸被抑制,导致局部缺氧缓解,从而达到增强PDT的效果. 与Mito-pss相比,Mito-oxe在光照射下对低氧肿瘤的治疗效果是最佳的. 此项研究所构建的线粒体靶向O2节省器,通过减少O2的消耗提高PDT,为利用TME中有限的物质提高PDT疗效提供了一种新思路.

图5 (a) Mito-OxE的简易合成过程和(b) 缓解肿瘤缺氧以增强PDT的机理图
3.3 ICD
ICD是肿瘤细胞受到外界刺激发生死亡的同时,由非免疫原性转变为免疫原性而介导机体产生抗肿瘤免疫应答的过程[24]. 众所周知,肿瘤不仅会逃避免疫微环境,免疫细胞还有可能会保护甚至是促进肿瘤细胞的增殖和扩散. 自ICD现象被发现以来,开发能够诱导肿瘤细胞ICD的药物一直是肿瘤免疫治疗领域的研究热点. 遗憾的是,目前可用的ICD诱导剂的数量仍然非常少,且大多数是高毒性化疗药物. 因此,研发低毒性的诱导剂迫在眉睫. JIANG等[25]提出了一种基于磁热疗(MHT)引起的线粒体热应激的新型ICD模式,通过热分解方法用锌锰铁氧体(ZnMnFe2O4)壳包覆硬磁性锌钴铁氧体(ZnCoFe2O4)核,制备出核壳结构的ZnCoFe2O4@ ZnMnFe2O4纳米粒子(MNP)表面接枝精氨酰-甘氨酰-天冬氨酸(RGD)和TPP盐,构建出纳米药物平台MNPs-RGD-TPP(MRT),用于有效地激发肿瘤相关巨噬细胞(TAM)对抗癌细胞. 这种热应激损伤的线粒体可引起肿瘤细胞的ICD,以释放损伤相关分子模式(DAMP),激活TAM针对癌细胞的免疫应答,如图6所示. 此项研究通过线粒体靶向磁热ICD激活TAM的治疗方法,对未来的抗肿瘤免疫治疗具有指导意义.

图6 (a) MRT的合成示意图和(b) 线粒体热应激诱导ICD用于MHT下的癌症免疫治疗的机理图
4 结论与展望
综上所述,TPP盐材料被广泛地应用于肿瘤的诊断和治疗,其可以联合多种诊断和治疗方式进行多模态诊断和协同治疗. 本文简要概述了TPP盐在FI和拉曼成像的肿瘤诊断,以及PTT,PDT和ICD等肿瘤治疗中的运用. 对于TPP盐在肿瘤诊断和肿瘤治疗方面的优缺点和发展趋势总结如下.
在肿瘤诊断方面:利用TPP盐的亲脂性和正电荷进行肿瘤线粒体特异性靶向,具有精确、快速和良好的诊断效果. 但是其特异性选择肿瘤细胞的效果仅依靠线粒体膜电位的差,会有较大的误差,因此在生物安全性方面需要着重考虑. 目前,TPP鹽在肿瘤诊断领域的应用还是比较少的,因为其对于尾部偶联的荧光分子具有一定要求(例如:小分子荧光稳定性、水溶性和细胞毒性小等). 现在已取得了优秀的研究成果,这个领域是非常值得研究和探索的.
在肿瘤治疗方面:TPP盐介导的靶向线粒体,具有优良的靶向性和可多变的尾部偶联有机官能团,为协同治疗提供了良好的思路. 但是,由于线粒体自身的低渗透压性,TPP盐往往只能将药物携带到线粒体表面,并不能被线粒体很好地吸收,因此,对于线粒体损伤效果会变差. 如果想要进一步提升线粒体损伤的效果,需要提前调研携带药物的作用范围或者合成效果更好的靶向线粒体有机小分子. 随着亚细胞器的深入研究,相信在不久的将来,靶向线粒体导致线粒体损伤的肿瘤治疗会得到快速的发展.
参考文献:
[1] WU Y, ZHU K, ZHANG X, et al. Emerging plasmonic nanoparticles and their assemblies for cancer radiotherapy [J]. Advanced Drug Delivery Reviews, 2023,194:114710.
[2] LIANG Y, LIAO C, GUO X, et al. RhRu alloy-anchored mxene nanozyme for synergistic osteosarcoma therapy [J]. Small, 2023,19(22):2205511.
[3] XIAO Z, CHEN Q, YANG Y, et al. State of the art advancements in sonodynamic therapy (SDT): metal-organic frameworks for SDT [J]. Chemical Engineering Journal, 2022,449:137889.
[4] ZHOU Z, SONG J, NIE L, et al. Reactive oxygen species generating systems meeting challenges of photodynamic cancer therapy [J]. Chemical Society Reviews, 2016,45(23):6597-6626.
[5] ZHEN W, AN S, WANG S, et al. Precise subcellular organelle targeting for boosting endogenous-stimuli-mediated tumor therapy [J]. Advanced Materials, 2021,33(51):2101572.
[6] RALPH S J, RODRIGUEZ-ENRIQUEZ S, NEUZIL J, et al. Bioenergetic pathways in tumor mitochondria as targets for cancer therapy and the importance of the ROS-induced apoptotic trigger [J]. Molecular Aspects of Medicine, 2010,31(1):29-59.
[7] LIN X, LI L, LI S, et al. Targeting the opening of mitochondrial permeability transition pores potentiates nanoparticle drug delivery and mitigates cancer metastasis [J]. Advanced Science, 2021,8(4):2002834.
[8] LU P, BRUNO B J, RABENAU M, et al. Delivery of drugs and macromolecules to the mitochondria for cancer therapy [J]. Journal of Controlled Release, 2016,240(28):38-51.
[9] BATTOGTOKH G, KO Y T. Mitochondrial-targeted photosensitizer-loaded folate-albumin nanoparticle for photodynamic therapy of cancer [J]. Nanomedicine, 2017,13(2):733-743.
[10] ZIELONKA J, JOSEPH J, SIKORA A, et al. Mitochondria-targeted triphenylphosphonium-based compounds: syntheses, mechanisms of action, and therapeutic and diagnostic applications [J]. Chemical Reviews, 2017,117(15):10043-10120.
[11] SMITH B R, GAMBHIR S S. Nanomaterials for in vivo imaging [J]. Chemical Reviews, 2017,117(3):901-986.
[12] CHENG P, PU K. Molecular imaging and disease theranostics with renal-clearable optical agents [J]. Nature Reviews Materials, 2021,6(12):1095-1113.
[13] CHEN H, LIU L J, QIAN K, et al. Bioinspired large stokes shift small molecular dyes for biomedical fluorescence imaging [J]. Science Advances, 2022, 8(32). DOI: 10.1126/sciadv.abo3289.
[14] HUEFNER A, KUAN W L, MULLER K H, et al. Characterization and visualization of vesicles in the endo-lysosomal pathway with surface-enhanced raman spectroscopy and chemometrics [J]. ACS Nano, 2016,10(1):307-316.
[15] DAI X, SONG Z L, SONG W, et al. Shell-switchable SERS blocking strategy for reliable signal-on SERS sensing in living cells: detecting an external target without affecting the internal raman molecule [J]. Analytical Chemistry, 2020, 92(16):11469-11475.
[16] DURRANT B, TRAPPETT M, SHIPP D, et al. Recent developments in spontaneous raman imaging of living biological cells [J]. Current Opinion in Chemical Biology, 2019,51:138-145.
[17] SUN J, WANG J, HU W, et al. Camouflaged gold nanodendrites enable synergistic photodynamic therapy and NIR biowindow II photothermal therapy and multimodal imaging [J]. ACS Applied Materials Interfaces, 2021,13(9):10778-10795.
[18] ZHU Y, HUANG Y, JIN Y, et al. Peptide-guided system with programmable subcellular translocation for targeted therapy and bypassing multidrug resistance [J]. Analytical Chemistry, 2019,91(3):1880-1886.
[19] LOPEZ V, VILLEGAS M R, RODRIGUEZ V, et al. Janus mesoporous silica nanoparticles for dual targeting of tumor cells and mitochondria [J]. ACS Applied Materials & Interfaces, 2017,9(32):26697-26706.
[20] LIU S, ZHANG T, LI S, et al. Biomimetic nanobomb for synergistic therapy with inhibition of cancer stem cells [J]. Small, 2023,19(12):2206503.
[21] TAO W, CHENG X, SUN D, et al. Synthesis of multi-branched Au nanocomposites with distinct plasmon resonance in NIR-Ⅱ window and controlled CRISPR-Cas9 delivery for synergistic gene-photothermal therapy [J]. Biomaterials, 2022,287:121621.
[22] PAN Y, ZHOU S, LIU C, et al. Dendritic polyglycerol-conjugated gold nanostars for metabolism inhibition and targeted photothermal therapy in breast cancer stem cells [J]. Advanced Healthcare Materials, 2022,11(8):2102272.
[23] YUAN P, DENG F A, LIU Y B, et al. Mitochondria targeted O2 economizer to alleviate tumor hypoxia for enhanced photodynamic therapy [J]. Adv Healthc Mater, 2021,10(12):e2100198.
[24] GUO J, ZOU Y, HUANG L. Nano delivery of chemotherapeutic ICD inducers for tumor immunotherapy [J]. Small Methods, 2023,7(5):2201307.
[25] JIANG H, FU H, GUO Y, et al. Evoking tumor associated macrophages by mitochondria-targeted magnetothermal immunogenic cell death for cancer immunotherapy [J]. Biomaterials, 2022,289:121799.
(責任编辑:郁慧,顾浩然)

