纳米材料介导植物遗传转化的研究进展
杨得民 曹婷婷 吕敏 陈楠

DOI: 10.3969/J.ISSN.1000-5137.2024.01.016
收稿日期: 2023-11-01
基金项目: 国家自然科学基金(21974089)
作者简介: 杨得民(1999—), 男, 硕士研究生, 主要从事纳米材料用于植物基因表达调控等方面的研究. E-mail:15629733873@163.com
* 通信作者: 陈 楠(1979—), 女, 研究员, 主要从事纳米生物效应、 纳米荧光探针及纳米药物等方面的研究. E-mail:Nchen@shnu.edu.cn
引用格式: 杨得民, 曹婷婷, 吕敏, 等. 纳米材料介导植物遗传转化的研究进展 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):120?128.
Citation format: YANG D M, CAO T T, LYU M, et al. Research progress of nanomaterials in plant genetic transformation [J]. Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):120?128.
摘 要: 植物遗传转化对于改善农作物的性状,培育高产、优质、多抗性的新品种,从而降低农药和肥料的使用量等至关重要. 传统的遗传转化方法存在着诸多局限性,如物种的不普适性,植物组织易被破坏,成本高、耗时长和转化效率低等. 近几年,纳米材料介导的植物遗传转化策略逐渐被研究和尝试,并显示出了不受物种限制、生物相容性良好和操作简单等一系列优势. 文章对常用的传统遗传转化方法进行了总结,重点介绍了近年来多种纳米材料在植物遗传转化中的研究和应用进展,并讨论和展望了纳米材料在植物遗传转化应用领域的挑战和发展前景.
关键词: 纳米材料; 纳米基因载体; 植物遗传转化; 基因表达调控
中图分类号: Q 943.2 文献标志码: A 文章编号: 1000-5137(2024)01-0120-09
Abstract: Plant genetic transformation is crucial for improving quality of crop straits, cultivating new varieties with high yield, improved quality, and multi-resistance, thereby reducing the use of pesticides and fertilizers. Traditional genetic transformation approaches have great limitations, including the non-universality of species, susceptibility to plant tissue destruction, high cost, long time consumption, and low transformation efficiency. In recent years, strategies for plant genetic transformation mediated by nanomaterials have been developed and attempted, and have shown a series of advantages such as no species limitation, good biocompatibility, and simple operation. This review introduces the commonly used traditional genetic transformation methods and focuses on the recent research and application progress of various nanomaterials in plant genetic transformation. Finally, the challenges and prospects in the field of plant genetic transformation are discussed.
Key words: nanomaterials; nano-gene vetors; plant genetic transformation; regulation of gene expression
0 引 言
植物遺传转化指利用物理、化学方法或借助载体,将外源遗传物质导入植物受体细胞,并整合到受体细胞的染色体中,从而调控目的基因在受体植物中的表达水平,达到改变植物性状以及培育植物新品种的目的. 植物遗传转化技术是植物基因工程的关键,传统的植物遗传转化方法主要包括农杆菌介导法、聚乙二醇(PEG)介导法、脂质体介导法、基因枪法、花粉管通道法和超声波法等.
尽管植物遗传转化技术取得了许多突破,但仍远落后于动物基因工程的发展. 植物细胞的细胞壁由纤维素、半纤维素、果糖和少量结构蛋白构成[1],参与调节细胞的形状和扩张、控制组织凝聚以及抵御微生物或病原体等生理功能[2],细胞壁的存在使外源物质难以进入细胞内部,仅允许小粒径的生物分子通过,极大程度地阻碍了外源基因载体进入植物细胞内部发挥功能. 因此,许多现有的基因转导技术很难被应用于植物遗传转化[3].
20世纪末,随着纳米技术的迅速发展,纳米材料因其尺寸小、比表面积大、生物兼容性较好等优点被广泛用作基因载体应用于生物医学领域[4]. 近年来,研究者们尝试将纳米材料应用于植物遗传转化领域,并展示出了巨大的潜力. 目前,纳米材料已经被作为核酸载体应用于烟草、棉花、水稻等植物[5]. 本文介绍了两种最常用的传统遗传转化方法以及纳米材料介导的基因传递系统的研究现状,并且讨论了不同种类纳米材料在介导植物基因传递方面的特点和优势.
1 常用的植物遗传转化手段
1.1 农杆菌介导法
农杆菌侵染植物后,借助毒力蛋白将T-DNA插入植物细胞中. 毒力蛋白协助T-DNA从农杆菌转运至植物细胞壁和质膜,并促进T-DNA整合到植物核基因组中,从而实现遗传转化. 1977年,CHILTON等[6]首次利用农杆菌介导法实现了质粒DNA(plasmids DNA,pDNA)向植物细胞中的有效递送. 自此以后,农杆菌介导的植物遗传转化得到了迅速发展,目前已广泛应用于多种双子叶植物,如大豆[7]、棉花[8]、番茄[9]和烟草[10]等. 农杆菌介导的遗传转化依赖于化学物质诱导,如植物受伤后释放的酚类物质乙酰丁香酮和α酰羟基乙酰丁香酮[11],能够诱导农杆菌吸附在植物伤口处,从而使农杆菌T-DNA发生转移,实现基因转化. 由于这些酚类物质通常不存在于单子叶植物,导致农杆菌介导的遗传转化应用范围受到限制,遗传转化效率很低. 1984年,HERNALSTEENS等[12]首次利用农杆菌成功实现了单子叶植物石刁柏的遗传转化,为实现农杆菌介导的单子叶植物遗传转化提供了可能性. 近年来,农杆菌介导的转化已经被成功应用于少部分农作物,如水稻[13]、小麦[14]和玉米[15].
农杆菌介导法是目前研究最为成熟、应用最为广泛的植物遗传转化方法. 其优势在于操作相对简单,重复性高且成本较低. 然而,该方法也存在一些明显的缺陷:(1) 由于农杆菌的侵染特点,大多数单子叶植物都不会自然地被农杆菌所侵染;(2) 单子叶植物的转化效率远低于双子叶植物;(3) 由于农杆菌侵染后,外源DNA被随机整合到植物基因组中,很可能导致植物出现不理想的农艺性状.
1.2 基因枪法
1987年,KILEIN等[16]首次开发了biolistic技术,即基因枪技术,也称为粒子轰击技术,并首次使用该技术将携带DNA的钨颗粒轰击进入洋葱表皮细胞,成功转化了洋葱表皮细胞[17]. 随着研究人员对物理参数、环境和生物条件的优化,改进后的基因枪法能够转化不同的受体材料,包括原生质体[18]、愈伤组织[19]、花粉[20]等. 与农杆菌介导法相比,基因枪法较少受到植物种属的限制,适用范围更广,如CAIMI等[21]成功将解淀粉芽孢杆菌的SacB基因转入单子叶植物玉米,促進了具有较高经济价值的果聚糖合成,显示出了该方法在农作物育种改良中的应用潜力. 基于其受体植物物种的多样性,操作简便以及可以转化高达150 kb分子量的DNA等优点,基因枪法在植物基因工程中得到了广泛的发展. 然而基因枪法也存在局限性:一方面粒子轰击系统所使用的设备及材料(如金颗粒和基因枪等)较为昂贵,增加了遗传转化的成本;另一方面,粒子轰击容易对植物造成损伤,导致其转化效率降低,以及转化后的DNA片段容易发生断裂,进一步限制了转化的成功率.
2 纳米材料介导的植物遗传转化
与传统的植物遗传转化方法相比,纳米材料介导的基因递送策略具有多种优势,例如细胞毒性较低、操作简单和不受物种限制且能同时递送多种生物分子等. 此外,纳米材料还具有易于设计和改性的独特优势,例如,纳米材料可经过表面修饰后,实现针对特定植物细胞器(叶绿体[22]和线粒体[23])的靶向递送. 目前,已有多种纳米材料被报道应用于植物体内的基因表达调控,主要包括碳基、纳米金、层状双氢氧化物(LDH)和肽载体等纳米材料.
2.1 碳基纳米材料在植物中遗传转化的应用
碳基纳米材料因具有出色的光学性能、良好的生物相容性、丰富的表面官能团等优点,被广泛应用于电子、传感、纳米医学等各个领域. 碳纳米管、碳点、石墨烯和氧化石墨烯等是碳基纳米材料家族的主要成员. 已有大量研究聚焦于碳基纳米材料与哺乳动物之间的相互作用,然而将其应用于植物基因递送的研究目前仍处于起步阶段,其作为植物遗传转化中的基因递送载体的效率和相关机制仍在探索中.
2.1.1 碳 点
碳点是直径小于10 nm的零维碳纳米材料,因其优异的光学性能,良好的生物相容性而被广泛应用于生物医学、光催化等领域. 近年来,碳点在植物方面的研究主要聚焦于其对于植物生长、发育[24]、光合作用[25]和抵抗生物胁迫[26]的影响等. 碳点的小粒径和表面丰富的官能团为其负载核酸,穿过细胞壁提供了可能性,因此研究人员尝试将碳点应用于植物核酸递送中. 碳点通常因表面带羟基或羧基而呈负电荷,WANG等[27]将聚乙烯亚胺(PEI)引入碳点表面,使其带正电荷,并通过静电吸附携带pDNA,在水稻、小麦、绿豆等多种植物中实现了基因递送和功能的表达,成功诱导水稻叶片组织产生了潮霉素抗性,如图1(a)所示. SCHWARTZ等[28]使用PEI作为碳源,通过溶剂热反应合成了用于吸附siRNA(小干扰RNA,small interfering RNA)的水溶性碳点,该纳米复合物进一步与非离子型表面活性剂混合制备成制剂,使用低压喷雾方法喷洒至烟草和番茄叶片上,沉默了绿色荧光蛋白(GFP)和内源性基因镁螯合酶H亚基(Magnesium Chelatase H,CHLH,一种叶绿素合成关键酶),如图1(b)所示,成功观察到叶片白化,并通过定量聚合酶链反应证明了相关基因mRNA转录水平的降低,如图1(c)所示.

图1 碳点在植物遗传转化中的应用. (a) 利用碳点将潮霉素抗性基因导入水稻叶片中, 成功诱导水稻产生潮霉素抗性[27];利用碳点将用于沉默CHLH的siRNA注入烟草叶片中,成功实现相关基因敲除[28]; (b) 烟草叶片表现出叶片白化(白色箭头所指); (c) CHLH的转录本分析. 叶片处理后5 d, 从四株植物的4片叶子中取样进行实时荧光定量PCR(RT-qPCR)分析
2.1.2 碳纳米管
碳纳米管可分为直径为1~3 nm的单壁碳纳米管(SWCNTs)和直径为5~40 nm的多壁碳纳米管(MWCNTs)[29]. 使用碳纳米管作为核酸递送系统的相关研究在哺乳动物体系取得了理想的结果,但很少有人关注其在植物基因递送方面的研究.
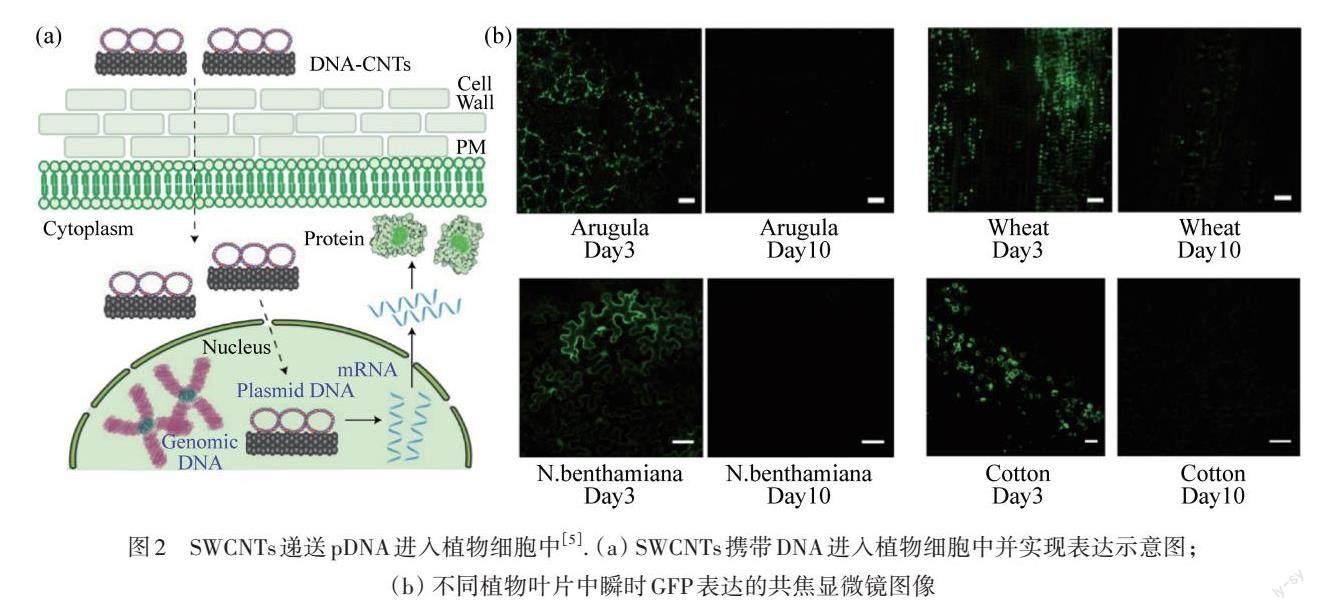
LIU等[30]首次验证了SWCNTs能穿过完整的植物细胞,使用SWCNTs携带异硫氰酸荧光素(FITC)标记的单链DNA,通过与烟草黄亮细胞BY-2共孵育,在共聚焦荧光显微镜下观察到了明显的FITC绿色荧光,该工作证明了无需外部帮助(例如粒子轰击),携带DNA的SWCNTs即可成功进入完整的植物细胞. 在此之后,使用碳纳米管向植物中递送其他生物分子的相关研究逐渐被报道. DEMIRER等[5]通过共价结合的方式使用PEI对SWCNTs进行修饰(PEI-SWCNTs),使其表面呈正电,静电吸附pDNA,负载在碳纳米管上的pDNA不会受到核酸内切酶的影响而被降解. 该工作首先将DNA-Cy3负载在PEI-SWNT表面,DNA-Cy3与内源性GFP共定位结果表明:与裸DNA-Cy3不同,负载在PEI-SWNTs上的DNA能被递送进入成熟植物叶片中;随后,使用PEI-SWCNTs携带表达GFP的质粒DNA,将其注射到不同植物叶片中,包括双子叶植物烟草、芝麻、棉花和单子叶植物小麦,在其叶片中均观察到了明显的绿色荧光,并通过定量聚合酶链反应证明了GFP的表达,如图2所示. 该工作证明了在不依赖外力(如基因枪)的条件下,SWCNTs能够实现植物的基因递送,并且不受植物种属的限制. 通过对碳管表面进行修饰,还能实现针对植物细胞器的靶向递送. KWAK等[22]通过在SWCNTs表面共价结合壳聚糖,可在不需要外力辅助的情况下实现pDNA的叶绿体靶向递送. 使用该复合纳米材料递送pDNA进入分离的原生质体和成熟植物的叶绿体中,成功实现了黄色荧光蛋白的瞬时表达. 在后续研究中,SANTANA等[31]开发了靶向叶绿体的碳基纳米管材料,通过植物生物识别的方法提高了靶向递送效率. 在该研究中,研究人员在SWCNTs表面修饰能靶向叶绿体的肽,该肽可以选择性地结合叶绿体膜上的蛋白质易位子外通道(TOC),从而实现靶向递送,成功提高了pDNA在叶绿体中的表达. LAW等[23]利用类似的方式实现了pDNA在成熟植物叶片的线粒体中表达. RNA干扰(RNA interference,RNAi)可以实现有效的转录后基因沉默,有利于研究和控制植物的代谢途径以及构建抗病毒植物等. 局部应用小干扰RNA来激活RNAi,可帮助植物功能基因组学的研究、作物改良和作物保护等. siRNA的高效递送是该技术发展的主要障碍. DEMIRER等[32]利用π-π堆叠的方式构建了siRNA-SWCNTs系统. SWCNTs可以保护RNA免受核酸酶的降解,该工作实现了RNA向成熟植物细胞中递送,并有效沉默了突变体植物的GFP基因.

图2 SWCNTs递送pDNA进入植物细胞中[5]. (a) SWCNTs携带DNA进入植物细胞中并实现表达示意图;(b) 不同植物叶片中瞬时GFP表达的共焦显微镜图像
2.2 纳米金
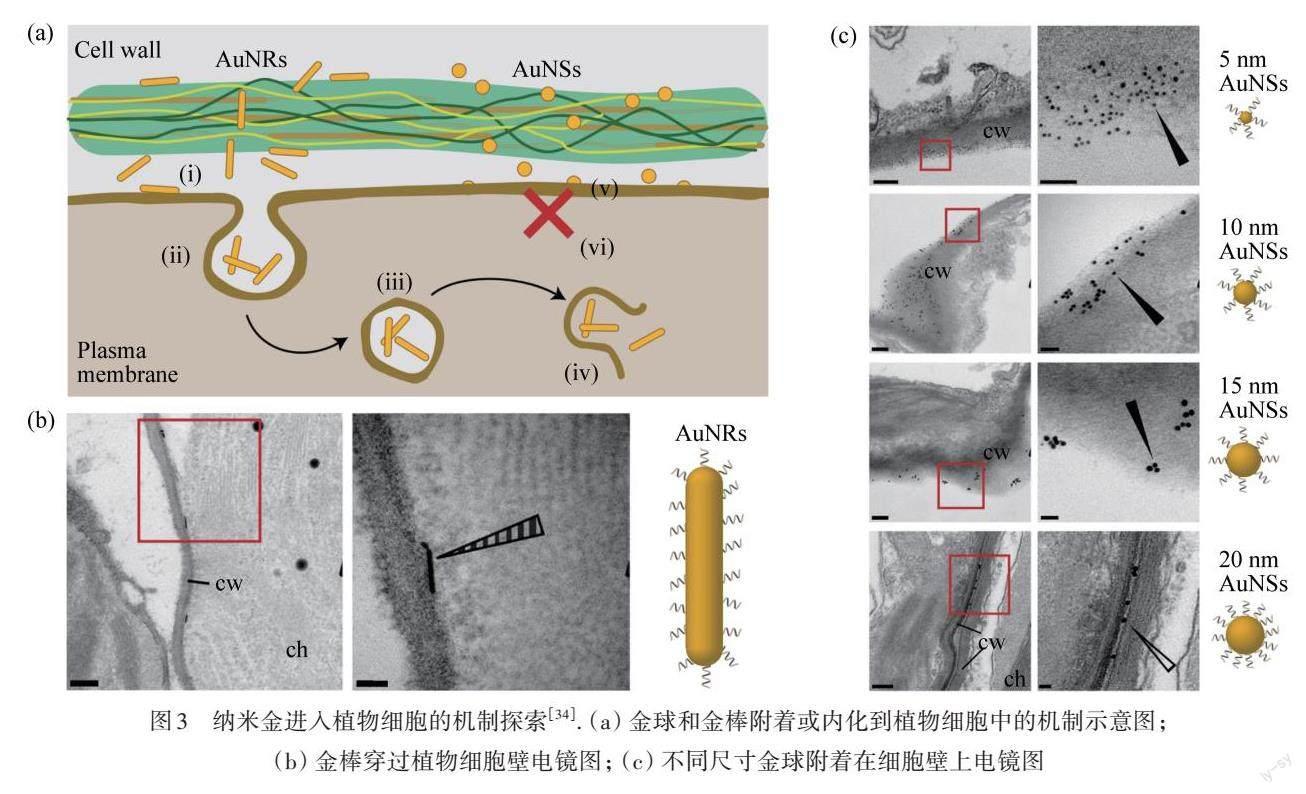
使用基因枪将DNA包覆的纳米金颗粒注入植物组织,从而实现遗传转化的方法已经得到了广泛研究,但纳米金本身是否可以作为介导外源基因进入植物细胞的载体尚待研究. 纳米金有着超小的尺寸(小于10 nm),使得纳米金有机会穿过植物细胞壁. ZHANG等[33]合成了PEI功能化的金纳米团簇(PEI-AuNCs). PEI-AuNCs通过静电吸附的形式负载siRNA,可以有效地保护siRNA不被降解. 该研究观察了PEI-AuNCs在20 min至24 h的内化程度,结果表明:在渗透1 h时,其内化程度最高,1 h后内化程度逐渐降低. 该工作设计了针对GFP基因的siRNA,PEI-AuNCs可以成功地将siRNA传递到表达GFP的成熟烟草叶片中;通过RT-qPCR分析和蛋白质印迹实验(Western Blot),分别验证了靶基因的敲除. 在該课题组的另一项研究中,ZHANG等[34]合成了4种不同直径的纳米金颗粒(5,10,15和20 nm)和纳米金棒(13 nm×68 nm,长宽比为5.2),用于递送siRNA到成熟植物叶片中,他们发现颗粒形状是影响纳米金载体内化和基因传递效率的关键因素,如图3(a)所示. 结果显示:金棒可以通过一定角度穿过细胞壁并被细胞内吞,实现RNA的递送,如图3(b)所示. 而金球载带siRNA并不需要穿过细胞壁,通过附着在细胞壁上也能实现基因沉默,并且10 nm金球具有更高的基因沉默效率,如图3(c)所示. 该结果提示了纳米载体的内化机制需要进一步研究探索.

图3 纳米金进入植物细胞的机制探索[34]. (a) 金球和金棒附着或内化到植物细胞中的机制示意图;(b) 金棒穿过植物细胞壁电镜图; (c) 不同尺寸金球附着在细胞壁上电镜图
2.3 LDH
LDH是一类表面带正电的离子层状无机材料,在自然界中以矿物形式存在. 由于LDH的阳离子特性,它可以与带负电荷的DNA强烈结合.
BAO等[35]首次证明了LDH可以递送生物分子进入植物细胞. 该工作将FITC标记的单链DNA(FITC-ssDNA)负载在LDH上,与悬浮的拟南芥根细胞进行共培养,结果显示:DNA被细胞成功内化. 该研究进一步对摄取机制进行了探究,结果表明:不论是抑制剂还是低温处理,均不影响材料的内化,即内化与网格蛋白介导的内吞作用以及能量相关的内化途径无关. MITTER等[36]合成了携带双链RNA(double strand RNA,dsRNA)的LDH,使用局部喷洒的方式,使CMV2b-dsRNA-Cy3-LDH(对照为CMV2b-dsRNA-Cy3)附着在烟草叶片上且无法被水流冲洗,如图4(a)所示. 在植株的培养过程中LDH被缓慢降解,随后dsRNA逐渐释放,起到基因调控和抗病毒的作用;由于材料的高附着性和能被逐渐降解,LDH实现了长达30 d的抗病毒效果,且未被喷洒的新叶也获得了20 d的保护,如图4(b)所示. 该工作发展了一种能够有效抑制番茄黄化曲叶病毒的纳米制剂,作为一种可持续且易于采用的局部喷雾剂,这项研究为将纳米技术应用于作物保护提供了全新的思路.

图4 LDH应用于植物抗病毒研究[36]. (a) 分别喷洒CMV2b-dsRNA-Cy3和CMV2b-dsRNA-Cy3-LDH后, 拟南芥叶子清洗前后的共聚焦图像; (b) 烟草叶片使用不同材料喷洒处理后5 d及20 d, 用黄瓜花叶病毒PMMoV攻击, 烟草坏死病灶情况
2.4 肽载体
肽载体是近年来迅速发展起来的一类非病毒纳米载体. 聚阳离子肽可以凝聚带负电荷的DNA,并保护DNA免受核酸酶降解. 细胞穿透肽(CPP)可促进细胞摄取小分子化合物、DNA片段和纳米尺寸的颗粒等. CPP的作用已经在哺乳动物细胞中得到了广泛的研究. 2005年,CHANG等[37]首次利用富含精氨酸的细胞内转运肽将完全生物活性形式的GFP和红色荧光蛋递送到番茄和洋葱组织中,表明CPP可以穿过细胞壁和细胞膜将外源生物分子递送到完整的植物细胞中. 此外,多种细胞器靶向肽也已被应用于将基因传递到植物的线粒体[38]和叶绿体[39]等. 例如2019年,THAGUN等[39]合成了叶绿体靶向肽和细胞穿透肽复合肽(CTP/CPP),可以较为快速地将pDNA转染到叶绿体中,如图5(a)所示. 该工作使用细胞器靶向精准地将DNA递送至不同植物叶细胞叶绿体中,利用无针注射的方式将pDNA/CTP/CPP复合物注入拟南芥叶片和烟草叶片中,如图5(b)和5(c)所示,为靶向递送物质进入植物细胞器中提供了一种新策略. 该方法不仅简单有效,而且无需复杂材料和昂贵仪器.

图5 使用肽介导的靶向基因递送至各种植物细胞质体种的研究[39]. (a) pDNA/CTP/CPP复合物介导的质体转化示意图;(b) 拟南芥叶片细胞中绿色体特异性GFP瞬时表达的共聚焦图像; (c) 烟草叶片细胞中绿色体特异性GFP瞬时表达的共聚焦图像
3 总结与展望
植物基因工程育种可以定向改良农作物的目标性状,实现作物品质和产量的同步提高,以满足人们需求. 因此,建立高效、简便、通用的植物遗传转化方法至关重要. 纳米材料介导的植物遗传转化具有如下优点:(1) 纳米材料无需外力辅助即可穿过植物细胞壁,通过简单的注射或喷洒的方式就能实现纳米基因载体的内化和核酸的递送、表达;(2) 纳米载体较少受到植物种属的限制,由于农杆菌的侵染特性,对于绝大多数单子叶植物无法实现农杆菌介导的转化,而多数纳米材料没有严格的宿主选择性;(3) 纳米载体对核酸具有保护性,核酸负载在纳米材料后,不会受到核酸酶影响而被快速降解,有效降低了其降解速率;(4) 纳米载体可负载大量核酸,实现大片段基因递送和多基因共同递送. 目前纳米材料介导的遗传转化已经被尝试应用于烟草、拟南芥、小麦、玉米、棉花、菠菜、水稻等多个种属的植物.
作为植物基因工程中的新兴领域,纳米材料介导的基因递送尚在起步阶段,仍存在许多问题亟待解决:(1) 纳米材料内化进入植物细胞的机制尚不明确,研究工作的结论不一. 在现有的研究中,以LDH为例,BAO等[35]所报道的工作中,拟南芥根部细胞无论是抑制剂处理后的还是低温处理后的,均不影响纳米材料的内化,而在后续的另一篇研究中,YONG等[40]对分离出来的番茄花粉细胞进行低温处理过后,纳米材料的内化效率明显降低,提示两者的内化机制存在很大差异. (2) 核酸的递送是否需要纳米材料进入植物细胞中. 在ZHANG等[34]的研究中,使用金作为递送系统时,其实验结果表明:具有穿过细胞壁能力的金棒递送siRNA的效率低于未穿过细胞壁的金球(10 nm),其具体机制仍需進一步探究. (3) 纳米材料作为递送系统是否安全. 纳米材料作为递送系统施用于植物后,可以经生物链流入土壤,水系,最终到达动物体内,而纳米材料的是否会发生累积,其对生态环境及动物是否会造成不可逆的影响也需要进一步探究. (4) 目前纳米材料介导的遗传转化仍处于探索阶段,大多数应用聚焦于植物叶片或根部细胞,且所递送核酸均是瞬时过表达或敲除荧光蛋白等非功能基因,其进一步效用尚待开发. 为了实现目的基因的稳定表达,利用纳米材料对CRISPR-Cas基因编辑系统进行递送是一个全新和有潜力的方向,其优势包括稳定性高、毒性低、负载能力强、受体植物种类广泛等. 可以预见,纳米材料与CRISPR-Cas系统的结合将在植物基因工程领域拓展全新的应用前景.
參考文献:
[1] ZHAO Y, MAN Y, WEN J, et al. Advances in imaging plant cell walls [J]. Trends in Plant Science, 2019,24(9):867-878.
[2] SOMERVILLE C, BAUER S, BRININSTOOL G, et al. Toward a systems approach to understanding plant cell walls [J].Science, 2004,306:2206-2211.
[3] YAN Y, ZHU X, YU Y, et al. Nanotechnology strategies for plant genetic engineering [J]. Advanced Materials, 2022,34:2106945.
[4] YADAV K, SAHU K K, SUCHETA, et al. Biomedical applications of nanomaterials in the advancement of nucleic acid therapy: mechanistic challenges, delivery strategies, and therapeutic applications [J]. International Journal of Biological Macromolecules, 2023,241:124582.
[5] DEMIRER G S, ZHANG H, MATOS J L, et al. High aspect ratio nanomaterials enable delivery of functional genetic material without DNA integration in mature plants [J]. Nature Nanotechnology, 2019,14:456-464.
[6] CHILTON M D, DRUMMOND M H, MERLO D J, et al. Stable incorporation of plasmid DNA into higher plant cells: the molecular basis of crown gall tumorigenesis [J]. Cell, 1977,11(2):263-267.
[7] LI S, CONG Y, LIU Y, et al. Optimization of agrobacterium-mediated transformation in soybean [J]. Frontiers in Plant Science, 2017,8:246.
[8] WANG Q, ALARIQI M, WANG F, et al. The application of a heat-inducible CRISPR/Cas12b (C2c1) genome editing system in tetraploid cotton (G. hirsutum) plants [J]. Plant Biotechnology Journal, 2020,18(12):2436-2443.
[9] SHARMA M K, SOLANKE A U, JANI D, et al. A simple and efficient Agrobacterium-mediated procedure for transformation of tomato [J]. Journal of Biosciences, 2009,34(3):423-433.
[10] NORKUNAS K, HARDING R, DALE J, et al.Improving agroinfiltration-based transient gene expression in Nicotiana benthamiana [J].Plant Methods,2018,14:71.
[11] STACHEL S E, MESSENS E, ZAMBRYSKI M V M P. Identification of the signal molecules produced by wounded plant cells that activate T-DNA transfer in Agrobacterium tumefaciens [J]. Nature Communications, 1985,318:624-629.
[12] HERNALSTEENS J P, THIA-TOONG L, SCHELL J, et al. An Agrobacterium-transformed cell culture from the monocot Asparagus officinalis [J]. The EMBO Journal, 1984,3:3039-3041.
[13] HIEI Y, KOMARI T. Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed [J]. Nature Protocols, 2008,3(13):824-834.
[14] BARTLETT J G, ALVES S C, SMEDLEY M, et al. High-throughput Agrobacterium-mediated barley transformation [J].Plant Methods, 2008,4:22.
[15] ISHIDA Y, HIEI Y, KOMARI T. Agrobacterium-mediated transformation of maize [J]. Nature Protocols, 2007,2:1614-1621.
[16] KLEIN T M, WOLF E D, WU R, et al. High-velocity microprojectiles for delivering nucleic acids into living cells [J].Nature Communications, 1987,327:70-73.
[17] SANFORD J C, KLEIN T M, WOLF E D, et al. Delivery of substances into cells and tissues using a particle bombardment process [J]. Particulate Science and Technology, 1987,5(1):27-37.
[18] GALBRAITH D W. Silica breaks through in plants [J]. Nature Nanotechnology, 2007,2:272-273.
[19] CARSONO N, YOSHIDA T. Transient expression of green fluorescent protein in rice calluses: optimization of parameters for helios gene gun device [J]. Plant Production Science, 2015,11:88-95.
[20] HAY I, LACHANCE D, ADERKAS P V, et al. Transient chimeric gene expression in pollen of five conifer species following microparticle bombardment [J]. Canadian Journal of Forest Research, 1994,24(12):2417-2423.
[21] CAIMI P G, MCCOLE L M, KLEIN T M, et al. Fructan accumulation and sucrose metabolism in transgenic maize endosperm expressing a bacillus am ylolique faciens SacB gene [J]. Plant Physiol, 1996,110(2):355-363.
[22] KWAK S Y, LEW T T S, SWEENEY C J, et al. Chloroplast-selective gene delivery and expression in planta using chitosan-complexed single-walled carbon nanotube carriers [J]. Nature Nanotechnology, 2019,14:447-455.
[23] LAW S S Y, LIOU G, NAGAI Y, et al. Polymer-coated carbon nanotube hybrids with functional peptides for gene delivery into plant mitochondria [J]. Nature Communications, 2022,13:2417.
[24] LI H, HUANG J, LU F, et al. Impacts of carbon dots on rice plants: boosting the growth and improving the disease resistance [J]. ACS Applied Bio Materials, 2018,1(3):663-672.
[25] WANG H, ZHANG M, SONG Y, et al. Carbon dots promote the growth and photosynthesis of mung bean sprouts [J].Carbon, 2018,136:94-102.
[26] SU L X, MA X L, ZHAO K K, et al. Carbon nanodots for enhancing the stress resistance of peanut plants [J]. ACS Omega, 2018,3(12):17770-17777.
[27] WANG B, HUANG J, ZHANG M, et al. Carbon dots enable efficient delivery of functional DNA in plants [J]. ACS Applied Bio Materials, 2020,3(12):8857-8864.
[28] SCHWARTZ S H, HENDRIX B, HOFFER P, et al. Carbon dots for efficient small interfering RNA delivery and gene silencing in plants [J]. Plant Physiology, 2020,184(2):647-657.
[29] BYRNE M T, GUN'KO Y K. Recent advances in research on carbon nanotube-polymer composites [J]. Advanced Materials, 2010,22(15):1672-1688.
[30] LIU Q, CHEN B, WANG Q, et al. Carbon nanotubes as molecular transporters for walled plant cells [J]. Nano Letters,2009,9(3):1007-1010.
[31] SANTANA I, JEON S J, KIM H I, et al. Targeted carbon nanostructures for chemical and gene delivery to plant chloroplasts [J]. ACS Nano, 2022,16(8):12156-12173.
[32] DEMIRER G S, ZHANG H, GOH N S, et al. Carbon nanocarriers deliver siRNA to intact plant cells for efficient gene knockdown [J]. Science Advances, 2020,6(26):1-12.
[33] ZHANG H, CAO Y, XU D, et al. Gold-nanocluster-mediated delivery of siRNA to intact plant cells for efficient gene knockdown [J]. Nano Letters, 2021,21(13):5859-5866.
[34] ZHANG H, GOH N S, WANG J W, et al. Nanoparticle cellular internalization is not required for RNA delivery to mature plant leaves [J]. Nature Nanotechnology, 2021,17:197-205.
[35] BAO W, WANG J, WANG Q, et al. Layered double hydroxide nanotransporter for molecule delivery to intact plant cells [J]. Scientific Reports, 2016,6:26738.
[36] MITTER N, WORRALL E A, ROBINSON K E, et al. Clay nanosheets for topical delivery of RNAi for sustained protection against plant viruses [J]. Nature Plants, 2017,3:16207.
[37] CHANG M, CHOU J C, LEE H J. Cellular internalization of fluorescent proteins via arginine-rich intracellular delivery peptide in plant cells [J]. Plant and Cell Physiology, 2005,46(3):482-488.
[38] YOSHIZUMI T, OIKAWA K, CHUAH J A, et al. Selective gene delivery for integrating exogenous DNA into plastid and mitochondrial genomes using peptide-DNA complexes [J]. Biomacromolecules, 2018,19(5):1582-1591.
[39] THAGUN C, CHUAH J A, NUMATA K. Targeted gene delivery into various plastids mediated by clustered cell‐penetrating and chloroplast‐targeting peptides [J]. Advanced Science, 2019,6:1902064.
[40] YONG J, ZHANG R, BI S, et al. Sheet-like clay nanoparticles deliver RNA into developing pollen to efficiently silence a target gene [J]. Plant Physiology, 2021,187(2):886-899.
(責任编辑:郁慧,包震宇)

