虎杖苷调节YAP1/TAZ信号通路对缺氧性肺动脉高压新生大鼠肺动脉平滑肌细胞增殖与凋亡的影响*
刘文光, 刘思佟, 张薇薇, 庄桂银, 谢思雨, 田 雪, 李晓珊, 谷 强△
新疆维吾尔自治区石河子大学第一附属医院 1儿科 2产科,石河子 832000 3新疆维吾尔自治区石河子市人民医院产科,石河子 832000
新生儿缺氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是一种严重的儿童肺动脉高压,其发病率和死亡率都很高。HPH的主要病理改变为肺血管调节功能障碍,其中肺动脉平滑肌细胞(pulmonary arterial vascular smooth muscle cells,PASMCs)增殖引起的肺小血管非典型收缩和重构,导致右心室肥厚甚至衰竭[1]。目前HPH的治疗策略包括一氧化氮吸入以及西地那非、米力农和前列环素等肺血管扩张药物的使用,但以上治疗存在一定的不良反应,且一旦疾病发展为肺血管重构和右心室肥厚,治疗的有效性就会降低,导致死亡率升高[2]。因此,制定有效的预防新生儿HPH疾病进展的策略至关重要。虎杖苷(polydatin,PD)是从虎杖根中提取的天然二苯乙烯类化合物,具有抗氧化、抗炎、改善微循环等多种药理活性,对肺、肝、神经系统和心血管系统具有保护作用[3]。已有研究发现,PD能够改善野百合碱诱导的肺动脉高压损伤,抑制肺内皮功能障碍和肺血管重构[4]。研究表明,Hippo通路与肺血管重构关系密切,Yes相关蛋白1(YAP1)和PDZ结合域的转录共刺激因子信号通路(TAZ)是Hippo通路的两个关键转录调控因子,Hippo-YAP1/TAZ轴能够通过调节细胞增殖、分化和凋亡来控制器官大小[5]。此外,YAP1/TAZ在肺动脉高压(PH)模型及缺氧人PASMCs中表达异常上调,表明YAP1/TAZ参与PH进展[6]。但PD对HPH新生大鼠的保护作用及对肺血管平滑肌细胞增殖与凋亡的具体作用机制尚不完全清楚。本研究对此进行探究。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级Wistar新生大鼠70只,日龄7~10 d,购自新疆维吾尔自治区实验动物研究中心,生产许可证号:SCXK新2003-0001,20~30 g,所有大鼠均饲养于12 h明暗循环的标准环境中,自由进食和饮水。本研究经动物伦理委员会批准。
1.1.2 主要试剂与仪器 PD购自深圳海思安生物技术有限公司;Hippo通路抑制剂XMU-MP-1购自美国MCE公司;苏木精-伊红(HE)染色液购自上海源叶生物科技有限公司;胶原酶购自上海抚生实业有限公司;DMEM培养液购自武汉赛奥斯生物科技有限公司;CCK-8试剂盒购自武汉伊莱瑞特生物科技公司;EdU试剂购自艾美捷科技有限公司;Annexin Ⅴ-FITC/PI试剂盒、辣根过氧化物(HRP)结合的二抗购自南京诺唯赞生物科技公司;一抗YAP1、TAZ、B细胞淋巴瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)和β-actin(英国Abcam公司)。常压低氧舱(贵州风雷氧舱有限公司);CO2培养箱购自广州科适特科学仪器有限公司;显微镜购自德国徕卡公司;流式细胞仪购自美国贝克曼库尔公司。
1.2 动物实验
1.2.1 动物模型构建及分组 将新生大鼠随机分为6组:对照组、模型组、PD低剂量组、PD中剂量组、PD高剂量组、PD高剂量+Hippo通路抑制剂(XMU-MP-1)组,每组10只。除对照组饲养于标准条件下的室内空气中外,其余各组大鼠饲养于常压低氧舱中,氧浓度(10.0±0.5)%,温度25~27℃,湿度50%~70%,缺氧8 h/d持续2周,自由饮水和进食[7]。从缺氧第1天开始,PD低、中、高剂量组新生大鼠参照文献[8]中的方法分别在缺氧前10 min,隔日腹腔注射PD 5 mg/kg、10 mg/kg、20 mg/kg,连续4周;PD高剂量+XMU-MP-1组在缺氧前10 min,腹腔隔日注射PD 20 mg/kg和XMU-MP-1 1 mg/kg[9],连续4周;对照组和模型组给予相同剂量的生理盐水。
1.2.2 右心室收缩压(RVSP)和右心室肥厚指数(RVHI)检测 缺氧4周后,腹腔注射戊巴比妥钠麻醉大鼠,将微导管通过静脉切开术引入右颈外静脉,插入各组大鼠心脏右心室(right ventricular,RV),采用BE-EH4生物信号系统测量RVSP数据。
测量结束后,将大鼠安乐死,打开胸腔后分离右心室、左心室(left ventricle,LV)和室间隔(ventricular septum,VS),分别称量其干重。计算RVHI即RV重量与LV和室间隔重量的比值=RV/(LV+VS)。解剖出左肺,置于液氮中保存,用于后续实验。
1.2.3 肺组织病理学观察 取各组大鼠右肺组织,固定在10%甲醛溶液中,制备成4 μm厚的石蜡切片,进行HE染色,观察血管重构和纤维化情况。采用Image Pro Plus图像分析软件计算肺动脉管壁厚度(wall thickness)占总厚度的百分比(WT%)和管壁面积(wall area)占总面积的百分比(WA%)。
1.2.4 Western blot检测肺组织蛋白表达 取各组大鼠左肺组织,在冰上用放射性免疫共沉淀裂解液裂解提取总蛋白,蛋白定量后,在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上分离每个样品的等量蛋白,然后将凝胶上的蛋白转移到PVDF膜上。然后用5%牛血清白蛋白(BSA)封闭膜,并与一抗YAP1(1∶1000)、MST1(1∶1000)、TAZ(1∶1000)和β-actin在4℃孵育过夜,后将膜与HRP结合的二抗孵育。用化学发光试剂对免疫反应条带进行可视化。
1.3 细胞实验
1.3.1 PASMCs细胞分离与培养 取正常新生大鼠用45 mg/kg的戊巴比妥钠腹膜内麻醉,在显微镜下解剖肺内动脉,剥离外膜和内皮后,组织切块用0.2%胶原酶在37°C消化2 h,转移到细胞培养瓶中。加入含20 %胎牛血清和青霉素/链霉素的DMEM培养液,在培养箱(37℃,5% CO2)中培养。取第2~5代PASMCs用于实验。用特异性α-SMA抗体对提取的PASMCs细胞进行鉴定并确定其纯度。
1.3.2 细胞分组 将处于对数生长期的PASMCs分为NC组、低氧(Hypoxia)组、PD低剂量组、PD中剂量组、PD高剂量组、PD高剂量+XMU-MP-1组。其中NC组细胞在常氧(37℃,21% O2,5% CO2)条件下的DMEM培养液中培养;Hypoxia组细胞在缺氧(37℃,3% O2,5% CO2)条件下的DMEM培养液中培养;PD低、中、高剂量组分别用0.5、1、2 mmol/L的PD处理后,在缺氧(37℃,3% O2,5% CO2)条件下的DMEM培养液中培养;PD高剂量+XMU-MP-1组用2 mmol/L的PD和1 μmol/L的XMU-MP-1[10]处理后,在缺氧(37℃,3% O2,5% CO2)条件下的DMEM培养液中培养。
1.3.3 细胞增殖测定 CCK-8检测:将各组PASMCs培养48 h后,以每孔1×104个细胞接种在96孔板中,将10 μL CCK-8溶液加入到每个孔中,并将96孔板在37°C下再孵育1 h,在450 nm处测量吸光度(A)值。
EdU检测:按照EdU试剂盒说明书,各组细胞加入100 μL/孔稀释的EdU溶液,在CO2培养箱中孵育2 h,多聚甲醛固定、透化、洗涤后,加入100 μL的Hoechst 33342染色液进行细胞核染色,使用荧光显微镜观察拍照。
1.3.4 细胞凋亡测定 将各组PASMCs接种于96孔板中,加入5 μL Annexin Ⅴ-FITC和5 μL PI避光孵育15 min,用流式细胞仪检测细胞凋亡。
1.3.5 Western blot检测PASMCs蛋白表达 将各组PASMCs裂解后提取总蛋白,其余步骤与1.2.4相同,按照步骤检测PASMCs中YAP1、MST1、TAZ、Bcl-2、Bax蛋白表达。
1.4 统计学方法
2 结果
2.1 PD对各组大鼠RVSP和RVHI的影响
与对照组相比,模型组大鼠RVSP、RVHI显著升高(均P<0.05);与模型组相比,PD低、中、高剂量组大鼠RVSP、RVHI显著降低,且PD各组间差异有剂量依赖性(均P<0.05);与PD高剂量组相比,PD高剂量+XMU-MP-1组大鼠RVSP、RVHI显著升高(均P<0.05),见表1。

表1 各组大鼠RVSP和RVHI比较Table 1 Comparison of RVSP and RVHI of rats in
2.2 PD对各组大鼠肺组织病理变化的影响
HE染色结果显示,对照组大鼠肺动脉管壁完整光滑,细胞分布整齐致密,管壁薄而均匀,肌层无增厚;模型组大鼠肺动脉管壁明显增厚,管腔变窄,细胞排列方式紊乱;PD低、中、高剂量组肺动脉增厚减少,管腔变大,细胞排列整齐,且随PD剂量增加作用效果更明显;PD高剂量+XMU-MP-1组肺动脉管壁增厚,管腔变窄,见图1。与对照组相比,模型组大鼠WT%、WA%显著升高(均P<0.05);与模型组相比,PD低、中、高剂量组大鼠WT%、WA%显著降低,且PD各组间有剂量依赖性(均P<0.05);与PD高剂量组相比,PD高剂量+XMU-MP-1组大鼠WT%、WA%显著升高(均P<0.05),见表2。
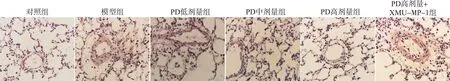
图1 各组大鼠肺组织HE染色图(×400)Fig.1 HE staining of lung tissue of rats in each group(×400)
表2 各组大鼠WT%、WA%比较Table 2 Comparison of WT and WA of rats in
2.3 PD对各组大鼠肺组织YAP1/TAZ通路蛋白变化的影响
与对照组相比,模型组大鼠YAP1、MST1、TAZ蛋白表达显著升高(均P<0.05);与模型组相比,PD低、中、高剂量组大鼠YAP1、MST1、TAZ蛋白表达显著降低,且PD各组间有剂量依赖性(均P<0.05);与PD高剂量组相比,PD高剂量+XMU-MP-1组大鼠YAP1、MST1、TAZ蛋白表达显著升高(均P<0.05),见图2、表3。

A:对照组;B:模型组;C:PD低剂量组;D:PD中剂量组;E:PD高剂量组;F:PD高剂量+XMU-MP-1组

表3 各组大鼠YAP1/TAZ通路蛋白表达比较Table 3 Comparison of YAP1/TAZ pathway protein expression of rats in each
2.4 PD对各组大鼠PASMCs细胞增殖的影响
与NC组相比,Hypoxia组细胞A450nm值、EdU阳性率显著升高(均P<0.05);与Hypoxia组相比,PD低、中、高剂量组细胞A450nm值、EdU阳性率显著降低,且PD各组间有剂量依赖性(均P<0.05);与PD高剂量组相比,PD高剂量+XMU-MP-1组组细胞A450nm值、EdU阳性率显著升高(均P<0.05),见图3、表4。
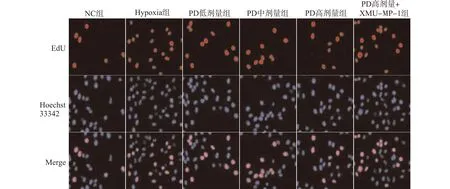
图3 各组PASMCs细胞增殖情况(×400)Fig.3 Proliferation of PASMCs in each group(×400)
表4 各组细胞A450nm值、EdU阳性率比较Table 4 The A450nm value and EdU positive rate of each
2.5 PD对各组大鼠PASMCs细胞凋亡的影响
与NC组[(8.16±0.93)%]相比,Hypoxia组细胞凋亡率[(4.54±0.85)%]显著降低(P<0.05);与Hypoxia组相比,PD低、中、高剂量组细胞凋亡率显著升高,分别为(5.38±0.66)%、(6.44±0.78)%、(7.85±0.86)%;且PD各组间有剂量依赖性(均P<0.05);与PD高剂量组相比,PD高剂量+XMU-MP-1组细胞凋亡率[(4.73±0.86)%]显著降低(P<0.05),见图4。

图4 各组PASMCs细胞凋亡情况Fig.4 Apoptosis of PASMCs cells in each group
2.6 PD对各组PASMCs细胞YAP1/TAZ通路和凋亡蛋白的影响
与NC组相比,Hypoxia组细胞YAP1、MST1、TAZ、Bcl-2蛋白表达显著升高,Bax表达显著降低(均P<0.05);与Hypoxia组相比,PD低、中、高剂量组细胞YAP1、MST1、TAZ、Bcl-2蛋白表达显著降低,Bax表达显著升高,且PD各组间有剂量依赖性(均P<0.05);与PD高剂量组相比,PD高剂量+XMU-MP-1组细胞YAP1、MST1、TAZ、Bcl-2蛋白表达显著升高,Bax表达显著降低(均P<0.05),见图5、表5。

A:NC组;B:Hypoxia组;C:PD低剂量组;D:PD中剂量组;E:PD高剂量组;F:PD高剂量+XMU-MP-1组
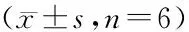
表5 各组细胞YAP1/TAZ通路及凋亡蛋白表达比较Table 5 Comparison of YAP1/TAZ pathway and apoptotic protein expression of cells in each
3 讨论
HPH是一种以肺血管收缩和血管重构为特征、恶性程度极高的心血管疾病,与成人肺血管相比,新生儿肺血管更容易受到缺氧损伤,具有较高的病死率。此外,新生儿HPH具有长期并发症,包括神经发育、认知和听力异常[11]。因此,阐明新生儿HPH发病的潜在机制具有必要性和紧迫性。本研究通过建立新生大鼠HPH模型,发现大鼠肺动脉管壁明显增厚,管腔变窄,RVSP、RVHI、WT%、WA%显著升高,表明新生大鼠HPH模型构建成功,大鼠出现肺血管重构和心力衰竭。PD具有显著的抗氧化、抗炎、抗肿瘤、免疫调节等生物学特性,还能调节细胞增殖和凋亡,减轻氧化应激和炎症反应,且毒副作用小,安全性高[12]。研究发现,PD已广泛用于多种心血管疾病的治疗,PD通过促进SIRT6介导的自噬来减轻脓毒性心肌病[13];PD还能通过抑制氧化应激和炎症反应发挥对糖尿病心肌损伤大鼠的心脏保护作用[14]。本研究中PD干预后,HPH新生大鼠肺动脉增厚减少,管腔变大,RVSP、RVHI、WT%、WA%显著降低,且PD各组间有剂量依赖性,表明PD对HPH新生大鼠心力衰竭和肺血管重构有改善作用。
HPH的发病机制复杂,与肺动脉细胞增殖、血管重构、抗凋亡增加和原位血栓形成有关,其中PASMCs过度增殖和凋亡抵抗是低氧性PASMCs在低氧性肺动脉重构和HPH中的标志性特征。研究发现,通过抑制PASMCs增殖可以保护小鼠免受缺氧引起的PH[15]。本研究中,缺氧环境下诱导的PASMCs的A450nm值、EdU阳性率、Bcl-2蛋白表达显著升高,凋亡率、Bax表达显著降低,表明缺氧促进PASMCs增殖,抑制凋亡,进而引发肺动脉血管重构。PD已被发现能够通过增强缺氧人PASMCs中SIRT1的表达来改善线粒体生物发生和功能[16]。本研究中PD干预后,缺氧诱导的PASMCs的A450nm值、EdU阳性率、Bcl-2蛋白表达降低,凋亡率、Bax表达升高,且PD各组间有剂量依赖性,表明PD能够抑制HPH新生大鼠PASMCs增殖,促进凋亡,改善肺动脉血管重构。
Hippo信号通路是一个进化上保守的通路,YAP1和TAZ是Hippo通路的关键效应分子,通过调节细胞增殖、凋亡和干细胞自我更新来控制器官大小[17]。Hippo通路包括MST1/2、LATS1/2以及下游的转录共激活因子YAP,MST1磷酸化后促进YAP的磷酸化,导致YAP滞留在细胞质中,被蛋白酶体降解。而去磷酸化的YAP位于细胞核中,与TAZ相互作用,促进靶基因表达[18]。Hippo通路的失调,通过激活YAP和TAZ,导致成体器官不受控制的增殖和抑制凋亡[19]。因此,Hippo/YAP信号通路是HPH的潜在治疗靶点。Zuo等[20]发现,通过下调LATS1和YAP的表达,抑制PASMCs的增殖和迁移,进而改善PH。Acharya等[21]发现,通过抑制YAP1/TAZ的激活,可以改善肺血管增生和PH。此外,Wang等[22]也发现,YAP上调促进Notch3的表达和激活,最终促进PASMCs过度增殖。因此,抑制YAP1/TAZ的激活可能具有抑制HPH大鼠PASMCs增殖的作用。PD已被发现能够通过抑制YAP表达和核易位来减轻糖尿病肾病中的肾小管间质纤维化[23]。本研究中PD处理后,缺氧诱导的肺组织和PASMCs细胞YAP1、MST1、TAZ蛋白表达显著降低,表明PD可能通过抑制YAP1/TAZ通路,抑制PASMCs增殖,改善新生大鼠HPH。而使用Hippo通路抑制剂XMU-MP-1可显著上调YAP1、MST1、TAZ蛋白表达,逆转PD对HPH新生大鼠肺血管重塑和PASMCs增殖的改善作用。进一步表明PD对HPH新生大鼠PASMCs增殖的抑制作用和对凋亡的促进作用是通过抑制YAP1/TAZ通路实现的。
综上所述,PD可能通过抑制YAP1/TAZ信号通路抑制HPH新生大鼠PASMCs增殖,促进凋亡。本研究为新生儿HPH的治疗提供了新思路。

