敲减NLRP3抑制LPS诱导BV2小胶质细胞的炎症反应*
徐鑫梓, 王 睿, 杜雅明, 刘 欣, 邵 卫, 陈国华, 王俊力△
1华中科技大学同济医学院附属武汉中西医结合医院神经内科,武汉 430022 2湖北中医药大学中医临床学院,武汉 430065
神经炎症是指由感染、创伤、毒素和自身免疫反应等引起发生在神经系统的炎症反应,主要表现为小胶质细胞和星形胶质细胞的活化,细胞因子和趋化因子的释放[1]。大量研究发现,持续过度的炎症反应是阿尔茨海默病、帕金森病、抑郁症等多种神经退行性疾病和神经精神疾病神经元损伤的共同病理基础[2-3]。LPS通过与小胶质细胞的Toll样受体4(Toll-like receptor 4,TLR4)结合,触发一系列细胞内信号级联反应,促使小胶质细胞向M1促炎表型转化[4]。其中,NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体是由胞质内模式识别受体参与组成的多蛋白复合物,在免疫调节和炎症过程中发挥着关键作用[5]。虽然有部分研究关注NLRP3炎性小体激活的负调控机制,但目前关于体外抑制NLRP3对LPS活化的BV2小胶质细胞的直接影响及其表现报道较少。因此,本研究以LPS诱导小鼠小胶质细胞BV2体外炎症模型为研究对象,通过shRNA基因干扰技术敲减细胞中NLRP3表达,进一步探讨NLRP3信号通路对LPS激活下的BV2细胞炎症损伤的影响。
1 材料与方法
1.1 实验主要试剂
LPS(来源于大肠埃希菌)购于Sigma公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素18(interleukin-18,IL-18)、IL-1β ELISA试剂盒购于伊莱瑞特生物科技股份有限公司;一氧化氮(nitric oxide,NO)试剂盒购于南京建成科技有限公司;小鼠源性重组离子钙结合衔接分子1(ionized calcium-binding adapter molecule 1,Iba1)抗体购于Abcam公司;兔抗Arginase-1(D4E3MTM)XP®Rabbit mAb购于Cell Signaling Technology公司;NLRP3单克隆抗体购于Affinity公司;兔抗iNOS单克隆抗体购于武汉三鹰生物技术有限公司。
1.2 方法
1.2.1 细胞培养 选用经鉴定合格的小鼠小胶质细胞BV2(武汉普诺赛生命科技有限公司,货号:CL-0493),使用含1%双抗、10%胎牛血清的DMEM培养液,于37℃、5%CO2的培养箱中培养,每2天换液1次,培养至对数生长期以备用。
1.2.2 NLRP3 shRNA载体构建 根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)提供的NLRP3的mRNA核苷酸序列(NM_001359638.1),设计3条siRNA干扰序列片段和1条阴性对照序列,均由上海吉玛基因化学技术有限公司合成,靶向序列为NLRP3-mus-2764:5′-GGUUCUGAGCUCCAACCAUTT-3′;NLRP3-mus-2411:5′-GGUCUCUUCUCAAG-UCUAATT-3′;NLRP3-mus-727:5′-CCAACUGGUCAAGGAGCAUTT-3′;shRNA-NC:5′-UUC-UCCGAACGUGUCACGUTT-3′。通过qRT-PCR选择干扰效率最高的序列构建shRNA。质粒pG2.2用BsaⅠ酶切,1%琼脂糖凝胶回收大片段。用T4DNA连接酶将稀释退火后的shRNA-NLRP3片段与线性化的pG2.2载体连接,取10 μL连接产物转化感受态细胞,涂板挑取单菌落摇菌按试剂盒说明书小量提取质粒,用SacⅠ做酶切鉴定、测序鉴定是否为阳性克隆,测序无误后大规模提取shRNA-NLRP3质粒。以阴性对照(negative control,NC)序列作为对照,构建方法同上。
1.2.3 稳定转染BV2细胞系构建 转染前,将5×105个细胞重悬于1.5 mL DMEM培养液中。用Opti-MEM稀释Lipofectamine 2000脂质体,将测序正确的pG2.2-mus-NLRP3质粒载体转染BV2细胞,37℃培养72 h后检测转染效率,筛选获得稳定转染的BV2细胞进行后续研究。
1.2.4 LPS刺激致BV2细胞炎症模型的制备 取对数生长期转染后BV2细胞,调整细胞密度为1×104个/mL,按每孔2 mL接种于6孔培养板,分为4组并进行相应处理:空白对照组、对照组、阴性对照组(转染阴性对照NC shRNA质粒)、shNLRP3组(转染NLRP3 shRNA质粒)。除空白对照组外,其余组均使用1 μg/mL的LPS处理24 h。
1.2.5 ELISA检测TNF-α、IL-4、IL-18和IL-1β蛋白含量 取各组BV2细胞上清液,用ELISA试剂盒检测各组BV2上清液中TNF-α、IL-4、IL-18和IL-1β蛋白含量。
1.2.6 免疫荧光染色检测BV2细胞Arg-1/Iba1、iNOS/Iba1表达 取各组BV2细胞,用胰酶消化后制作爬片。24 h后取出爬片在培养板中用PBS浸洗3次,加入4%多聚甲醛固定15 min,加入0.5%的Triton X-100室温通透20 min,正常山羊血清室温封闭30 min,加入一抗Anti-Iba1抗体、Arginase-1(Arg-1)抗体、iNOS抗体(稀释比均为1∶100),4℃孵育过夜。次日,PBS清洗3次后,分别加入Cy3标记的山羊抗小鼠IgG(1∶100)和FITC标记的羊抗兔IgG(1∶100),避光室温孵育1 h,DAPI避光孵育5 min,用含抗荧光淬灭剂的封片液封片,在荧光显微镜下观察并采集图像。
1.2.7 Western blot检测NLRP3表达 取各组BV2细胞,离心后去上清加入蛋白裂解液,置于冰上裂解30 min后在12000 r/min、4℃条件下离心5 min,取上清液,使用BCA法测定蛋白浓度。每孔加40 μg蛋白样品,经10%SDS-PAGE电泳分离后,GAPDH条带以200 mA、90 min转至PVDF膜,NLRP3条带以200 mA、120 min后300 mA、30 min转至PVDF膜。室温下使用5%脱脂牛奶封闭2 h,用封闭液稀释相应的一抗GAPDH(1∶1000)和NLRP3(1∶800)4℃孵育过夜。用TBST稀释HRP标记羊抗兔二抗(1∶10000稀释),室温摇床孵育2 h,使用ECL化学发光法X光胶片压片、扫描,用Image-pro plus分析胶片灰度值。
1.3 统计学方法
2 结果
2.1 shRNA质粒表达载体构建
与对照组相比,NC序列转染组NLRP3 mRNA的表达差异无统计学意义(P>0.05),各干扰序列组(NLRP3-mus-2764组、NLRP3-mus-2411组、NLRP3-mus-727组)的NLRP3 mRNA表达显著降低(均P<0.01,图1A),其中NLRP3-mus-727组表达最低,沉默效果最好,因此本研究选用NLRP3-mus-727作为干扰序列构建shRNA进行后续实验。质粒载体pG2.2原本含一个SacⅠ的酶切位点,设计干扰片段时人为地引入另一个SacⅠ的酶切位点。当质粒被SacⅠ酶切出约600 bp的DNA条带时,说明目的退火片段成功插入pG2.2载体(图1B)。

A:qRT-PCR筛选NLRP3干扰序列,与对照组比较,**P<0.01;B:质粒酶切产物琼脂糖凝胶电泳鉴定,M:标准DNA,1:pG2.2-mus-NLRP3质粒,2:pG2.2-NC质粒
2.2 重组NLRP3 shRNA表达质粒的DNA测序及Western blot检测结果
插入shNLRP3和shNC片段的重组质粒基因测序结果显示,插入的碱基序列与设计shRNA片段完全一致。与对照组相比,经LPS处理后的阴性对照组BV2细胞NLRP3蛋白表达水平差异无统计学意义;与阴性对照组相比,shNLRP3组的BV2细胞NLRP3蛋白表达量明显降低(P<0.01,图2)。

1:空白对照组,2:对照组,3:阴性对照组,4:shNLRP3组;A:NLRP3蛋白表达条带;B:NLRP3蛋白表达水平统计图;C:shNLRP3与shNC重组质粒基因测序图;与空白对照组比较,**P<0.01;与阴性对照组比较,##P<0.01
2.3 敲减NLRP3基因对小胶质细胞形态学的影响
如图3A所示,空白对照组BV2细胞为静息态,呈圆形、短梭形,细胞数量较多,胞体小,细胞上有细长突起,呈毛刺样,高度分支;LPS诱导下的对照组细胞数量相对减少,胞体增大,呈梭形或杆状的“激活态”,突起回缩变短,呈“阿米巴”状,如图3B。阴性对照组BV2细胞形态与对照组类似(图3C)。shNLRP3组细胞与空白对照组形态相似(图3D)。

A:空白对照组;B:对照组;C:阴性对照组;D:shNLRP3组
2.4 敲减NLRP3基因对小胶质细胞炎症反应的影响
如图4所示,与空白对照组相比,对照组BV2细胞炎症因子IL-18、IL-1β、TNF-α和NO的分泌量明显增加(均P<0.01);与阴性对照组相比,shNLRP3组细胞炎症因子和NO的分泌量明显降低(均P<0.01);阴性对照组与对照组相比差异无统计学意义(均P>0.05),提示敲减NLRP3可抑制LPS诱导下的BV2炎症反应,减少促炎性介质分泌。

1:空白对照组;2:对照组;3:阴性对照组;4:shNLRP3组;与空白对照组比较,**P<0.01;与阴性对照组比较,##P<0.01
2.5 敲减NLRP3基因对小胶质细胞活化标志蛋白的影响
如图5免疫荧光检测结果显示,未诱导的空白对照组BV2细胞iNOS/Iba1相对表达量较低,Arg-1/Iba1相对表达量较高;与空白对照组相比,对照组与阴性对照组iNOS/Iba1相对表达量明显升高,Arg-1表达下降,差异均有统计学意义(均P<0.01);与阴性对照组比较,shNLRP3组iNOS/Iba1相对表达量下降,Arg-1/Iba1上调(均P<0.01),提示敲减NLRP3可抑制小胶质细胞活化,促使其向M2表型极化。
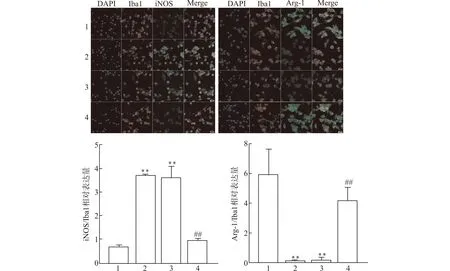
1:空白对照组;2:对照组;3:阴性对照组;4:shNLRP3组;与空白对照组比较,**P<0.01;与阴性对照组比较,##P<0.01
3 讨论
神经炎症是指中枢神经系统在各种内、外源性因素刺激下(如错误折叠的蛋白质、毒素和病原体)所产生的一系列免疫反应,主要表现为脑组织炎性细胞浸润、胶质增生、神经元丧失等[6]。一般认为,这种免疫反应主要由神经免疫细胞活化后产生的促炎因子所引发,例如细胞因子和趋化因子。在癫痫、神经退行性疾病、抑郁症等多种神经精神系统疾病中,这些促炎因子可以通过抑制神经元分化、诱导神经元凋亡和坏死、增加兴奋性神经递质产生、破坏血脑屏障通透性等途径导致神经元损伤,在疾病的发生和进展中发挥重要作用[7]。因此,抑制神经炎症可能是多种神经精神系统疾病防治的重要策略之一。
小胶质细胞被认为是驻留在中枢神经系统的巨噬细胞,在生理情况下呈现高度分支的“静息态”,发挥免疫监视、清除细胞碎片、突触修剪等作用;当受到病原体、损伤组织等各种预警分子信号刺激时,小胶质细胞上的模式识别受体(pattern recognition receptors,PRRs)能够迅速响应,在数分钟内转换为胞体增大、突起缩短的“阿米巴”状活化态,然后通过胞饮、吞噬或受体介导的内吞作用将致病物质内化并降解。在IL-2、IL-13刺激时,小胶质细胞则转换为替代激活的抗炎表型(M2型),偏向分泌具有神经保护作用的Arg-1、IL-10、转化生长因子β(TGF-β)、神经营养因子等物质[8]。但值得注意的是,小胶质细胞的表型极化在疾病状态下是一个动态转化的过程,M1/M2表型在时间、空间上呈现为相对重合的“谱系”状态[9]。因此,小胶质细胞的激活被认为是神经炎症的关键指征,通过干预表型转换来调节神经炎症反应的转归方向,使炎症结果向抗炎保护方向演变,是干预多种神经系统疾病发生发展的有效方案之一。本研究结果显示,LPS能够诱导BV2小胶质细胞激活,细胞呈现胞体增大的“阿米巴”状活化态,并向高表达iNOS的M1表型极化,释放大量促炎因子,促进神经炎症反应。
NLRP3蛋白是NLRP3炎性小体的核心组成成分,广泛存在于中枢神经系统,并在小胶质细胞中大量表达。作为PRRs之一,NLRP3能够识别外源性或内源性病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),活化下游转录核因子-κB,磷酸化并降解IκBα、NF-κB p65发生核移位,启动靶基因转录,上调NLRP3、IL-1β和IL-18前体表达;然后在胞内或胞外PAMPs和DAMPs的刺激下装配NLRP3炎症复合体,释放成熟的炎性因子IL-1β和IL-18,并激活Gasdermin D导致小胶质细胞膜裂解,进一步释放更多的炎性因子[10]。本研究证实,体外环境下应用shRNA敲减NLRP3基因表达能够抑制IL-1β、IL-18释放,促进小胶质细胞M1型向M2型表型转化,上调Arg-1/Iba1表达、抑制iNOS/Iba1表达,同时减少TNF-α、NO等毒性物质释放,减轻中枢炎性损伤。
综上所述,本研究采用LPS致BV2小胶质细胞活化的炎症模型,探讨NLRP3基因干扰shRNA技术对小胶质细胞激活的作用,结果显示敲减NLRP3表达可以显著抑制小胶质细胞活化,增加小胶质细胞M2型标志物(Arg-1)的表达,降低M1型标志物(iNOS)表达,下调炎性因子IL-1β、IL-18、TNF-α及NO分泌,从而发挥抑制炎症反应的作用,但对具体作用机制仍需进一步探讨。

