地质聚合物管状无机膜固定化碳酸酐酶用于CO2捕获
赵宝中, 贺艳, 邓兴发, 肖培, 崔学民*
(1.广西大学 化学与化工学院, 广西 南宁 530004;2.广西石化资源加工及过程强化技术重点实验室, 广西 南宁 530004)
0 引言
膜接触器(membrane contactor, MC)是一种用于CO2分离的气液接触装置,具有占地面积小、操作灵活、可模块化等优点[1-2],有望替代目前工业应用中占地面积大、能耗高、易出现起泡、溢流等问题的传统填料吸收塔[3]。由于接触器使用的胺类吸收溶剂具有毒性和腐蚀性,对环境造成较大的危害[4-7],且较难解决高二氧化碳反应速率和低再生能耗之间的矛盾,因此需要寻求一种绿色环保的催化剂并使用良性溶剂用于燃烧后碳捕获[8-9],对从烟道气中将温室气体的集中处理来抑制大量CO2排放造成的全球气候问题具有重要的现实意义[10-11]。
碳酸酐酶(carbonic anhydrase, CA)是一种可高效催化CO2水合反应的含锌生物酶,可以在良性溶剂中实现对CO2的高效催化转化,据报道,在CA催化下,CO2的水合速率可以提高数千万倍[12]。CA本身具有环保、无毒、可生物降解等优势,将CA在良性溶剂中催化CO2高效水合反应与易得的膜技术结合起来具有许多优点,不仅提高了CA的循环使用性能,并且固定在载体上的CA对于环境适应性也显著增强[13],且吸收装置成本低,对CO2选择性高,易于线性放大,环境友好。最早Suchdeo等[14]尝试将CA溶解在溶液中,并用2层疏水膜夹住该溶液来制备液膜反应器,然而这种膜稳定性差且液膜蒸发限制了反应器的长期运行。Hou等[15]将碳纳米管(carbon nanotubes, CNTs)涂覆在聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上,制备了Janus膜,该膜具有亲水-超疏水性,在亲水侧负载CA可以保留30%的CA活性,然而这种膜制备难度大,难以进一步利用。Xu等[16]在PVDF中空纤维膜一侧固定CA,但是难以克服PVDF材料浸泡在溶剂中因膜润湿和溶胀而带来的CO2通量显著降低的问题。Rasouli等[2]制备了有机物改性的聚丙烯(polypropylene, PP)平板膜用于CA固定化,可以获得54.3%的CA负载率和19.4%的酶活回收率,尽管获得了比较高的酶固定化收率,但是由于共价固定和有机物对CA结构的不利影响,因此酶的固定化效率有所降低。目前固定CA的膜接触器均以有机聚合物膜为主,在反应器连续运行时,基底材料的特性导致的堵孔问题使得CO2传质动力学降低。综合已发表的成果,由于目前用于固定CA的载体普遍存在制备方法复杂、成膜强度低的问题,因此难以实际应用[17-18]。
无机膜具有耐高温、耐酸碱、强度高、制作成本低等诸多优点,被广泛用于气固分离、液固分离、液液分离、光电催化等领域[19]。Merle等[20]使用电聚合的方法在大孔隙率的大孔碳泡沫上负载CA,该方法获得的固定化酶在70 ℃的胺溶剂中静置42 d后保留了40%的初始活性,显著提高了CA的热稳定性,但是大孔材料的使用无法有效地提高CA的负载量。地质聚合物是一种由[SiO4]和[AlO4]-四面体单元组成的具有三维网络状结构的凝胶材料,其结构类似于介孔沸石材料,可以用偏高岭土或工业废料(矿渣、粉煤灰、硅灰等)在100 ℃以下、碱性溶液激发下绿色环保地制备[21],整个制备过程操作简单,几乎没有温室气体产生[22]。由于地质聚合物具有与CA分子直径匹配的介孔结构,可以提供充足的比表面积,这是大多数有机材料所不具备的特性,并且内部富含羟基,可以很方便地用各种富官能团的化合物进行化学修饰[23],因此是固定CA理想的候选材料。
为了解决目前普遍存在的CA固定化载体难以规模化生产和工业化应用的问题,本研究中设计了地质聚合物管状无机膜用于负载CA。该膜以来源广泛的偏高岭土和工业废弃物高炉矿渣为原料,在60 ℃下通过一步法工艺制备,整个制备过程绿色环保,操作简单,易于放大,可规模化生产。本文中通过应用交联剂戊二醛预先修饰膜材料介孔结构,用循环过滤的方式负载了CA,探索了将CA固定在地质聚合物管状无机膜上的最佳条件,研究了获得的固定化酶的酶学性质,测试了固定化酶复合膜在CO2捕获和分离中的表现,并对固定化酶复合膜进行了长时间的循环使用性能测试。
1 实验
1.1 材料与仪器
主要实验原料:偏高岭土(内蒙古超牌高岭土有限公司)、粒状高炉矿渣〔广西北海诚德(集团)有限公司〕,它们的化学成分和质量分数见表1。其他实验材料还有钠水玻璃(南宁市大成化工有限责任公司);氢氧化钠(质量分数为96%)、过氧化氢(质量分数为30%)、十二烷基硫酸钠和氯化钙(广东光华科技股份有限公司);乙腈、乙酸对硝基苯酯(p-nitrophenyl acetate,p-NPA)和对硝基酚(p-nitrophenol, p-NP)(上海麦克林生化科技股份有限公司);三(羟甲基)氨基甲烷〔tris(hydroxymethyl)aminomethane,Tris〕、戊二醛(国药集团化学试剂有限公司);碳酸酐酶(牛红细胞,美国Sigma-Aldrich公司);去离子水(广西大学化学化工学院)。

表1 偏高岭土、粒状高炉矿渣的化学成分和质量分数Tab.1 Chemical composition and content of metakaolin and granulated blast furnace slag 单位:%
采用N2吸附仪(Gemini VII2390型,美国Micromeritics公司)测定样品的结构特征和孔隙特性,通过场发射扫描电子显微镜(Hitachi SU8220型,日本Hitachi公司)观察溅射金属后的形貌,使用傅里叶红外光谱仪(Nicolet iS50型,美国Nicolet公司)分析样品表面官能团信息,X射线粉末衍射(MiniFlex600型,日本Hitachi Rigaku公司)用于分析固体样品的结晶度,采用X射线光电子能谱仪(Thermo Scientific K-Alpha型,美国Thermo Fisher科技公司)测定样品的原子质量分数,使用紫外-可见分光光度计(UV-2600型,日本Shimadzu公司)测定溶液样品的吸光度。
1.2 地质聚合物管状无机膜的制备与酶活性测试
1.2.1 地质聚合物管状无机膜的制备
固定化酶复合膜的制备与性能测试流程如图1所示。
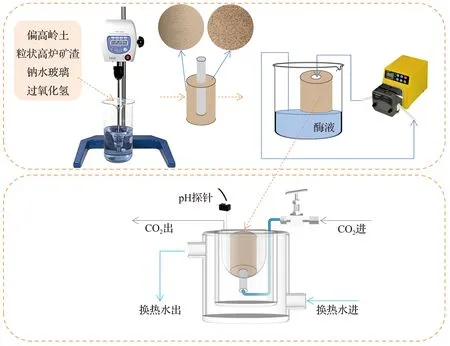
图1 固定化酶复合膜的制备与性能测试流程Fig.1 Preparation and performance testing process of immobilized enzyme composite membrane
将偏高岭土、粒状高炉矿渣各25.00 g混合均匀,加入模数为1.3的钠水玻璃50.00 g及去离子水6.25 g,搅拌机以转速为2 000 r/min搅拌2 min,随后加入十二烷基硫酸钠0.06 g、质量分数为30%的过氧化氢1.00 g,继续搅拌1 min得到铸模浆料。将浆料均匀倒入圆柱管式模具中,放在振荡台上振荡1 min,然后放入60 ℃烘箱中养护24 h。脱模,得到实验所需的地质聚合物管状无机膜。由于制备的地质聚合物管状无机膜是碱激发材料,因此在正式实验前要对地质聚合物管状无机膜进行清洗,以去除材料中残留的碱。
1.2.2 CA固定化
选择高度为6 cm、外直径为3 cm、内直径为1 cm的地质聚合物管状无机膜为实验载体。将质量分数为0.4%的戊二醛溶液5 mL 注入地质聚合物管状无机膜内表面,在重力作用下,戊二醛溶液会从膜内表面通过膜,再从膜外表面渗出。收集渗出的液体,将其再次注入膜内表面,持续30 min。
随后以被戊二醛修饰过的地质聚合物管状无机膜为实验对象,将含有1 mg CA的Tris-HCl缓冲溶液5 mL(pH=8.0,0.05 mol/L)注入地质聚合物管状无机膜内表面,以同样的方式循环负载2 h,收集负载后的滤液,记为A液。用Tris-HCl缓冲溶液5 mL 清洗管式膜3次,获得固定化酶复合膜,收集洗剂液,记为B液。混合A液、B液,用Bradford法[24]测定A、B混合液中的酶量,用差量法即可得到固定化酶复合膜的CA负载量。将固定化酶复合膜浸入Tris-HCl缓冲溶液(pH=8.0,0.05 mol/L)中,在4 ℃下贮存。
采用控制变量的方法研究在负载过程中温度、pH值、膜厚度、戊二醛用量、改性时间、交联时间等条件对固定化过程的影响。
1.2.3 酶活性测试
由于CA对p-NPA具有较强的亲和性[25],因此采用酶酯法检测游离酶和固定化酶复合膜的活性。
① 游离酶活性测试。将浓度为3 mmol/L的p-NPA(乙腈为溶剂)0.1 mL 与Tris-HCl缓冲液4 mL(pH=8.0,0.05 mol/L)混合均匀,加入酶液1 mL,用紫外-可见分光光度计测定溶液在波长为348 nm、反应时间为3 min的吸光度值,以不加酶的缓冲液为空白对照。
② 固定化酶复合膜活性测试。将浓度为3 mmol/L的p-NPA(乙腈为溶剂)0.1 mL 与Tris-HCl缓冲液5 mL (pH=8.0,0.05 mol/L)混合均匀,将溶液注入固定化酶复合膜的内表面,使液体与固定化酶复合膜循环接触,用紫外-可见分光光度计测定溶液在波长为348 nm、反应时间为3 min的吸光度值,以洗碱后未负载酶的地质聚合物管状无机膜为空白对照。固定化效率通过酶活性回收率和相对酶活来描述[26-27]。
1.3 酶学性质研究
为了测定环境温度、pH值对酶活性的影响,以不同温度处理酶4 h测定其热稳定性,在温度为4 ℃下长时间贮存来测定其贮藏稳定性,多次循环使用测定酶的循环使用性能。
1.4 测定动力学常数
为了获得游离酶与固定化酶复合膜的表观动力学参数,用紫外-可见分光光度计测定游离酶和固定化酶复合膜催化不同浓度(0.5、1、3、5、10 mmol/L)的p-NPA溶液的水解速率,根据反应速率与底物浓度的关系绘制双倒数图。酶促反应速率与底物浓度的关系由Lineweaver-Burk双倒数方程给出。
1.5 CO2捕获和分离性能测试
为了探索酶负载量、CO2流速、pH值、温度及长时间的循环流动测试对固定化酶复合膜捕获CO2性能的影响,将固定化酶复合膜放置在如图1所示气密性良好的实验装置上,将Tris-HCl缓冲溶液100 mL (pH=8.0,0.05 mol/L)注入反应器中,同时开启换热装置,当缓冲溶液以及固定化酶复合膜温度达到25 ℃时,开启CO2阀门并开始计时,控制CO2气流(质量分数为99.9%)体积流量为100 mL/min,记录缓冲溶液pH值降为7.0以及pH值不再减小所需的时间,当pH值在30 s内不再发生变化时关闭CO2阀门,立即转移反应后的缓冲溶液到150 mL烧杯中,加入浓度为0.1 mol/L的Tris溶液15 mL、浓度为2.5 mol/L的CaCl2溶液5 mL,此时溶液立刻浑浊,用玻璃棒搅拌均匀后,立刻用保鲜膜封口,静置1 h后过滤,烘干滤渣并称重。
2 结果与讨论
2.1 地质聚合物管状无机膜的结构特征
通过调整膜制备过程中过氧化氢的用量,制备出了6种不同水通量的地质聚合物管状无机膜,其结构参数见表2。
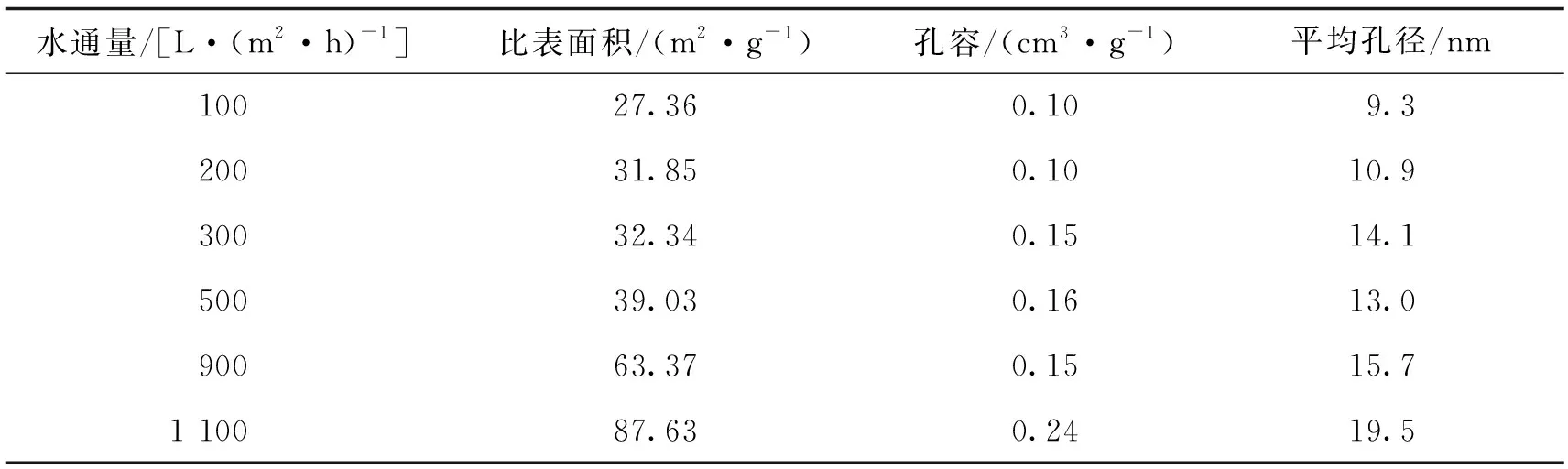
表2 6种地质聚合物管状无机膜的结构参数Tab.2 Structural parameters of six geopolymer tubular inorganic membrane pores
从表2可见,一方面,水通量较大的膜具有较大的比表面积,意味着该膜能提供更多的酶附着位点;另一方面,随着制备的地质聚合物管状无机膜水通量不断增大,其平均孔径迅速变大。尽管平均孔径更大的膜比表面积也很大,但根据以往的经验,这不利于酶的负载[28],因此,在权衡利弊后,本文中选择了水通量为900 L/(m2·h)的地质聚合物管状无机膜进行后续实验。此外,由于CA分子的颗粒尺寸约为5 nm×4 nm×4 nm(长度×宽度×高度)[28],这种材料丰富的介孔结构为酶的负载提供了足够的结合位点,这是获得良好酶固定效果的基础[29]。
2.2 负载的最优化研究
为了获得酶活性回收率最大的固定化酶复合膜,采用单变量法对影响碳酸酐酶固定效果的因素进行充分研究。不同操作条件对固定碳酸酐酶的影响如图2所示。

(a) 温度
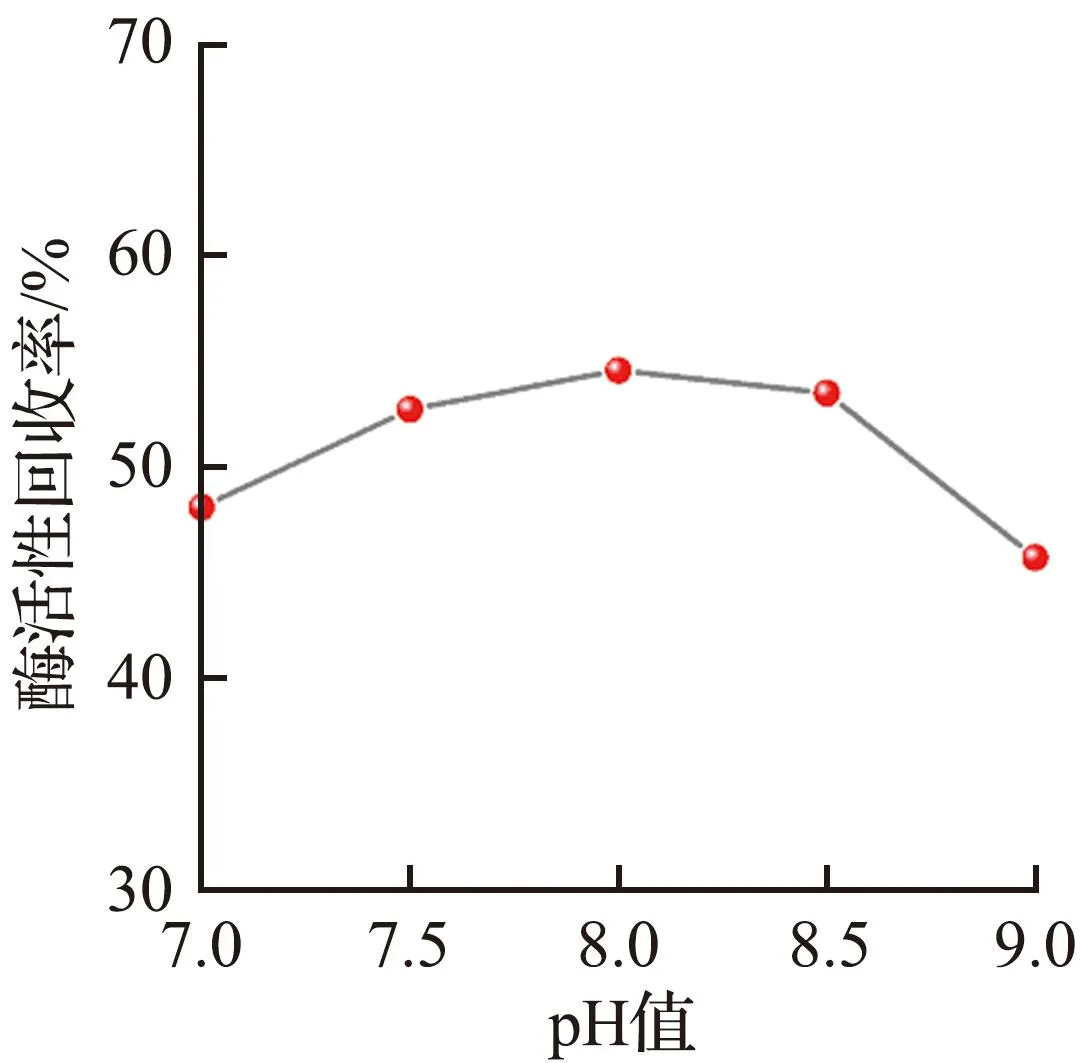
(b) pH值

(c) 膜厚度
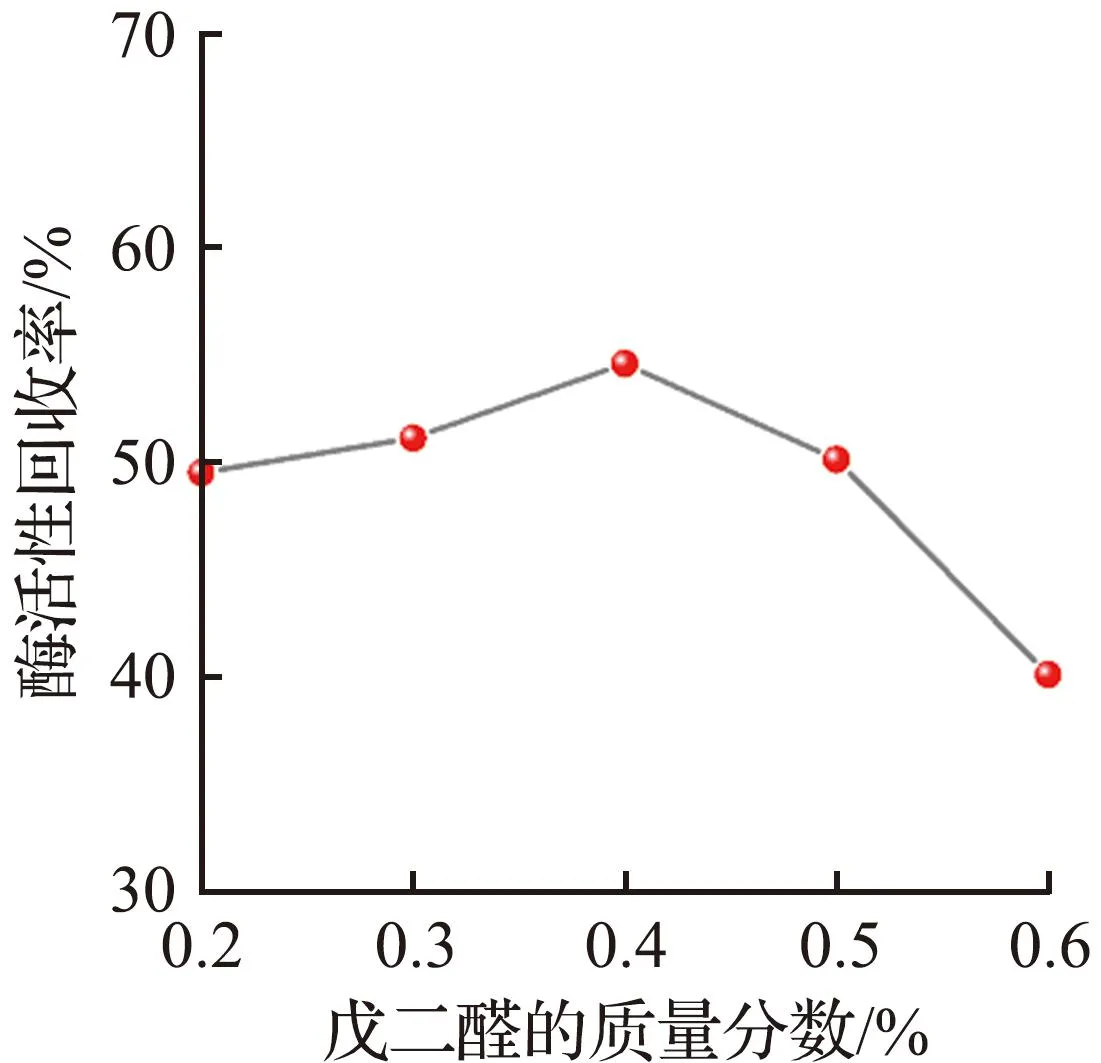
(d) 戊二醛用量

(e) 改性时间

(f) 交联时间图2 不同操作条件对固定碳酸酐酶的影响Fig.2 Effects of different operating conditions on the immobilization of CA
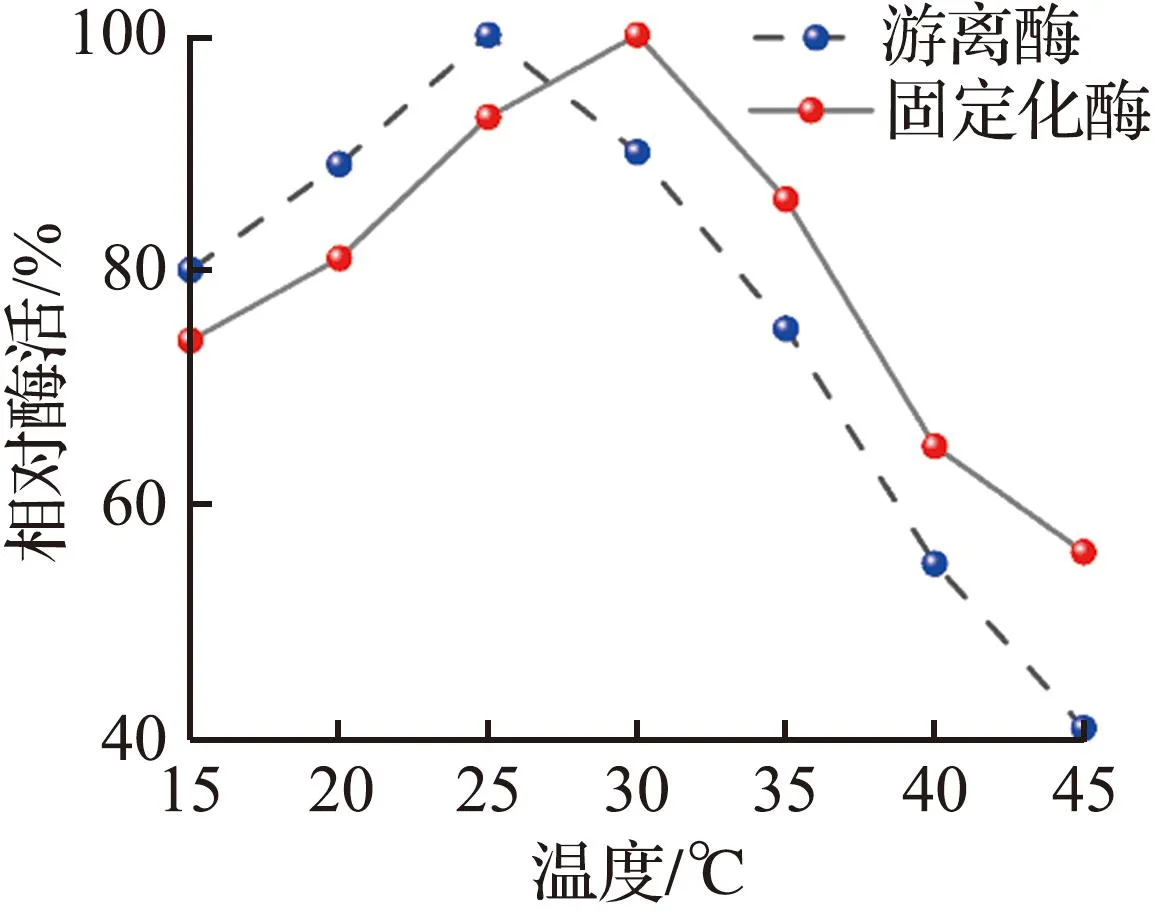
从图2可见,温度、pH值和戊二醛用量(质量分数)对酶负载有显著影响。温度过低或过高、环境过酸或过碱都不利于酶的固定。当温度低于30 ℃时,酶分子在膜中的扩散速度较慢;当温度高于30 ℃或处于强酸或强碱环境中时,酶分子结构容易受到破坏,导致固定过程中大量酶活性丧失。
重要的是,戊二醛作为一种交联剂,在固定化过程中影响很大。当戊二醛的质量分数小于0.4%时,固定化酶复合膜的酶活性回收率随戊二醛用量的增加而增大,然而,当戊二醛的质量分数大于0.4%时,戊二醛的强交联作用破坏了酶的分子结构,酶的活性回收率迅速减小。这种情况下虽然CA可以被固定在地质聚合物管状无机膜上,但活性却大大降低。实验过程中发现,膜的厚度对酶的负载量没有明显影响,负载过程主要取决于无机膜对酶分子的截留作用,因此,孔径大小以及酶分子在流经孔隙的过程中与地聚物表面的相互作用在酶固定化过程中起着非常重要的作用。
根据上述对负载过程的深入研究,得出制备性能最好的固定化酶复合膜的最佳条件为:pH值为8.0,温度为30 ℃,膜厚度为7 mm,戊二醛的质量分数为0.4%,改性时间为1.5 h,交联时间为2 h。
2.3 酶学性质
2.3.1 温度、pH值对酶活性的影响
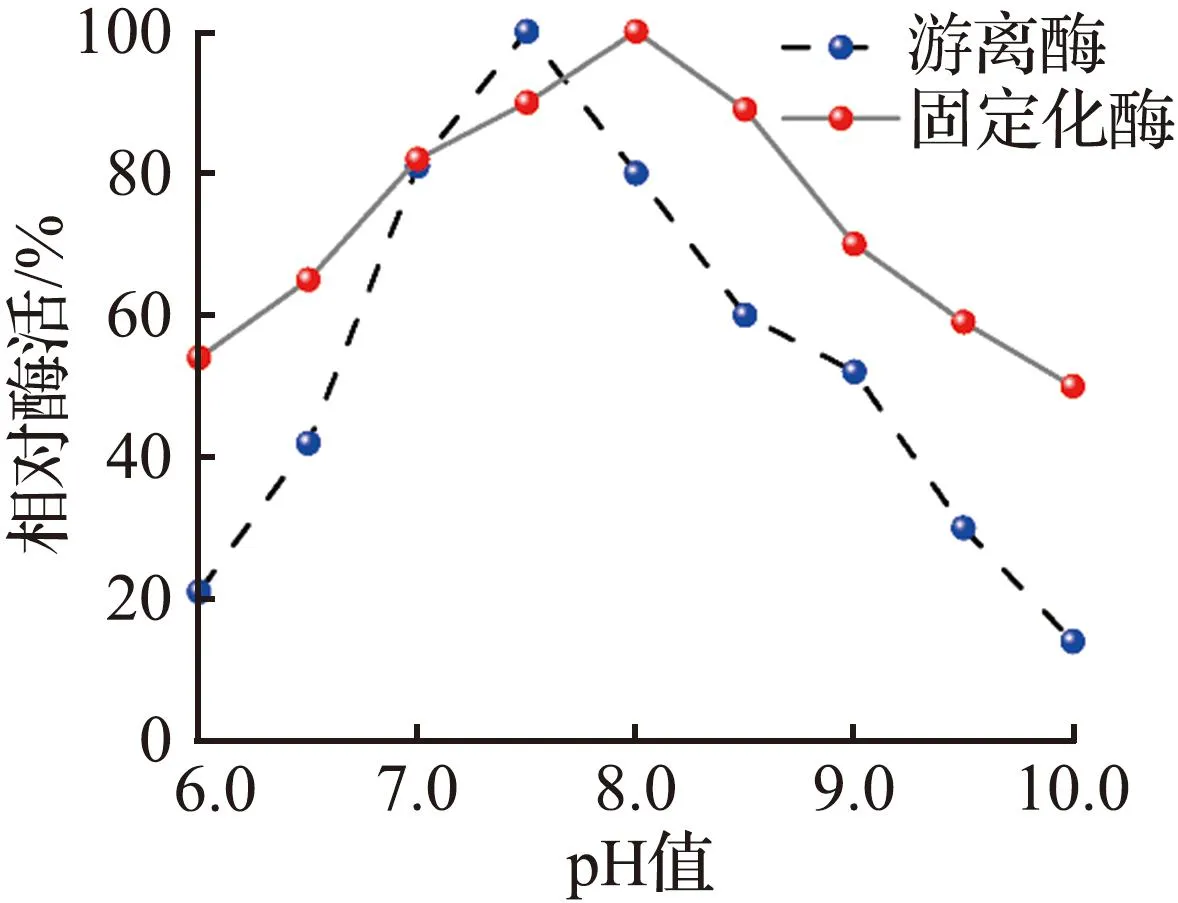
游离酶和固定化酶复合膜的酶学性质如图3所示。其中图3(a)、图3(b)分别对比了在不同温度、pH值时的固定化酶复合膜和游离酶的活性。从图3(a)可见,固定化酶复合膜的最适反应温度相比游离酶提高了5 ℃,说明游离酶与地质聚合物管状无机膜结合后对环境温度的容忍性有所提高[13]。从图3(b)可见,最适反应pH值从7.5提高到8.0,相对游离酶在一定程度上的pH值变化,固定化酶复合膜的活性降幅更小,说明CA固定化后,对pH值具有了一定的缓冲能力[13]。
(a) 温度对酶活性的影响
(b) pH值对酶活性的影响
(c) 不同温度处理4 h后酶的活性
(d) 4 ℃下贮藏若干天后酶的活性
(e) 固定化酶的循环性能
(f) 酶的Lineweaver-Burk双倒数图图3 游离酶和固定化酶复合膜的酶学性质Fig.3 Enzymatic properties of free and immobilized enzyme composite membrane
2.3.2 酶的热稳定性、贮藏稳定性和循环使用性能
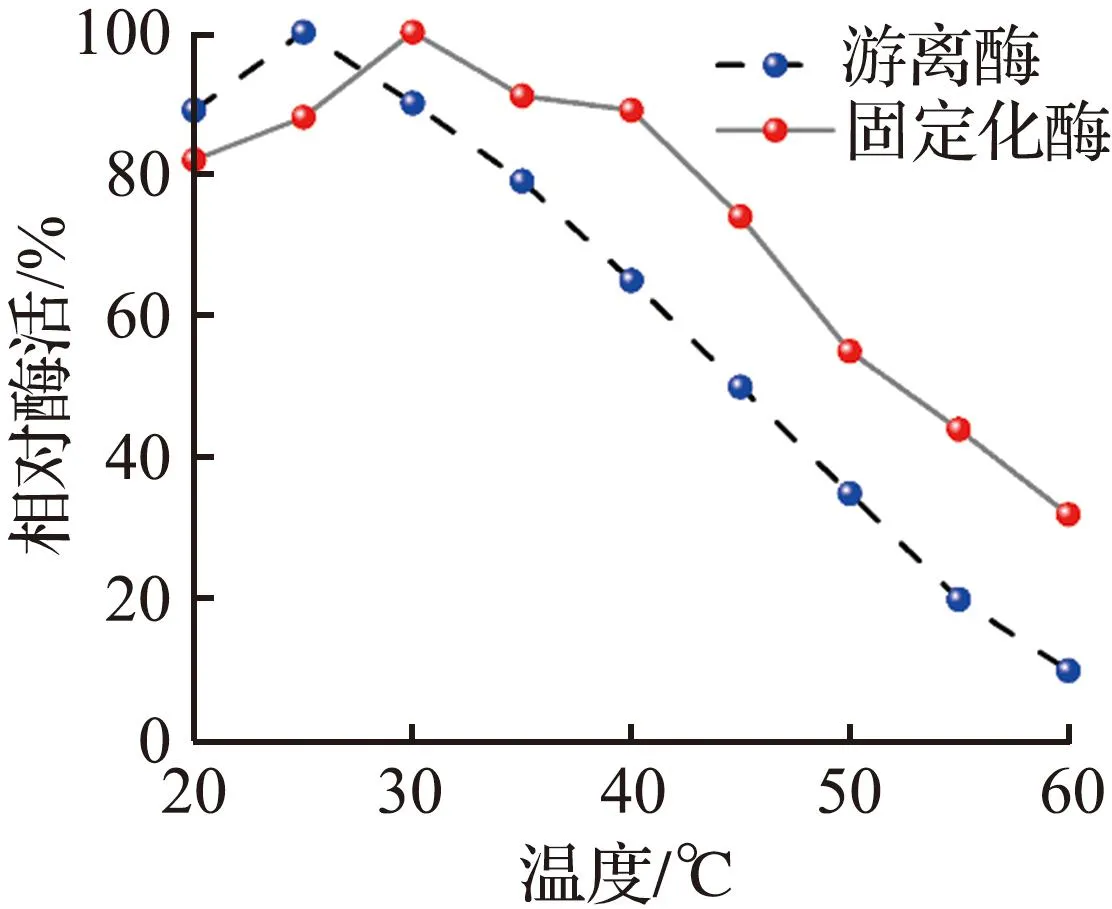
选取最佳固定化条件下得到的固定化酶复合膜和游离酶进行了热稳定性测试,结果如图3(c)所示。固定化酶复合膜在30 ℃达到最佳反应活性。随着温度的继续升高,固定化酶复合膜的活性均高于游离酶的活性,当温度达到60 ℃,游离酶活性剩余10.1%,而固定化酶复合膜活性仍然可以保留32.0%,说明固定化酶复合膜相对游离酶对高温的容忍性更强,原因是酶分子与地质聚合物管状无机膜的多点固定限制了酶的构象灵活性[30]。
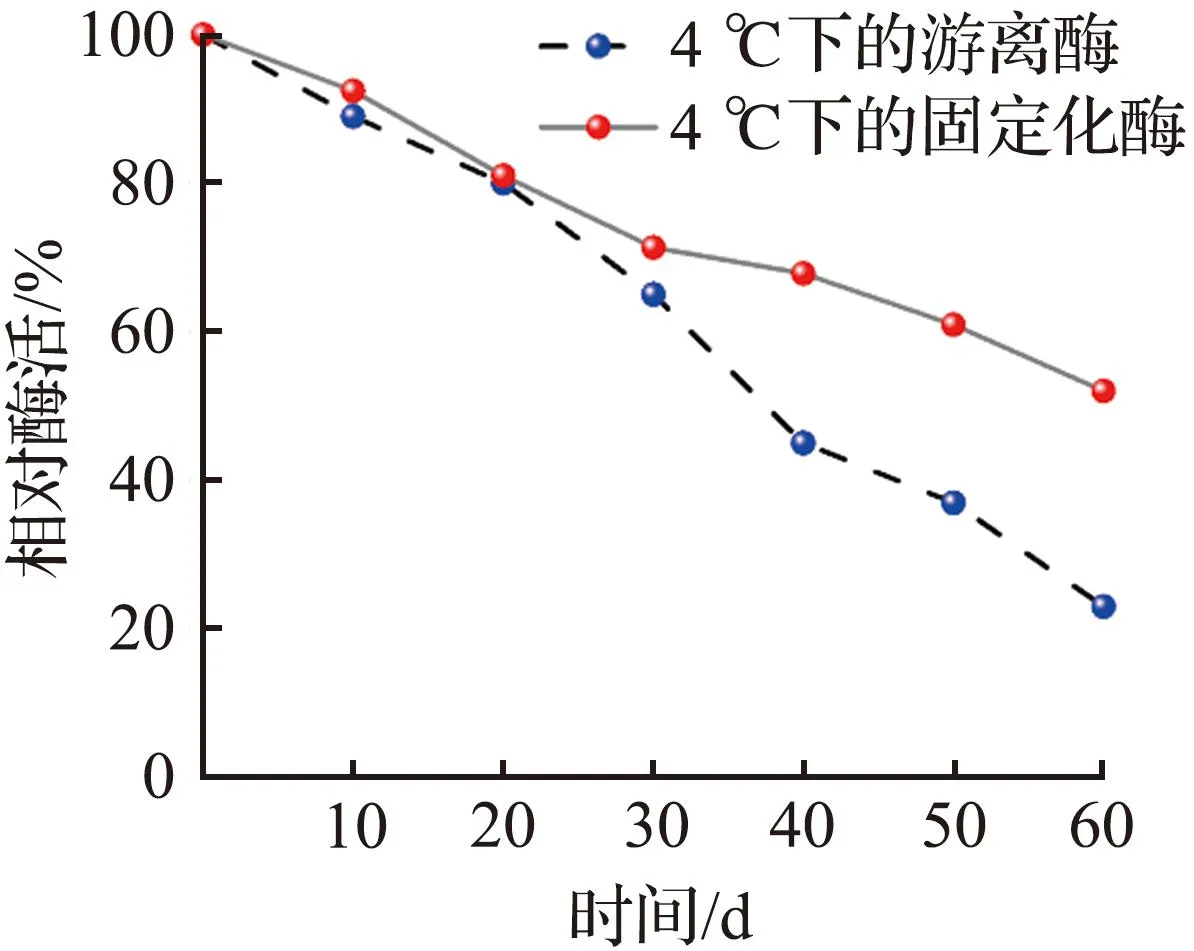
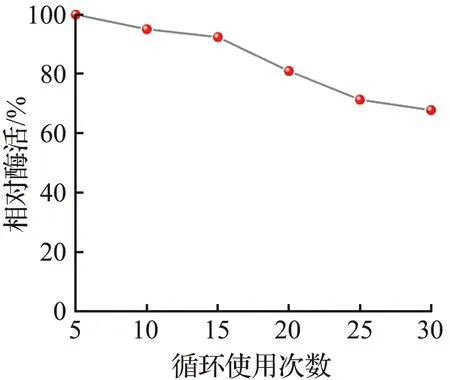
在4 ℃下贮藏60 d后,固定化酶复合膜仍保留了52.0%的相对活性,而游离酶仅剩余23.0%的相对活性[图3(d)],说明固定化CA具有较好的贮藏稳定性,原因是酶分子固定在地质聚合物管状无机膜上限制了酶分子自身的运动[31]。以上结果表明,固定化酶复合膜比游离形式更耐热,并且在整个时间周期内表现出良好的储存稳定性。经过连续30次循环使用,固定化酶复合膜仍能保留67.8%的相对活性[图3(e)],活性降幅较少,说明固定化酶复合膜酶浸出较少[32],酶的固定化效果优异。
2.4 动力学常数
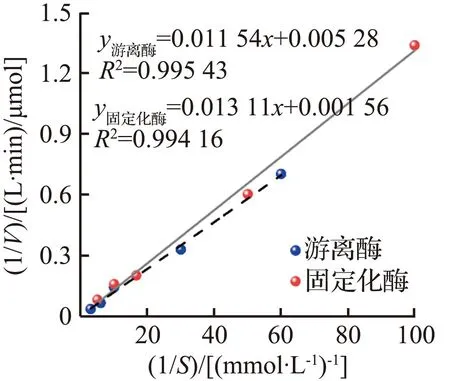
动力学研究对于评价酶的催化活性至关重要,使用不同浓度的p-NPA底物对游离酶和固定化酶复合膜进行了动力学测试,反应速率与底物浓度的关系如图3(f)所示,游离酶和固定化酶复合膜的动力学参数见表3。从表3可见,游离酶的最大反应速率Vmax、米氏常数Km、实际催化效率(kcat/Km,kcat为实际反应速率)分别为0.19 mmol/(L·min)、2.18 mmol/L、314.23 L/(mol·s),固定化后Vmax增大了2.4倍,为0.64 mmol/(L·min)。Km有所增大,说明CA在固定化后对底物的亲和性降低,这可能是CA在固定化过程中空间结构发生变化所致[33]。同时,固定化后,CA的部分催化活性位点被隐藏,底物在与酶的活性位点接触时存在一定的阻力[34],导致酶与底物的亲和性降低。固定到地质聚合物管状无机膜上时,CA与地质聚合物管状无机膜发生共价结合,部分活性位点被破坏,导致固定化酶复合膜的kcat/Km有所降低。

表3 游离酶和固定化酶复合膜的动力学参数Tab.3 Kinetic parameters of free CA and GM-CA
2.5 CO2捕获性能测试
2.5.1 CO2气体流速和酶用量的影响
CO2气体流速和酶用量对CO2捕获测试的影响如图4所示。对于具有相同酶负载量的固定化酶复合膜,随着CO2气体流速的增大,催化反应达到平衡所需的时间明显减少,尤其在气体体积流量从50 mL/min增大至100 mL/min时,反应达到平衡所需的时间成倍减少,这可能是由于气体体积流量的增大加速了固定化酶内表面流体的扰动,降低了CO2分子的外扩散阻力。当气体体积流量大于150 mL/min时,反应达到平衡的时间几乎不再减少,表明固定化酶复合膜与CO2的反应能力达到饱和[16],此时为内扩散控制,受到固定化酶复合膜内部孔结构的影响。特别地,当CO2气体体积流量为50 mL/min时,地质聚合物管状无机膜对照组二氧化碳水合反应达到平衡所需的时间超过30 min,矿化反应得到的碳酸钙质量小于125 mg,而固定化酶复合膜实验组催化反应达到平衡所需时间缩短至14 min以下,碳酸钙质量增加25 mg以上,说明尽管溶液持续变酸性对于CO2的水合反应速率有明显的抑制作用,然而固定化酶仍然能够在较短的时间内达到CO2在溶液中的水合反应极限。反观对照组,CO2在溶液中的水合反应极限在有限的时间内很难达到。同时可以看到,固定化酶复合膜在较低的酶负载量下就可以得到较好的催化效果,且CO2水合反应速率以及给定时间内的碳捕获量可以通过增加酶的负载量进一步提高。
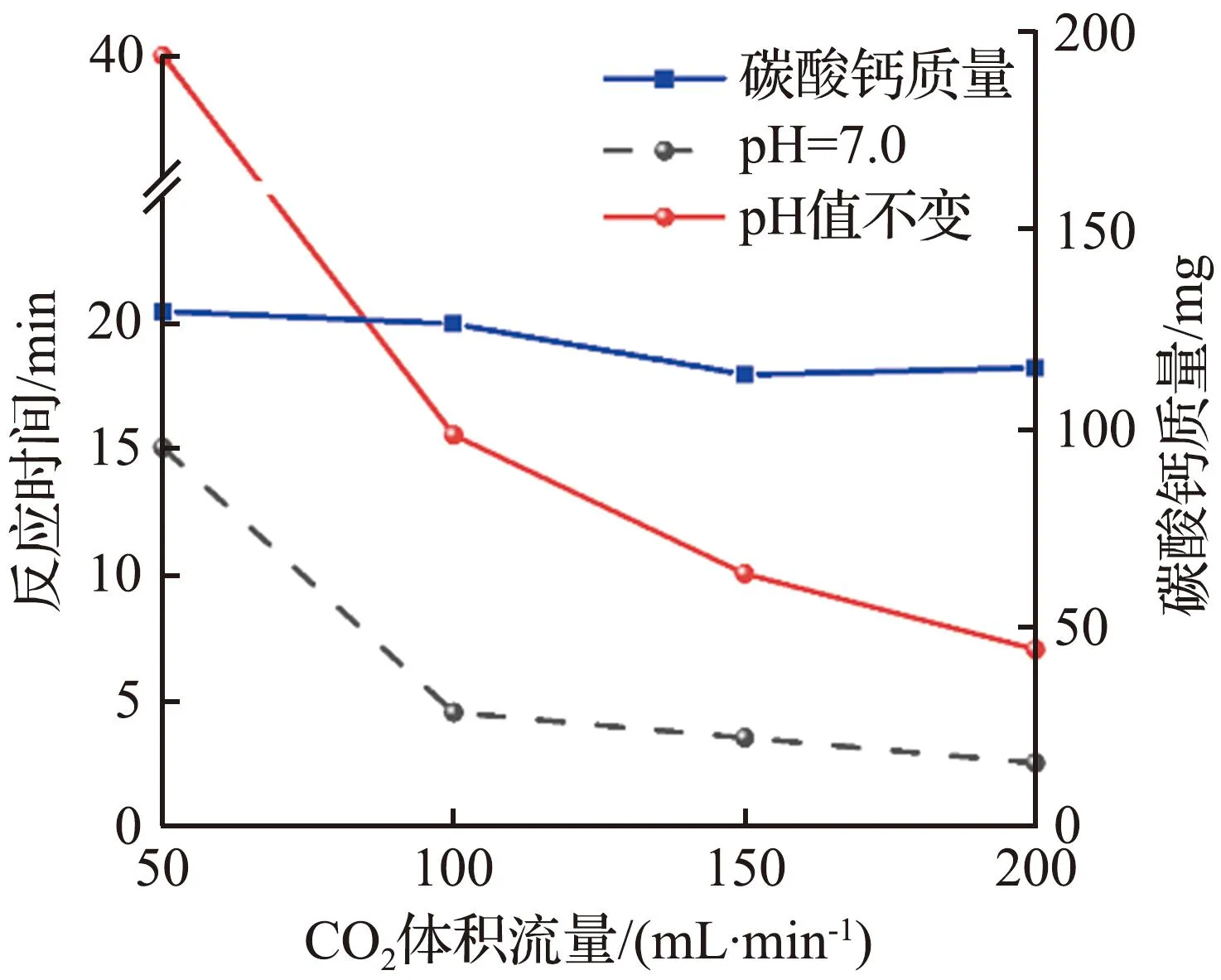
(a) 无酶负载
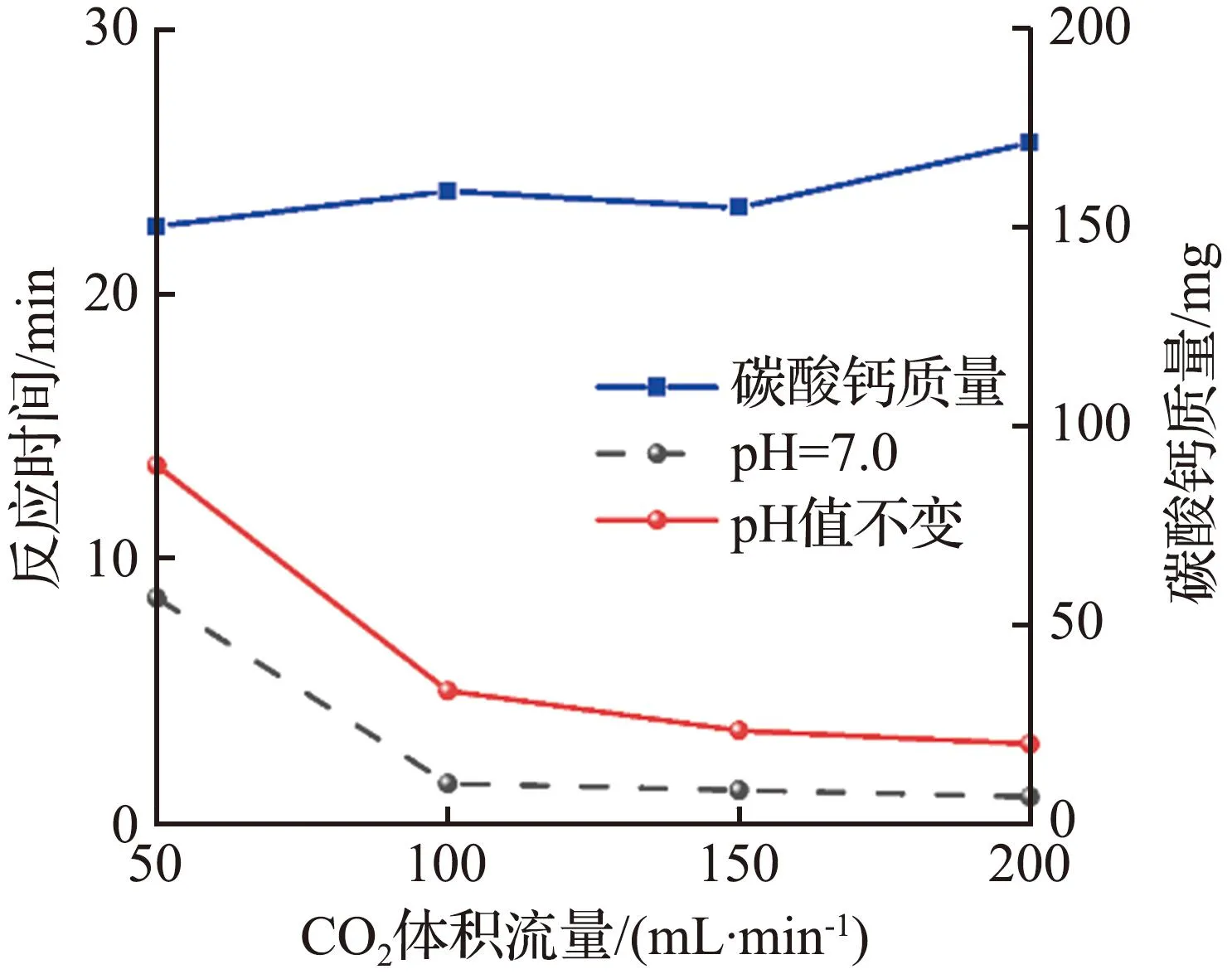
(b) 1 mg酶负载
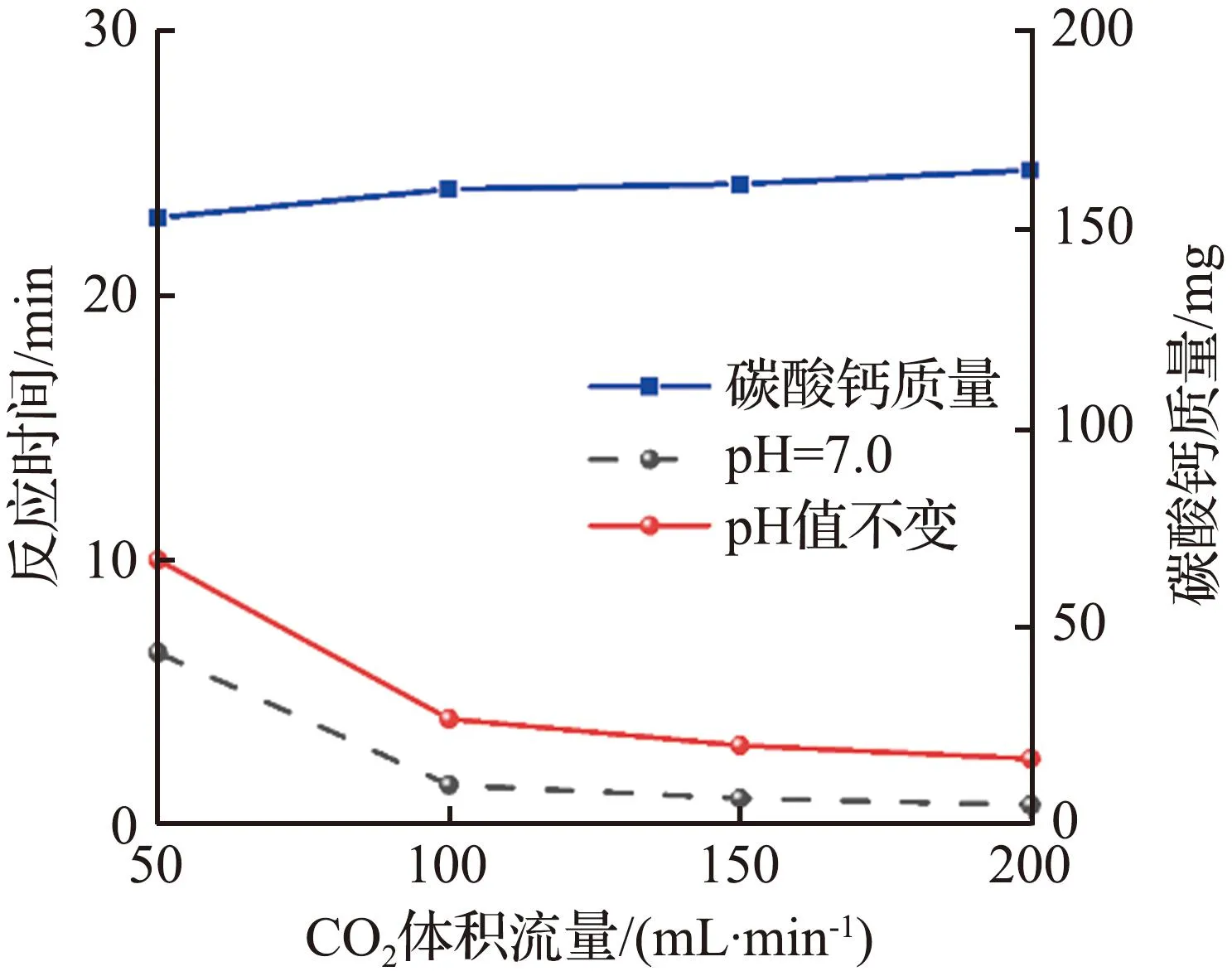
(c) 2 mg酶负载图4 CO2气体流速和酶用量对CO2捕获测试的影响Fig.4 Effects of CO2 gas flow rate and enzyme dosage on CO2 capture testing
2.5.2 温度和pH值的影响
温度和pH值对CO2捕获性能的影响如图5所示。从图5(a)可见,温度对于CO2捕获测试具有显著的影响,随着温度从20 ℃升高到35 ℃,反应达到平衡的时间呈现持续降低的趋势,表明温度的升高有助于CO2在膜孔隙内扩散,从而更好地与固定在膜上的酶分子充分接触和反应。随着温度的继续升高,反应达到平衡的时间开始增加,表明固定化酶复合膜在35 ℃达到最佳反应活性,过高的温度使得部分酶分子结构遭到破坏而失活。值得注意的是,在温度从35 ℃升高到40 ℃的过程中,得到的碳酸钙沉淀量继续增大,表明较高温度对于CO2在膜内的扩散具有明显的促进作用。
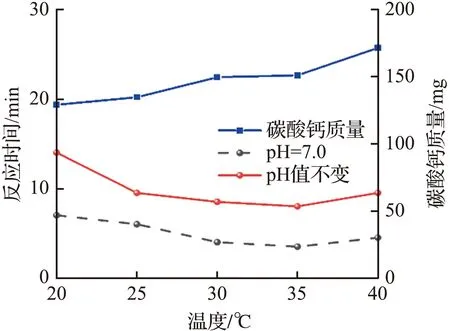
(a) 温度
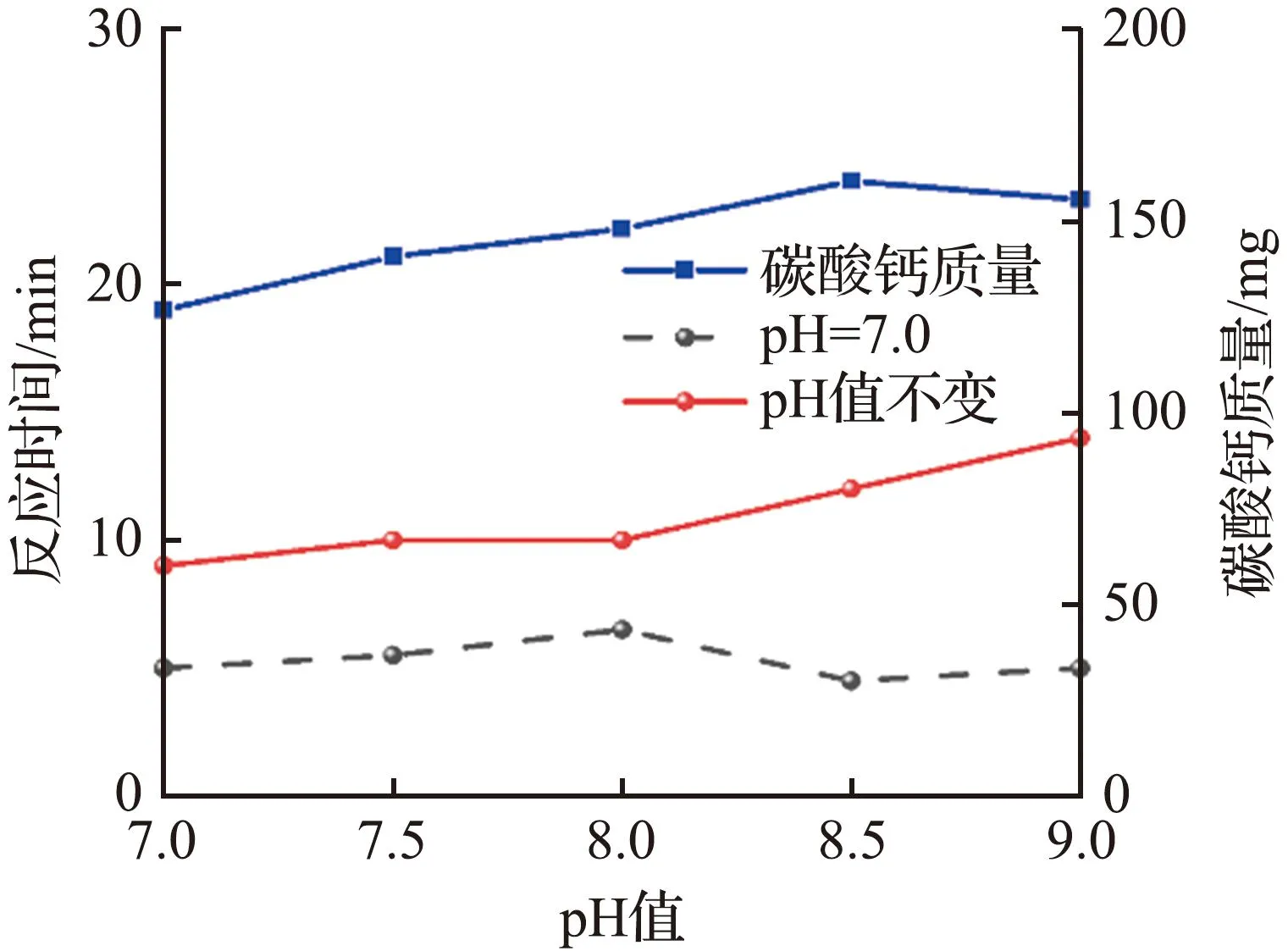
(b) pH值图5 温度和pH值对CO2捕获性能的影响Fig.5 Effects of temperature and pH on CO2 capture performance
从图5(b)可见,pH值为7.0~8.0时,反应达到平衡的时间没有明显的变化,随着pH值继续增大,反应达到平衡的时间开始增加,表明固定化酶复合膜在pH=8.0时达到了最佳反应活性,在pH值大于8.0的溶液中,固定化酶复合膜发生部分失活,从而使得反应达到平衡的时间明显增加。由于溶液的碱浓度对于CO2吸收也有一定的影响,因而在pH值为8.0~9.0的溶液中,反应后得到的碳酸钙沉淀量也有略微增加。
固定化酶在循环流动系统中的催化性能如图6所示。从图6中可以看出,空白地质聚合物管状无机膜组在通入CO220 min后,溶液pH值才逐渐趋于稳定,而固定化酶复合膜组在5次循环中均在前5 min溶液的pH值就会降到最低点,且相对于空白地质聚合物管状无机膜组,在固定化酶复合膜催化下反应溶液在30 min内所能达到的pH值平衡点低于空白地质聚合物管状无机膜组1 ~ 2个pH值单位,与图4的结果一致,表明固定化酶复合膜催化CO2水合作用效果显著。在5次循环实验中,反应液所能达到的最低pH值逐渐升高,这是因为长时间的连续流动实验使得固定化酶复合膜长时间处于酸性的溶液中,这对于碳酸酐酶分子活性的保持是非常不利的。尽管如此,从5次循环实验的结果来看,固定化酶复合膜在长时间的催化测试下均展现了良好的捕获CO2的能力,从另一方面说明该固定化酶复合膜具有出色的pH值耐受性,可以在低pH值的环境下工作。
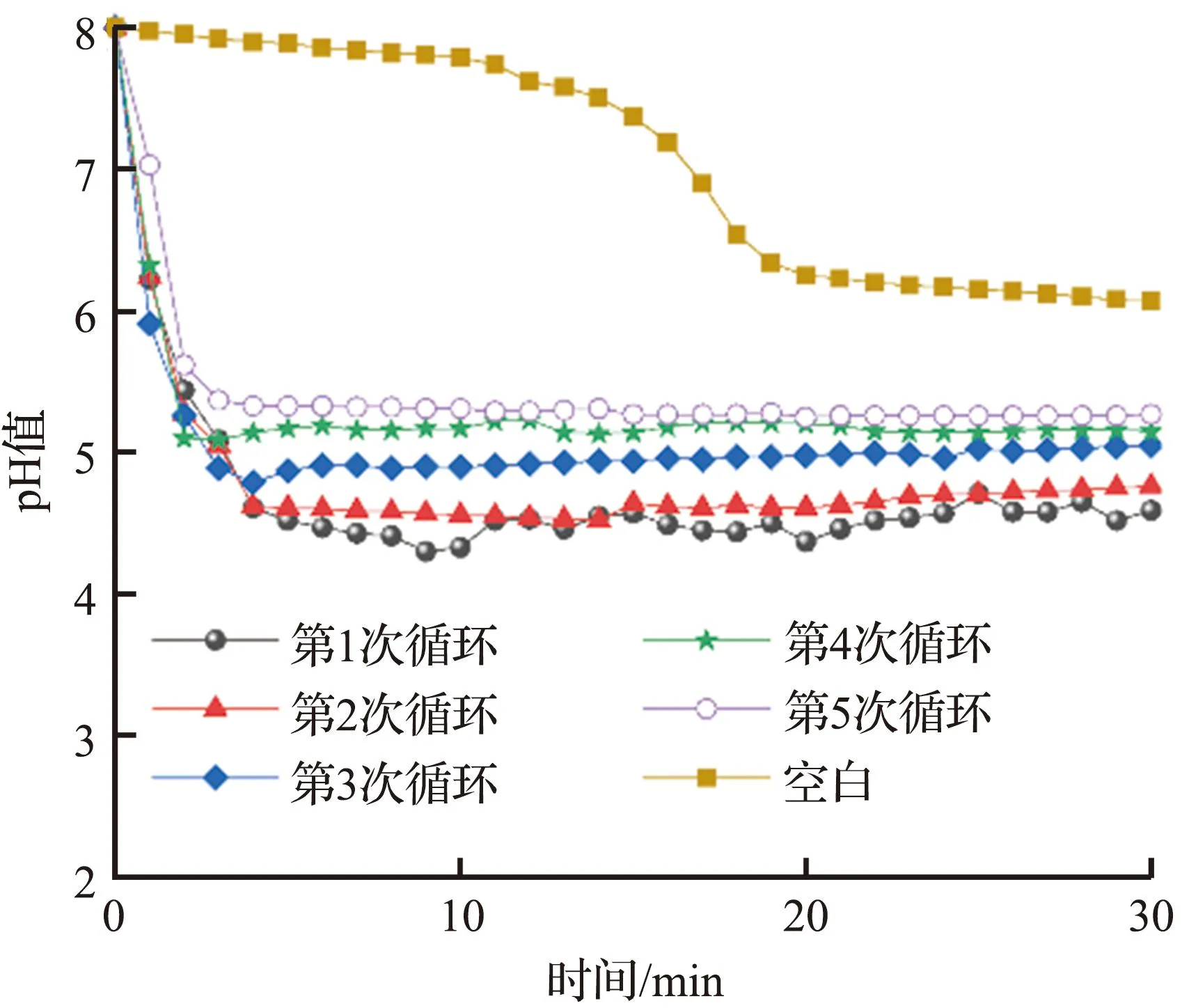
图6 固定化酶在循环流动系统中的催化性能Fig.6 Catalytic performance of immobilized enzyme in the continuous flow system
2.5.3 CO2捕获循环性能测试与固定化酶催化反应机制分析
生物催化复合地质聚合物管状无机膜和气液接触过程中的CO2捕获示意图如图7所示。由图7可见,在被戊二醛分子修饰的多孔地质聚合物管状无机膜中,由于CA分子尺寸受5 nm×4 nm×4 nm(长度×宽度×高度)的限制[28],CA分子在循环过滤(流经大孔)的过程中,选择性地被固定在地质聚合物管状无机膜的介孔结构中。相应地,CO2分子在推动力作用下不断地进入液相,在膜的介孔内扩散并与CA分子接触,迅速转化为H+和HCO3-,并持续在CA分子周围积累,一方面酸性的增加限制了CA分子结构的保持,另一方面产物持续的积累使得反应正向进行产生阻碍。此时由于膜内外浓度梯度的存在,以及额外的流体扰动将产物转移到外部溶液中,使得反应能够继续快速地进行下去。从这一过程中可以得到启发:一方面,增加气体流量或者额外的惰性气体有助于CO2在膜间的传质;另一方面,避免长时间处于酸性的环境中有利于固定化酶复合膜活性的保持,亦即通过外部辅助手段增加膜外部环境中液体的湍流,从而快速转移出膜内的产物或及时更换持续变得酸性的溶液。
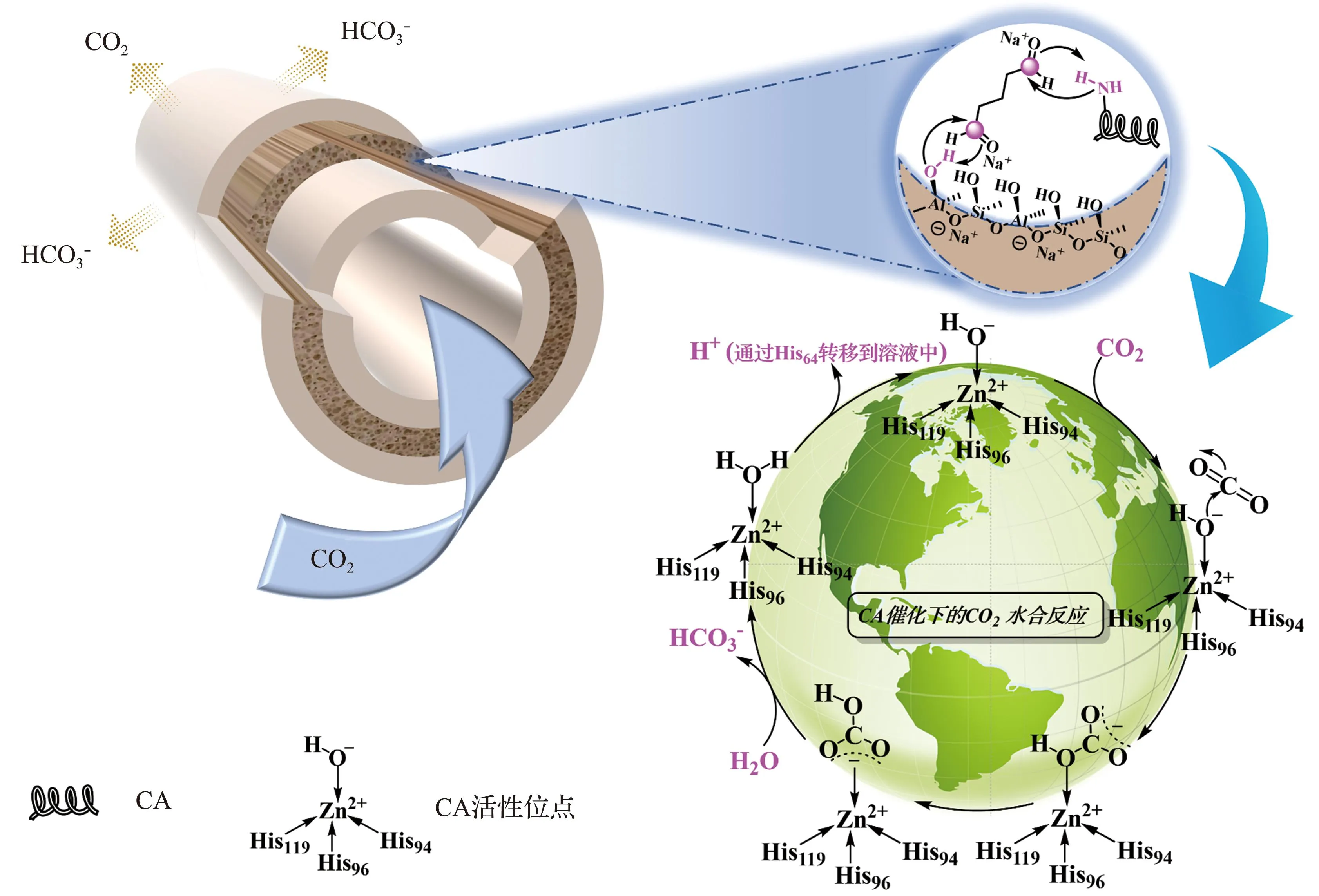
图7 生物催化复合地质聚合物管状无机膜和气液接触过程中的CO2捕获示意图Fig.7 Schematic illustration of the biocatalytic composite GM and CO2 absorption in MC process
2.6 地质聚合物管状无机膜和固定化酶复合膜的结构和成分分析
2.6.1 SEM分析
负载CA前、后膜的结构特征和孔隙特征如图8所示。从图8(a)可见,地质聚合物管状无机膜具有大量的大孔,这种大孔结构可以有效地增大膜内液体和气体的通量。地质聚合物在微观上具有明显的介孔结构,大量的孔隙增大了膜的比表面积,有助于酶在膜内的扩散和附着。从图8(b)可见,由于CA在地质聚合膜的介孔结构中与有机物交联,负载酶后地质聚合膜的介孔结构发生了显著变化[35]。这些变化使得地质聚合膜原本清晰的孔隙结构变得更加蓬松,从而大大增加了地质聚合膜的比表面积,并极大地增强了CO2分子在孔隙中的扩散和吸附能力。

(a) 负载前

(b) 负载后图8 负载CA前、后膜的结构特征和孔隙特征Fig.8 Structural and pore characteristics of the membrane before and after loading with carbonic anhydrase
2.6.2 FTIR分析
为了观察地质聚合物管状无机膜负载CA前、后表面化学键的变化,在傅里叶红外光谱仪上使用KBr压片技术对不同的固体粉末样品进行测试。加入缓冲液处理地质聚合物管状无机膜是为了避免缓冲液对地质聚合物管状无机膜红外分析的干扰。CA、缓冲液处理地质聚合物管状无机膜、地质聚合物管状无机膜和固定化酶复合膜的FTIR谱图如图9所示。

2.6.3 XRD和XPS分析
不同样品的XRD、XPS谱图如图10所示。在负载CA前、后,地质聚合物管状无机膜的XRD光谱基本保持不变,表明地质聚合物管状无机膜在负载酶前、后都保持了原有的凝胶结构[40]。膜的原子质量分数也通过XPS进行了分析[图10(b)和表4]。在负载酶前、后膜的原子含量没有发生明显变化,表明在负载过程中地质聚合物管状无机膜的材料成分没有发生变化。上述表征结果共同说明了膜在操作过程中的稳定性。
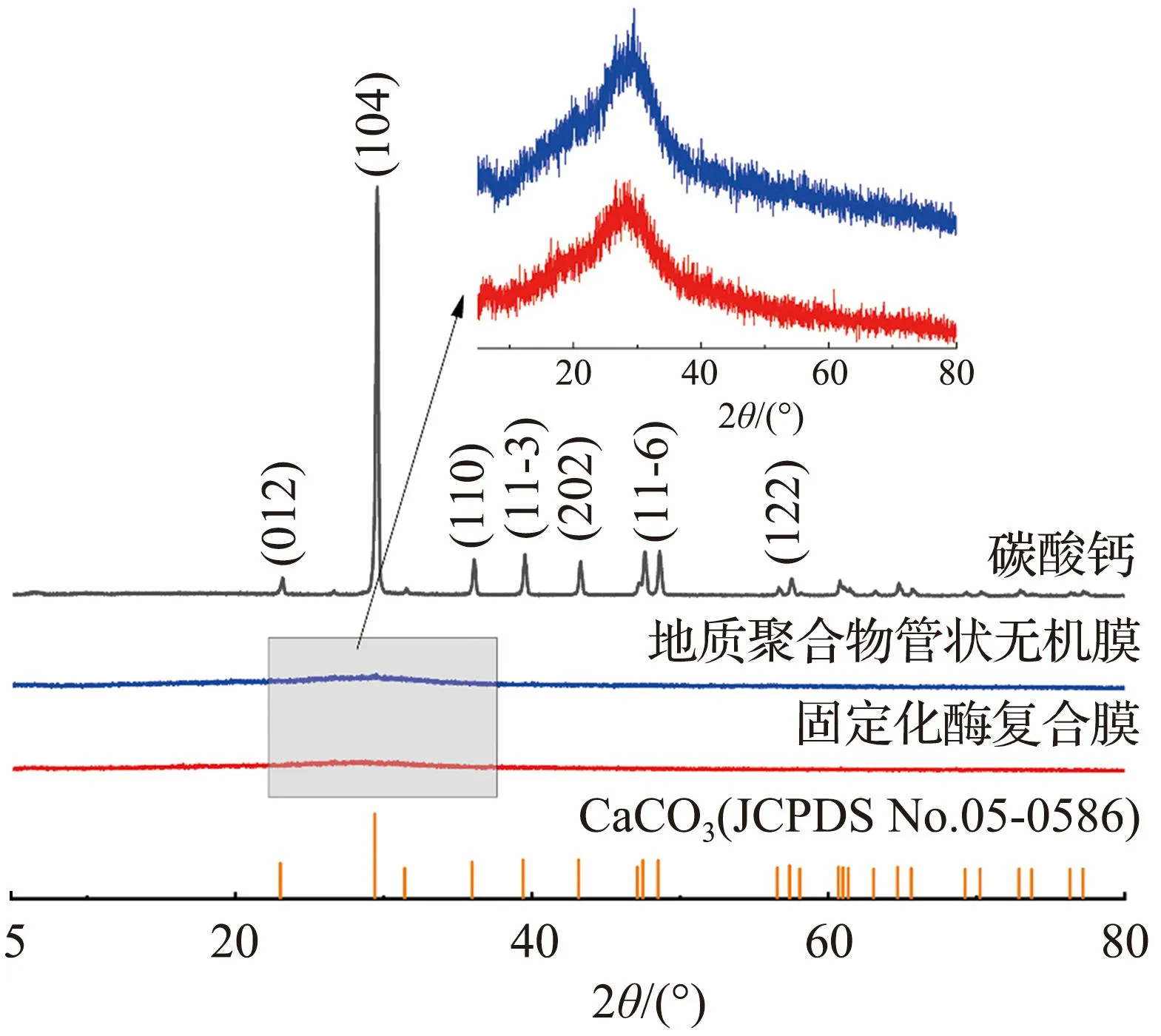
(a) XRD谱图
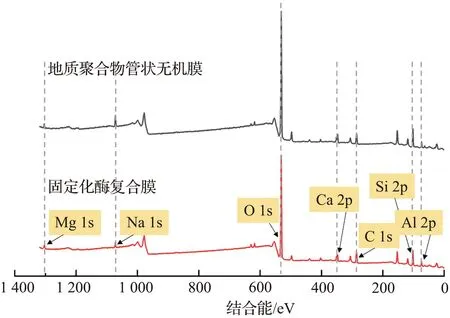
(b) XPS谱图 图10 不同样品的XRD、XPS谱图Fig.10 XRD spectra and XPS spectra of different samples

表4 通过XPS测定地质聚合物管状无机膜和固定化酶复合膜的原子质量分数Tab.4 Atomic percentage on GM and GM-CA determined by XPS 单位:%
3 结论
本文中以偏高岭土和粒状高炉矿渣为原料制备了地质聚合物管状无机膜用于负载CA,并对负载条件进行了探索,发现在最佳条件下获得的固定化酶复合膜具有高达63.7%的酶活性回收率。固定化酶复合膜在连续循环使用30次后,仍然可以保留67.8%的相对活性。固定化酶复合膜在4 ℃下贮藏60 d后仍然有52.0%的相对活性。与有机膜相比,该膜在酶活性回收率和操作稳定性方面都有显著提高。
在CO2捕获测试中,相对于未负载CA的空白膜,固定化酶复合膜催化CO2水合反应达到平衡所需要的时间缩短至14 min以下,矿化实验中,固定化酶复合膜催化下得到的CaCO3质量相较对照组多25 mg以上,说明固定化酶复合膜对CO2水合反应的催化效率显著,在排除低pH值对酶反应活性的不利影响后,固定化酶复合膜会有更加优异的表现。
地质聚合物管状无机膜制备成本低,机械强度高,因此地质聚合物管状无机膜作为载体的固定化酶复合膜具有良好的商业和工业应用价值,对于燃烧后捕获CO2有重要的应用前景。

