禽腺病毒血清4型感染的LMH细胞mRNA表达谱分析
杨筱竹,冯慧霞,2,候晓兰,席义博,段利强,杨 勃,2*
(1.山西高等创新研究院,山西太原 030000;2.山西农业大学动物医学院,山西太谷 030801;3.西北农林科技大学动物医学院,陕西杨凌 712100)
禽腺病毒血清4型(Fowl adenovirus serotype 4,FAdV-4)可引起禽类心包积液-肝炎综合征(hydropericardium syndrome-inclusion body hepatitis,HPS-IBH)或称为鸡心包积水综合征(hydropericardium syndrome,HPS),具有高度传染性、高致死率,且易与其他免疫抑制性病毒和细菌并发[1-2],主要感染鸡、鸭和鹅等家禽,也可感染野生禽类[3-5]。FAdV-4病毒粒子的外部衣壳主要由五邻体蛋白(Penton)、六邻体蛋白(Hexon)和三聚体纤突蛋白(Fiber)3种结构蛋白构成[6]。Penton位于病毒粒子20面体的顶端,可辅助腺病毒入侵宿主细胞;Hexon包含群、型和亚型特异性抗原决定簇,能诱导机体产生中和抗体,是禽腺病毒表面最主要的结构蛋白;Fiber由短纤维蛋白1(Fiber-1)和长纤维蛋白2(Fiber-2)构成,Fiber-1在病毒衣壳与宿主细胞黏附中发挥重要作用,Fiber-2可以影响病毒的毒力[7],被确定为中国高致病性 FAdV-4 流行毒株的主要毒力决定因子之一,也是病毒侵染和产生中和抗原位点的主要区域[3,6]。疫苗接种是最有效的预防病毒感染的方法,针对FAdV-4已研发出一些弱毒活疫苗、油乳剂灭活疫苗、基因工程疫苗和亚单位疫苗[5,8]。为确保国内外家禽养殖业的健康发展,有效防控该传染病的发生与流行,对FAdV-4致病机制的研究仍任重道远。
目前转录组学分析是病毒感染宿主细胞后研究宿主与病毒相互作用及探讨感染病毒致病机制的重要方法。高通量研究发现,gga-miR-181a-5p可抑制chSTING介导的信号传导途径,其可作为负反馈调节剂参与抗病毒免疫反应[9]。此外,研究表明FAdV-4进入LMH细胞过程中mRNAs参与了黏附连接和受体结合等与病毒密切相关的细胞功能,并富集在Toll样受体信号通路、TNF信号通路及MAPK信号通路[10]。本研究针对FAdV-4感染LMH细胞后转录组学进行了分析,筛选出差异表达基因并将其按功能分类,分析靶基因参与的细胞功能和信号通路,为阐明FAdV-4 感染LMH的致病机制和疫苗产品的研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 LMH细胞和FAdV-4均由西北农林科技大学预防兽医学公共卫生实验室分离与保存。
1.1.2 主要试剂 胎牛血清、胰酶和DMEM/F12培养基,Gibco公司产品;双抗(青霉素和链霉素),Hyclone公司产品;RNAiso Plus,TB Green Premix ExTaqⅡ和PrimeScript RT Reagent Kit,Takara公司产品;X-biotech彩色预染蛋白分子质量标准X10101(10~180 ku),安徽欣伯玉生物科技有限公司产品;PVDF膜,Millipore公司产品;ECL显色液,Thermo公司产品;Tubulin的特异性抗体,CST公司产品;HRP标记的山羊抗小鼠、山羊抗兔IgG,中山金桥公司产品;抗 FAdV-4 Hexon 的多克隆抗体由本实验室制备。
1.1.3 主要仪器 超净工作台(S·SW-CJ-1FD),上海跃进医疗器械有限公司产品;二氧化碳培养箱(250i),赛默飞世尔科技(中国)有限公司产品;小型垂直电泳槽 (Mini-protean tetra),高电流电泳仪电源(Powerpac HC),伯乐生命医学产品(上海)有限公司产品;一体化成像仪(LAS500),通用电气公司产品;实时荧光定量PCR仪(ABI 7500),赛默飞世尔科技(中国)有限公司产品;倒置荧光显微镜(MF52-N),广州市明美光电技术有限公司。
1.2 方法
1.2.1 测序样本的制备 将LMH细胞铺种(1.5×106个/孔)于6孔细胞培养板,分为感染组和未感染组,每组3个重复。待感染组细胞密度达80% 时,以MOI=2剂量接种FAdV-4,置于37℃、5% CO2培养箱培养48 h后弃上清,每孔加1 mL的RNAiso Plus,放于-80冻存,用于RNA提取和转录组测序。
1.2.2 病毒感染情况及免疫印迹分析 为了验证病毒感染情况,48 h后于倒置显微镜下观察并记录细胞的病变(cytopathic effect,CPE)情况。同时,将上述细胞用细胞裂解液裂解后,按比例加5×上样缓冲液,100℃煮样5~10 min。取10 μL蛋白样品加入10%的SDS-PAGE凝胶进行电泳。电泳结束后,在21 W条件下转膜2 h。转膜后用TBST溶液洗膜5次,5 min/次。将转好的膜用10%脱脂奶粉室温条件下封闭2 h后,孵育Hexon和Tubulin的抗体4℃过夜后用TBST溶液洗膜5次,5min/次。随后孵育二抗(稀释比例1∶10 000),室温1 h,最后用ECL方法进行显影和曝光。
1.2.3 文库的构建与测序 提取Total RNA并进行RNA质量检测。待RNA样本检测合格后,进行普通转录组mRNA-Seq文库构建。文库构建完成后使用Qubit 3.0进行初步定量,使用qPCR对文库有效浓度进行准确定量,待文库检测合格后,利用Illumina NovaSeq 6000进行PE150模式测序。
1.2.4 测序数据产出及质量评估 使用Illumina NovaSeq高通量测序平台对cDNA文库进行测序,产出原始数据(Raw data),过滤获得高质量的Clean reads用于后续数据分析,过滤主要包括去除含N(N表示无法确定碱基信息)的Reads(N个数>3)、去除低质量Reads(质量值低于5的碱基比例>=20%)、去除含接头(adapter)Reads。按上述标准过滤后得到Clean reads,再使用bowtie2软件将Clean reads比对到silva数据库去除rRNA,得到的Reads用于后续分析。
1.2.5 基因表达水平分析 采用FeatureCount对每个样本进行基因水平定量,合并得到所有样本的基因表达量矩阵,用FPKM(fragments per kilobase million)值表示mRNA-seq的基因表达定量。
1.2.6 基因差异表达分析 采用edgeR进行基因差异表达显著性分析。为控制假阳性率,差异表达通过|log2(Fold change)|>1.00&q value<0.05判定标准进行筛选。
1.2.7 差异表达基因功能富集分析 使用topGO 软件对差异表达基因进行GO(Gene ontology)富集分析,当校正的P值小于0.05时认为该GO功能存在显著富集情况。使用KOBAS(v3.0)软件对差异表达的基因进行KEGG(Kyoto encyclopedia of genes and genomes)富集分析并以校正的P值小于0.05为条件判断信号通路的显著性。
1.2.8 差异表达基因RT-qPCR验证 为了进一步验证FAdV-4感染LMH细胞的转录组结果,选择了与病毒感染潜在相关的8个差异表达基因进行RT-qPCR分析。病毒感染细胞48 h后,提取总RNA并将其反转录。使用Beacon Designer 7软件进行引物设计,引物序列见表1,由北京擎科生物科技有限公司合成。验证结果通过2-△△CT计算各基因的相对表达量,通过内参基因GAPDH校正,GraphPad Prism 6统计软件进行显著性分析。

表1 差异表达基因的RT-qPCR引物
2 结果
2.1 细胞病变与病毒感染情况
结果显示,对照组细胞结构完整,部分细胞聚堆生长,呈现梅花状特征(图1A);感染48 h后,出现典型的细胞病变效应(cytopathic effect,CPE),细胞开始皱缩变圆,折光性明显变强,且随着病变面积的增加,大量细胞开始脱落坏死,漂浮在培养液中(图1A)。另外,以MOI=2接种细胞后,利用Western blot检测病毒增殖情况。与对照组相比,只有感染组能检测到FAdV-4 的Hexon 蛋白表达(图1B),为样品的高通量检测提供了质控基础。
2.2 样品准备及数据质量分析
FAdV-4感染组和对照组经过高通量测序得到的原始数据经过滤后(表2)显示Q20(%)和 Q30(%)值均大于93.00%,由此可说明每个样品的测序结果均能满足后续实验分析需求。

表2 测序数据统计分析
2.3 基因差异表达分析
采用edgeR 筛选出log2|FoldChange|> 1.00 &q value<0.05的显著差异基因,对不同比较组合的差异表达基因结果绘制火山图(图2A),结果显示,当FAdV-4感染LMH细胞48 h后,差异表达基因共5 487个,其中2 604个基因上调表达,2 883个基因下调表达。为进一步直观展示感染后差异基因的表达模式并挖掘新的功能基因,对差异表达基因进行了聚类热图展示(图2B)。FAdV-4感染后的差异表达基因中,上调倍数前15的差异表达基因包括IL-8、CCL4、GNB3、NECTIN4、SFRP4等(表3),下调倍数前15的差异表达基因包括FABP2、PLPP3、GALR1L、MBL2等(表4)。在差异表达基因中,很多基因已被证实和禽腺病毒有关,证明了测序的准确性。另一方面,有些基因还尚未挖掘,能够作为FAdV-4感染机制的潜在靶点。

图2 差异表达基因火山图和聚类热图

表3 显著上调的前15个差异表达基因
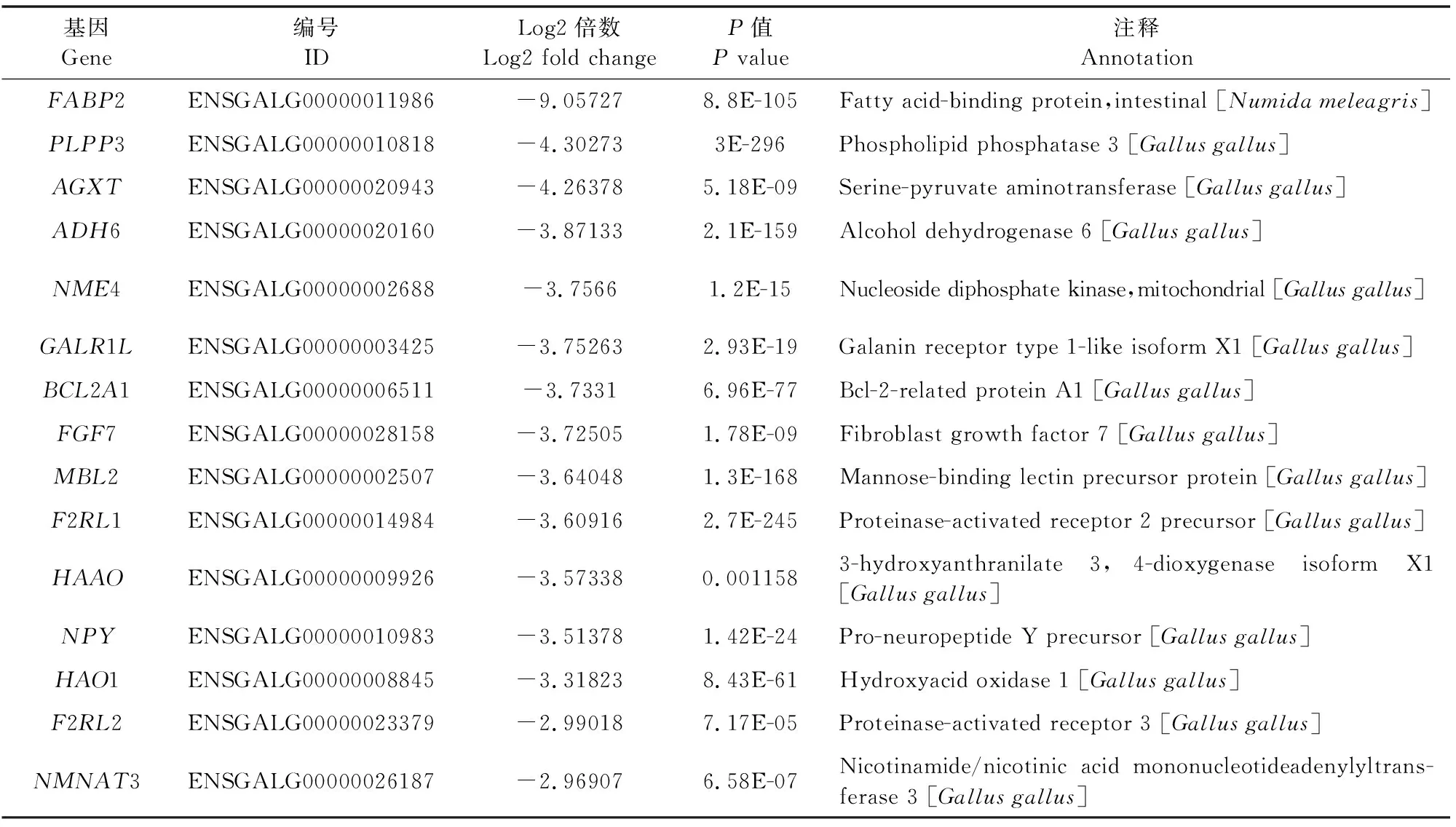
表4 显著下调的前15个差异表达基因
2.4 GO富集分析
使用topGO 软件对差异表达基因进行GO 富集分析,结果发现这些差异基因显著富集的GO terms共有1 089个,涉及生物过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)三大类(图3 A-C)。由图3可知,与生物过程有关的GO terms富集最显著的是生物质量调控,其次是激素水平的调节以及发育过程和细胞增殖。分子功能中差异表达基因主要富集在信号受体结合、离子跨膜转运体活性、离子门控通道活性和脂结合等。细胞组分中GO富集通路主要与细胞表面位点和质膜区域相关。

图3 FAdV-4感染LMH差异表达基因GO功能富集图
2.5 KEGG富集分析
使用KOBAS(v3.0)软件对差异基因进行KEGG pathway富集分析,分别挑选了上调和下调差异基因显著富集的前20个通路绘制气泡图(图4)。在下调差异基因中,与代谢相关的基因所在的通路被显著富集(图4A),如碳水化合物代谢、脂质代谢、谷氨酰胺代谢和核苷酸代谢。在上调差异基因富集的信号通路中,MAPK信号通路、吞噬作用、细胞周期、细胞黏附分子等均与病毒感染密切相关(图4B),为进一步研究FAdV-4感染机制奠定基础。
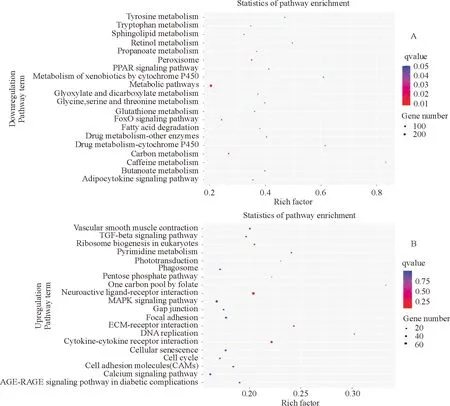
图4 FAdV-4感染LMH差异表达基因KEGG通路富集图
2.6 RT-qPCR验证
为了进一步验证FAdV-4感染LMH差异基因的表达谱变化,我们选取了与病毒感染相关的8个基因进行RT-qPCR验证,结果如图5所示,ADORA2B、CCL4、NECTIN4、IL8L1和SOCS1L基因表达上调,BCL2A1、FGF7和F2RL2基因表达下调,结果与转录组的测序结果基本一致,说明了此次高通量测序具有一定的准确性和可信度。

图5 差异表达基因的RT-qPCR验证
3 讨论
由于FAdV-4的迅速传播,导致病禽食欲不振、嗜睡、羽毛褶皱、精神萎靡、突然死亡,临床剖检特征为心包腔内有大量草黄色积液、肝脏肿大、多灶性坏死[3,9],还可通过粪口途径进行水平和垂直传播,传播范围广防控难度大,对国内外家禽养殖业造成巨大的经济损失。本研究选取MOI=2 FAdV-4感染LMH细胞48 h后进行转录组分析,当LMH出现明显的细胞病变并且充分表达病毒蛋白时,能更准确的反应病毒复制后细胞内的生物学反应,进一步阐明病毒和细胞的相互作用。因此,本研究选择该接种剂量及时间点进行转录组分析。
通过高通量测序分析,挖掘出部分报道过的与FAdV-4密切相关的细胞因子,如OBSL1、IL-8、CCL4等[11],进一步肯定高通量的准确性。大量研究表明IL-8作为重要的中性粒细胞趋化因子,当机体感染后可诱导机体的炎症反应,有利于机体消灭病原,在炎症过程中发挥重要功能[12],CCL4作为促炎趋化因子,在促炎刺激下形成并积极参与炎症反应,吸引免疫细胞到炎症部位。杨中英等人通过体外实验证明沉默CD46、DSG2表达后阻断了HAdV-3、HAdV-7的病毒侵入以及感染诱导的IL-8释放[13]。陈绪靖等人研究发现CCL4可以抑制J亚群禽白血病病毒的复制,具有抗病毒作用[14]。另一方面还筛选出了GNB3、NECTIN4、SFRP4、FABP2、PLPP3、GALR1L、SOCS1和MBL2等潜在的FAdV-4限制因子[15-17],还需要进一步研究证明其与FAdV-4的相互关系,挖掘潜在的防控靶点。
进一步筛选差异表达基因并按功能分类,发现差异基因与生物过程有关的GO terms富集显著的有激素水平的调节和细胞增殖。分子功能中差异表达基因主要富集在信号受体结合、离子跨膜转运体活性、离子门控通道活性等。细胞组分中GO富集通路主要与细胞表面位点和质膜区域相关。病毒感染后细胞增殖、离子跨膜转运体以及质膜区域活性的变化,提示病毒感染严重影响着细胞的命运,在病毒不断复制的过程中,细胞内各种细胞器的功能基本紊乱。因此,限制病毒增殖是重中之重,宿主细胞内限制因子的调控极为重要,下一步需要进一步挖掘分子功能、生物过程和细胞组分的主导作用,对变化倍数高的mRNA进行验证,寻求潜在的抗病毒靶点。KEGG分析发现下调差异基因富集到碳水化合物代谢、脂质代谢、氨基酸代谢和核苷酸代谢等途径中,这些基因和通路可维持细胞的能量状态,并提供必要的组成部分以确保适当的细胞功能,说明了FAdV-4对细胞的代谢功能有非常显著的抑制作用。已有研究表明,丝氨酸代谢可以抑制ATP6V0d2介导的YAP溶酶体降解,从而调节抗病毒先天免疫[18]。在上调差异基因富集的信号通路中,MAPK信号通路、细胞周期被富集,这些通路均已报道与腺病毒感染密切相关[11,19-20],同时也筛选出吞噬作用和细胞粘附通路等信号转导通路。本研究丰富了FAdV-4对LMH细胞的转录组调控信息,也为进一步探讨FAdV-4感染的致病机制和宿主细胞的抗病毒研究提供了理论基础。

