小反刍兽疫病毒竞争ELISA抗体检测方法的建立
许 芳,蔡 杰,薛华平,罗 均,蒋永青*,郭霄峰*
(1.华南农业大学兽医学院,广东广州 510642;2.深圳市绿诗源生物技术有限公司,广东深圳 518120)
小反刍兽疫(Peste des petits ruminants,PPR)是由PPRV感染反刍动物引起的一种急性、热性、高度接触性传染病,主要感染山羊和绵羊,具有高发病率和致死率[1]。该病目前主要流行于撒哈拉以南的非洲、中东地区和印度次大陆,由于PPR的高致死率(70%~80%)[2-4],世界动物卫生组织(WOAH)将其列为法定报告动物疫病,也是全球计划根除的动物疫病[5]。我国于2007年7月在西藏阿里首次发现了该病的疫情[6],因其具有极高的发病率和致死率,2022年我国农业农村部修定的《一、二、三类动物疫病病种名录》仍将其列为一类动物疫病。小反刍兽疫在流行国家和地区对当地畜牧业造成了毁灭性的打击,造成了严重的经济损失[7],因此建立小反刍兽疫快速诊断方法是非常必要的。
小反刍兽疫病毒为单股负链RNA病毒,在病毒基因组上依次分布着6个编码基因 N、P、M、F、H、L,分别编码6种结构蛋白(N、P、M、F、H、L 蛋白)及2种非结构蛋白(C、V 蛋白)[8]。其中,核衣壳(N)蛋白相对保守,是病毒的核衣壳的主要组成成分,是最为丰富的蛋白,能够保护病毒基因组免受核糖核酸酶Ⅰ的降解,与P蛋白共同参与病毒基因组的复制和转录。N蛋白具有较强的免疫反应原性,能够刺激机体产生强烈的免疫应答,在PPRV阳性血清中针对N蛋白的抗体占主导地位,常作为诊断抗原,用于诊断研究[9]。目前,PPRV抗体检测方法主要有血清中和试验、酶联免疫吸附试验(ELISA)、免疫层析等,血清中和试验是国内外公认的抗体测定方法,但中和试验因其操作复杂、耗时长、对人员和实验室要求均较高等缺点,不适于基层全面推广。ELISA技术是常用的血清学检测方法,也是WOAH推荐使用的PPRV检测方法[5]。早在1994年国外学者就以N蛋白为基础建立了cELISA检测方法,目前也成为了国际标准的PPRV抗体检测方法,开发了成熟的cELISA抗体检测试剂盒[10]。而我国目前在研究的相关PPRV ELISA检测方法,大多数为间接ELISA,也有阻断和竞争ELISA[8,11-13],但很少有开发出成熟的ELISA试剂盒。因此,本研究以N蛋白为基础,筛选出鼠抗PPRV N蛋白的特异性抗体,建立了PPRV cELISA抗体快速检测方法,为后续开发出成熟的ELISA试剂盒做准备,为我国PPRV的流行病学调查、疫苗免疫效果评估提供基础。
1 材料与方法
1.1 材料
1.1.1 细胞系、实验动物和血清 骨髓瘤细胞(S/P20)由华南农业大学兽医微生物实验室保存;Balb/c雌性小鼠购自珠海百试通生物科技有限公司;阴性血清,筛选临床表现健康的山羊场进行检测,用荧光RT-PCR方法对小反刍兽疫病毒抗原进行检测,用中和试验对小反刍兽疫病毒中和抗体效价进行检测,均为阴性,作为阴性质控品和阴性对照血清;阳性血清,上述筛选的阴性山羊,用小反刍兽疫活疫苗(Clone 9株)进行免疫,免疫后血清抗体效价不低于1∶128,作为阳性质控品和阳性对照血清;特异性对照血清,包括羊痘病毒抗体阳性血清、羊口蹄疫抗体阳性血清、布鲁氏菌抗体阳性血清(羊源)和羊pET-30a-BL21(DE3)抗体阳性血清,由华南农业大学兽医微生物实验室提供。70份血清是来自临床的某养殖场血清,其中绵羊血清50份(编号为1~50),山羊血清20份(编号为51~70)。
1.1.2 主要试剂 DH5α感受态细胞和BL21(DE3),中国北京全式金生物技术股份有限公司产品;Ni-NTA金属鳌合His蛋白纯化介质填料,美国GE公司产品;Ni2+-NTA HisBind Resin、50×HAT(A:氨基蝶呤)、50×HT(H:次黄嘌呤和T:胸腺嘧啶核苷)、弗氏完全、弗氏不完全佐剂、融合剂PEG(P7181)、辣根过氧化物酶(HRP)和鼠类单克隆抗体亚类鉴定试剂盒、单抗亚类鉴定试剂盒,均为德国默克集团公司产品;RPMI-1640培养基、胎牛血清FBS,均为美国Thermo Fisher Scientific公司产品;青霉素、链霉素,中国华北制药股份有限公司产品;TMB底物液,美国Seracare公司产品;96孔酶标板,中国深圳市金灿华实业有限公司产品;Protein G亲和层析柱、BCA蛋白浓度测定试剂盒(增强型),均为中国南京碧云天生物技术有限公司产品;rProtein G Beads 4FF亲和层析柱,中国天地人和生物科技有限公司产品。
1.1.3 主要仪器 振荡培养箱,中国上海一恒科学仪器有限公司产品;酶标仪,美国Thermo Fisher Scientific公司产品;二氧化碳培养箱,中国益世科(上海)企业发展有限公司产品。
1.2 方法
1.2.1 重组质粒的构建 重组质粒pET-30a-PPRV N由中国通用生物(安徽)股份有限公司设计和构建。
1.2.2 PPRV N蛋白的表达、纯化及鉴定 重组质粒转化E.coliBL21(DE3)感受态细胞,按照1∶100的比例接种于含卡那霉素30 μg/mL的LB液体培养基,于37 ℃、180 r/min摇床中培养12 h,单菌落摇混后挑取BL21(DE3)单菌落接种于5 mL含有30 μg/mL卡那霉素的LB液体培养基中,37 ℃、180 r/min振荡培养,当OD=0.6左右时,取1 mL菌液作为诱导前对照,同时加入异丙基硫代半乳糖苷(IPTG)至终浓度为0.8 mmol/L,37 ℃诱导表达3 h,离心集菌后使用液压破碎仪充分破碎,破碎完全后,以12 000 r/min离心10 min,收集上清,用Ni-NTA金属鳌合His蛋白纯化介质填料进行蛋白纯化。经SDS-PAGE电泳,分析目的条带的表达量,经Western blot验证蛋白的活性。
1.2.3 单克隆抗体的制备及鉴定 按照常规方法进行Balb/c小鼠免疫[14]。三免后14 d,尾静脉采血,间接ELISA法测定血清效价。选择效价最高的小鼠进行加强免疫。免疫后第3天,按照常规方法进行细胞融合。将2倍开始倍比稀释的杂交瘤细胞培养上清,按照“1.2.4项”间接ELISA法对杂交瘤细胞上清进行筛选。阳性孔再经过3次有限稀释法进行亚克隆,待阳性率达到100%时扩大培养,用于制备腹水,取腹水进行亚型鉴定、按照“1.2.4项”间接ELISA法进行效价检测,按照万文徽等的方法[15]进行抗体亲和力分析,按照rProtein G Beads 4FF亲和层析柱说明书进行单克隆抗体纯化、使用商品化的BCA蛋白浓度测定试剂盒检测单克隆抗体的浓度。
1.2.4 单克隆抗体的效价测定 用包被液将PPRV N蛋白稀释至1 μg/mL,加入ELISA板孔中,100 μL/孔,置2~8 ℃放置15 h;弃去包被液,拍干,用洗涤液洗板1次,300 μL/孔;弃去洗涤液,拍干,加入5%脱脂奶粉封闭板孔,200 μL/孔,置37 ℃温育60 min;弃去封闭液后拍干,加入使用磷酸盐缓冲液(PBS,0.01 mol/L,pH7.4)倍比稀释的杂交瘤细胞培养上清、小鼠腹水、酶标后的单抗,100 μL/孔,置37 ℃温育60 min,洗涤3次;加入1∶5 000稀释的羊抗鼠IgG-HRP酶标二抗,100 μL/孔,置37 ℃温育30 min;洗涤3次,加入底物显色液,100 μL/孔,20~25 ℃避光显色10 min;加入终止液,50 μL/孔;测定OD450值,分别设SP2/0细胞培养上清、PBS、PBS作为阴性对照,当OD450值大于阴性对照OD450值2倍时对应的最大稀释度作为单克隆抗体的效价。
1.2.5 单克隆抗体的标记及检验
1.2.5.1 辣根过氧化物酶(horseradish peroxidase,HRP)标记单克隆抗体 按照过碘酸盐氧化法标记单克隆抗体,具体操作如下:称取5 mg辣根过氧化物酶(HRP)溶于1 mL双蒸水中,加入500 μL新鲜配制的碘酸钠溶液,2~8 ℃反应30 min,溶液呈草绿色,再加入0.5 mL乙二醇(0.16 mol/L),混匀后室温避光反应30 min。然后加入5 mg纯化后的单克隆抗体,在pH9.5的碳酸盐缓冲液中2~8 ℃透析15 h。次日,在溶液中加入新鲜配制的NaBH40.2 mL,混匀后2~8 ℃反应2 h,再加入等体积的饱和硫酸铵溶液,2~8 ℃静置30 min,7 000 r/min离心10 min,弃上清,用PB缓冲液重悬,在PB缓冲液2~8 ℃透析15 h,收集透析袋内容物。
1.2.5.2 阻断效果检验 为保证阳性血清中含有过饱和抗体与HRP标记后的鼠抗PPRV N单克隆抗体产生竞争作用,用纯化好的PPRV N蛋白包被酶标板,蛋白含量为100 ng/孔,100 μL/孔,4 ℃包被过夜。弃去包被液,PBST洗涤液充分洗涤3次,300 μL/孔,然后向96孔板中加入5%脱脂奶粉进行封闭,200 μL/孔,于37 ℃封闭60 min。弃去封闭液,PBST洗涤液充分洗涤3次,加入阴性血清和阳性血清,为保证阳性血清中含有过饱和抗体,本次试验血清不做稀释,100 μL/孔,37 ℃孵育60 min。PBST洗涤液充分洗涤3次后加入不同倍数稀释的酶标抗体,37 ℃孵育60 min。PBST洗涤液充分洗涤3次后加入100 μL底物显色液,显色10 min后加入50 μL终止液,读数。根据计算公式计算阻断率(PI值),PI值=(1-阳性血清OD值/阴性血清OD值)×100%。
1.2.5.3 效价检验 对HRP标记后的鼠抗PPRV N单克隆抗体从100倍开始往下倍比稀释,按照“1.2.4项”间接ELISA的方法测定酶标抗体的效价,判定标准:选择(待检样本OD450/阴性对照OD450)≥2.1时,对应的最大稀释度为酶标抗体的效价。
1.2.6 竞争ELISA抗体检测方法的建立
1.2.6.1 最佳反应条件的确定 方阵滴定法确定PPRV N蛋白最佳包被浓度和酶标抗体的最佳稀释度。用包被液将PPRV N重组蛋白(起始浓度为1 mg/mL)按1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800和1∶25 600稀释后,分别横向加入酶标板中,每个稀释度加1行(12孔),每孔100 μL,包被酶标板,置2~8 ℃过夜。次日,弃去板孔中包被液,洗板1次,加入200 μL封闭液,置37 ℃作用2 h,弃去板孔中封闭液,拍干;用样品稀释液将已知背景的阴性血清(简称N)和阳性血清(简称P)分别4倍稀释,阴性血清加入1~6列,阳性血清加入7~12列,均是50 μL/孔,再将1G2-HRP酶标抗体(起始浓度为2 mg/mL)按1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000和1∶16 000稀释,纵向加入酶标板中,每个稀释度加1列(8孔)。37 ℃孵育30 min,洗板3次;拍干后加入TMB底物,室温避光反应10 min,以2 mol/L硫酸溶液终止。酶标仪测定OD450,选择N/P值(N:阴性孔平均值;P:阳性孔平均值)最大孔的稀释倍数作为抗原最佳包被浓度和酶标抗体1G2-HRP最佳稀释浓度。按照上述确定条件对最佳封闭液(0.1% BSA、0.2% BSA、0.5% BSA和1%鱼明胶)、封闭时间(1 h、1.5 h和2 h)、待检血清最佳稀释倍数(2倍、4倍、8倍和10倍)、血清和抗原的最佳反应时间(30 min、60 min、90 min和120 min)、底物显色时间(5 min、10 min、15 min和20 min)等条件进行优化。
1.2.6.2 阴阳性临界值的确定 按照优化的cELISA方法检测,对37份阳性血清和81份阴性血清进行PPRV抗体检测,测定的OD450结果按如下公式转换为阻断率PI,PI=(1-S/N)×100%,其中S为被检血清OD450值;N为阴性对照血清OD450均值,利用GraphPad Prism 8.0软件,根据95% CI下的诊断敏感性、特异性以及95% CI下的曲线面积来选择最优临界值。
1.2.7 竞争ELISA抗体检测方法的评价
1.2.7.1 最低检出限 按照优化的cELISA方法检测2倍梯度稀释的PPRV抗体阳性血清,确定最低检出限,评价该cELISA方法的敏感性。
1.2.7.2 特异性评价 按照优化的cELISA方法检测羊痘病毒抗体阳性血清、羊口蹄疫抗体阳性血清、羊pET-30a-BL21(DE3)抗体阳性血清和布鲁氏菌抗体阳性血清(羊源),评价该cELISA方法的特异性。
1.2.7.3 重复性评价 从同一批次和不同批次包被PPRV N蛋白的酶标板中各挑取3块,分别检测10份阳性血清和10份阴性血清样本,每份样品设置3个重复,计算批内或批间变异系数CV=SD/X×100%,评价该cELISA方法的重复性。
1.2.7.4 符合率评价 与血清中和试验进行比较,利用澳大利亚动物健康局兽医流行病学免费软件epitools(http://www.ausvet.com.au/)计算符合率、敏感性、特异性、阳性预测值、阴性预测值和Kappa值。cELISA方法按优化的条件进行检测和判定,血清中和试验操作方法和结果判定如下所述。
(1)将小反刍兽疫活疫苗(Clone 9株),用无血清MEM细胞培养液做10倍系列稀释,取10-5、10-6、10-7和10-84个稀释度,接种生长良好单层Vero细胞的96孔细胞培养板,每个稀释度接种4孔,每孔0.1 mL,置37 ℃、5% CO2培养箱中作用1 h后补加细胞维持液,每孔0.1 mL。置37 ℃、5% CO2培养箱培养6 d,逐日观察并记录细胞病变效应(cytopathic effect,CPE)孔数,按Reed-Muench方法计算TCID50。
(2)将已知毒价小反刍兽疫活疫苗(Clone 9株),用无血清MEM细胞培养液稀释成102.0TCID50/0.1 mL。
(3)将被检血清于水浴中56 ℃灭活30 min。将灭活血清用无血清MEM细胞培养液作1∶8稀释备用。
(4)同时设立对照,按《小反刍兽疫检验技术规范》(SN/T 2733-2010)6.3血清中和试验进行对照设立。
(5)向所有血清稀释孔加入100TCID50/0.1 mL病毒工作液0.1 mL,混匀后,37 ℃作用1 h。向所有孔加入浓度106/mL的Vero细胞悬液0.1 mL,置37 ℃、5% CO2培养箱中培养,期间每日观察细胞病变,记录被检血清各稀释度细胞病变数。
(6)试验成立的条件 接种后6 d,初判结果。符合《小反刍兽疫检验技术规范》(SN/T2733-2010)6.3 血清中和试验的判定标准。弃掉已有特异性病变孔,其余孔培养液换成维持液,继续培养7 d,进行终判。
(7)结果判定 被检血清1∶8的稀释度能抑制50%或50%以上的细胞出现CPE者判为阳性。
2 结果
2.1 PPRV N蛋白的表达、纯化及鉴定
SDS-PAGE电泳显示约在80 ku区域出现与预期大小相符条带(图1),表明成功表达PPRV N蛋白。Western blot结果显示该重组蛋白具有良好的反应原性(图2),PPRV阳性血清能与PPRV N蛋白发生特异性反应,与pET30a空载不发生特异性反应。

M.蛋白Marker; 1.重组蛋白PPRV N
2.2 单克隆抗体的制备及鉴定
经过2次筛选和3次克隆后获得了4株能够稳定分泌抗PPRV N蛋白的单克隆抗体杂交瘤细胞株,用单抗亚类鉴定试剂盒鉴定,单抗亚类均为IgG1型。其中1株1G2间接ELISA法检测腹水效价高达1∶5.12×106,相对亲和力为1.06×107mol/L。验证其具有较好的竞争效果(表1)。诱生的小鼠腹水纯化后,经SDS-PAGE电泳鉴定清晰可见一条大小约50 ku的重链带和一条大小约25 ku的轻链带(图3),BCA法测定单抗浓度为2.0 mg/mL。
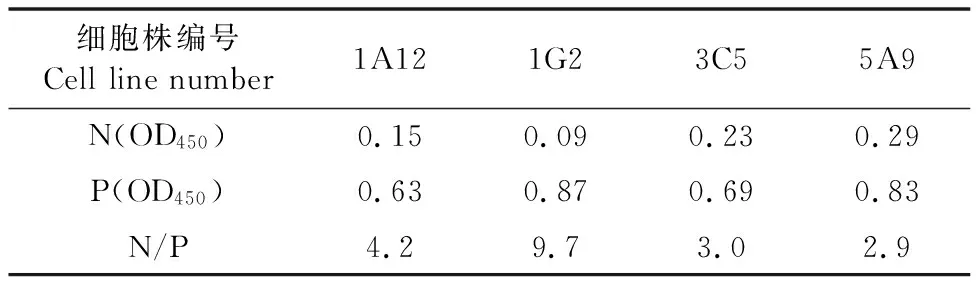
表1 单克隆抗体竞争效果评价
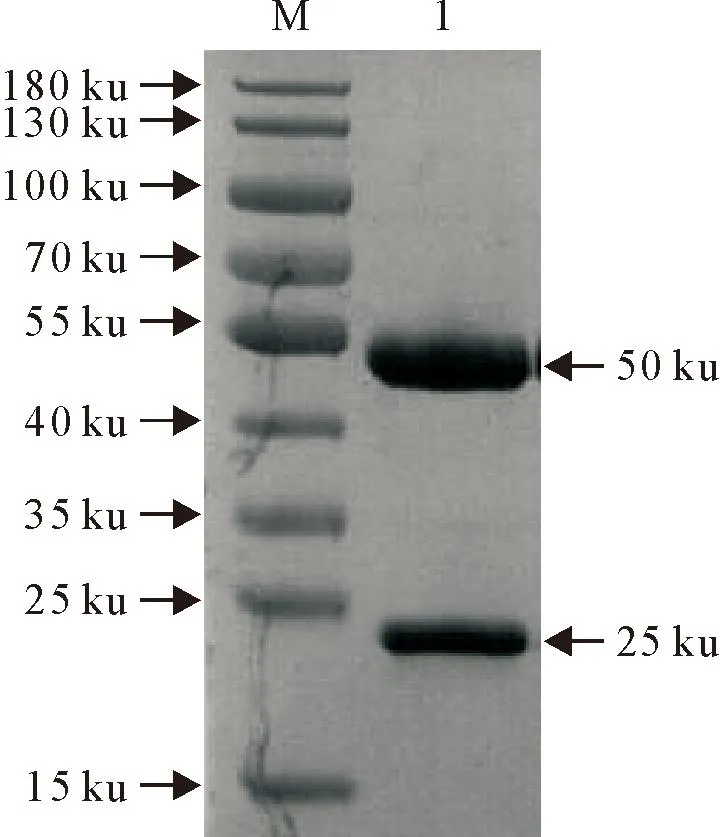
M.蛋白Marker; 1.纯化后的单克隆抗体
2.3 酶标抗体的制备及效价测定
将HRP标记1G2单克隆抗体后,采用间接ELISA方法测定效价,确定酶标抗体(1G2-HRP)的效价为1∶1.28×106。
2.4 竞争ELISA抗体检测方法的建立
2.4.1 最佳反应条件的确定 根据cELISA方阵滴定法结果,最佳抗原包被浓度为1.0 μg/mL(1∶3 200稀释),1G2-HRP最佳工作浓度为250 ng/mL;最佳封闭条件为含0.5% BSA的PBST缓冲液;待检血清最佳稀释条件为4倍稀释;待检血清、1G2-HRP酶标抗体与抗原进行竞争结合的最佳反应时间为60 min;酶标抗体最佳反应时间为30 min;TMB底物的最佳反应条件是在室温下避光作用10 min。
2.4.2 阴阳性临界值的确定 利用GraphPad Prism 8.0软件,根据95% CI下的诊断敏感性、特异性以及95%CI下的曲线面积来选择最优临界值。当临界值为41.53%时,此时诊断敏感性为97.53%,诊断特异性为91.89%,ROC曲线下面积AUC为0.9917(95CI:98.0%~100.0%)。最后结果保留两位有效数字,确定阴阳性临界值为42%。
2.5 竞争ELISA抗体检测方法的评价
2.5.1 最低检出限 疫苗免疫的PPRV抗体阳性血清梯度稀释后,重复3次进行检测,确定最低检出限为1∶128(表2),表明该方法具有较高的敏感性。

表2 最低检出限测定结果
2.5.2 特异性评价 检测羊痘病毒抗体阳性血清、羊口蹄疫抗体阳性血清和羊pET-30a-BL21(DE3)抗体阳性血清,结果均为阴性,阴性率为100%。表明该方法具有较好的特异性。
2.5.3 重复性评价 20份血清的批内重复性与批间重复性的变异系数均在15%以内,表明该方法具有良好的可重复性。
2.5.4 符合率评价 与血清中和试验比较,两者的阳性符合率为87.80%(95%CI:73.80,95.92),阴性符合率为94.95%(95%CI:88.61,98.34),总符合率为92.86%(95%CI:84.11,97.64),Kappa值为0.83(95%CI:53.10,112.50),具有较高的一致性。诊断敏感性为94.74%(95%CI:73.97,98.87),诊断特异性为92.16%(95%CI:81.12,97.82),阳性预测值为81.82%(95%CI:59.72,94.81),阴性预测值为97.92%(95%CI:88.93,99.95),具有较好的准确性(表3,表4)。说明该方法与血清中和试验具有较高的符合率。

表3 cELISA与血清中和试验检测结果

表4 cELISA相对血清中和试验的评估指标统计结果
3 讨论
小反刍兽疫尚无有效的治疗方法,我国执行“免疫-监测-净化”相结合的防控措施[16]。建立快速、有效、准确的检测方法尤其重要。商品化的小反刍兽疫活疫苗(Clone 9株)中含有PPRV弱毒,通过培养PPRV弱毒进行血清中和试验,比较了所建cELISA方法和血清中和试验的符合率。cELISA方法与血清中和试验相比,两者的阳性符合率为87.80%(95%CI:73.80,95.92),阴性符合率高达94.95%(95%CI:88.61,98.34),总符合率高达92.86%(95%CI:84.11,97.64),Kappa值为0.83(95%CI:53.10,112.50)(当Kappa值在0.81~1之间时,表示几乎完全一致),表明所建cELISA方法与血清中和试验具有较高的一致性。相较于血清中和试验,cELISA方法的诊断敏感性高达94.74%(95%CI:73.97,98.87),诊断特异性高达92.16%(95%CI:81.12,97.82),阳性预测值为81.82%(95%CI:59.72,94.81),即在所有检测的阳性动物中,81.82%的动物为真阳性动物;阴性预测值为97.92%(95%CI:88.93,99.95),即在所有检测阴性动物中,高达97.92%的动物为真阴性动物,说明所建cELISA方法对阳性动物和阴性动物均有较高的预测能力。因此,建立的PPRV cELISA抗体检测方法与血清中和试验具有较高的符合率和一致性,操作简便、快速,检测结果稳定,更适合在基层兽医检测实验室全面推广和应用。

