缺血性卒中无复流动物模型建立和多维度评价方案☆
杨馨漩 田昊 赵家慧 郑丽娜 刘丽萍
血管再通是急性缺血性脑卒中治疗的一个重要手段[1-2]。然而,约有一半的患者无法通过血管再通治疗获得良好神经功能预后[3],称为无效再通。约有1/4 的患者不能成功再灌注[4]。除责任血管再闭塞外,微血管循环障碍导致的无复流而不能获得再灌注是主要的病理变化[5]。无复流机制尚不清楚,还需进一步的研究。既往研究中建立和评估脑无复流模型的方法各不相同[6-8],所用小鼠品系及造模方式和缺血时间各有不同,没有公认的方法。本研究目的是为了建立合适的脑无复流模型并对灌注减低进行多维度评价。
1 材料与方法
1.1 实验动物雄性C57BL/6 及BALB/c 小鼠(体质量25~30g,8~12 周龄)购买于斯贝福实验动物科技有限公司(北京,中国)。实验动物饲养于北京市神经外科研究所动物实验室,饲养环境温度(22±2)℃,光照/黑暗周期为12 h,小鼠可自由饮水和采食。实验流程和动物福利保护严格按照实验动物福利伦理法律法规执行。本实验由北京市神经外科研究所实验动物福利伦理委员会批准,批准伦理号为202002005和202201003。
共用雄性C57BL/6 小鼠16 只,5 只用于活体双光子监测(其中2只颅骨窗质量差,成像差),5只用于C57BL/6 sham 组激光散斑血流监测,6 只用于C57BL/6 MCAO 组光散斑血流监测(其中1 只死亡)。BALB/c 小鼠37 只,8 只用于活体双光子监测(其中3 只颅骨窗质量差成像差或死亡),5 只用于BALB/c sham组激光散斑血流监测,6只用于BALB/c tMCAO 1 h 组激光散斑血流监测(其中1 只死亡),7只用于BALB/c tMCAO 1.5 h 组激光散斑血流监测(其中2 只死亡),处死后用于评估全脑灌注改变及免疫荧光染色评估微血管灌注改变;5 只用于BALB/c sham 组行为学评估,6 只用于BALB/c tMCAO 1.5 h组行为学评估(其中1只死亡),处死后用于免疫荧光染色评估脑梗死面积。
1.2 方法
1.2.1 小鼠短暂性大脑中动脉闭塞(transient middle cerebral artery occlusion,tMCAO)模型的制作 4%~5%异氟烷诱导小鼠进行深度麻醉, 1%~2%异氟烷维持麻醉。参照既往研究[9],结扎和切断颈外动脉远端,并从颈外动脉残端将6-0 硅胶涂层线栓(602256PK5Re,Doccol)插入颈内动脉。线栓进一步推进到有轻微阻力,从颈外动脉起始处进入颈内动脉约8~9 mm,即为大脑中动脉起始处。1 h 或1.5 h后,通过抽出线栓使大脑中动脉再通。假手术组(sham 组)进行除了插入线栓以外的操作。在手术和麻醉恢复期间,将小鼠放在加热垫上,保持(37.0±0.5)℃。
1.2.2 激光散斑对比成像动态评估小鼠脑皮质血流变化 参考既往研究[10]使用激光散斑血流成像仪(RFLSI III,深圳瑞沃德生命科技有限公司)测量激光散斑对比成像图。在缺血前、缺血期间以及再通后2 h 和24 h,对皮质灌注进行监测。感兴趣区选在双侧大脑中动脉流域内。此外,计算梗死同侧/对侧脑血流的相对比例。
1.2.3 组织准备 建模后24 h,在处死前10 min通过尾静脉注射100 μL 70 kD 的罗丹明B 异硫氰酸酯(RITC)-葡聚糖(R9379,sigma,5%W/V)。小鼠脑用4%多聚甲醛固定过夜,然后用含有30%蔗糖的4%多聚甲醛溶液固定48 h。使用冰冻切片机收集50 μm或30 μm厚的连续冠状切片。
1.2.4 免疫荧光染色 免疫荧光染色用漂片,血管基底膜用抗胶原IV 抗体(1∶250,Abcam,ab19808)标记,用兔源抗MAP2抗体(1∶200,cst,8707S)染色来评估梗死区。将切片在含有5%山羊血清(Solarbio, SL038)和0.3% Triton X-100 的0.1 mol/L PBS中在室温下封闭1 h。然后一抗4 ℃下孵育过夜,用PBS/Triton X-100 洗涤后,将切片与二抗在室温下孵育1 h。二抗是山羊抗兔Alexa Flour 488(1∶500;Thermo Fisher Scientific,A-11008)。用PBS/Triton X-100 清洗后,用抗荧光衰减封片剂(Solarbio,S2100)封片。通过激光共聚焦显微镜(LSM 710;Zeiss,德国)获得用于血管分析的Z-堆图。MAP2染色的图像用Vectra Polaris(PerkinElmer, Spokane,WA, United States)进行扫描。
1.2.5 梗死面积的量化 从前囟层面开始每隔7 张脑片选取一张30 μm 厚切片用于评估梗死面积,使用ImageJ(1.53t 版,美国NIH)计算MAP2阴性和全脑的面积。用梗死面积÷全脑面积,得到梗死面积与全脑的占比。
1.2.6 颅窗手术 用颅骨钻在运动感觉皮质上方做一个直径3 mm颅骨窗(右侧,距Bregma点-3.0 mm,外侧3.5~4.0 mm)。其余暴露颅骨表面用牙科水泥封闭,并用牙科水泥将定制头件固定在颅骨上。
1.2.7 双光子成像观察大脑中动脉血流及测量微血管流速变化 在双光子成像前一天制作颅内窗。在缺血前、缺血期间以及再通后2 h 和24 h,使用配备有MaiTai 双光子激光器和20 倍水浸物镜的双光子显微镜(LSM 880, Axio Examiner;蔡司)进行成像。显微镜由ZEN 2011 软件(黑色版,蔡司,德国)控制,在测量过程中,小鼠固定在定制金属板上,并如造模所述保持麻醉状态。在成像前10 min,从尾静脉注射100 μL RITC-葡聚糖,并用800 nm 激光激发,以观察血管。血管的Z-堆记录为512 × 512 像素,帧扫描时间943.72 ms,覆盖约425 μm×425 μm×120 μm 的体积。此外,每个Z-堆记录10 帧。红细胞的流速和流量通过线扫描获得[11],2000 循环,帧扫描时间为1.84 ms。
1.2.8 全脑灌注分析 从前囟对应脑平面开始,每7片脑切片选取一片30 μm 厚代表脑片,一共6 片脑片,封片后用Vectra Polaris (PerkinElmer,华盛顿州斯波坎,美国)仪器进行成像,使用Image J(1.53t,美国国立卫生研究院)软件测量每个半脑切片的平均RITC-葡聚糖信号强度,并对其进行伪彩色化。该信号可评估脑组织灌注。此外,计算梗死同侧/对侧RITC-葡聚糖信号强度的比。
1.2.9 行为学评估 行为学评估在再通后24 h 进行,使用改良神经功能评分(modified neurological function score, mNSS)。mNSS 的评分标准为0~18分(分数越高代表损伤越严重):0 分,正常;1~6分,轻度损伤;7~12 分,中度损伤;13~18 分,严重损伤[12-14]。
1.3 统计学方法统计分析及作图采用GraphPad Prism(9.4.0 版)。数据使用D'Agostino & Pearson 检验进行正态性测试,用±s描述数据。正态分布数据用t检验比较,同一批小鼠多时间点血流数据比较用两因素重复测量方差分析。非正态分布数据用Mann-Whitney检验分析。检测水准α=0.05。
2 结果
2.1 脑无复流模型的建立
2.1.1 C57BL/6 sham 组和C57BL/6 tMCAO 1 h 组多时间点皮质灌注对比 激光散斑血流监测显示,脑血流数据采用两因素重复测量方差分析,发现组间(F=40.452,P<0.001)、时间(F=73.712,校正P<0.001)、时间与组间(F=22.798,校正P<0.001)存在交互效应,故进行成对比较。分析发现大脑中动脉阻塞时,C57BL/6 tMCAO 1 h 组皮质灌注减少70.3%,而C57BL/6 sham 组减少11.3%。再通后2 h,C57BL/6 tMCAO 1 h组与C57BL/6 sham 组间的差异有统计学意义(P<0.001)。当再通后24 h 时,两组无统计学差异(P>0.999)。见图1和表1。

Fig.1 Scattered representative images of C57BL/6 mice sham group and tMCAO 1 h group at multiple time points showing cortical perfusion图1 C57BL/6 小鼠sham 组和 tMCAO 1 h 组多时间点的散斑代表图,显示皮质灌注情况
Tab.1 Changes in cerebral blood flow in mice assessed by laser scatter contrast imaging(±s,n=5)表1 激光散斑血流仪评估小鼠脑血流变化(±s,n=5)
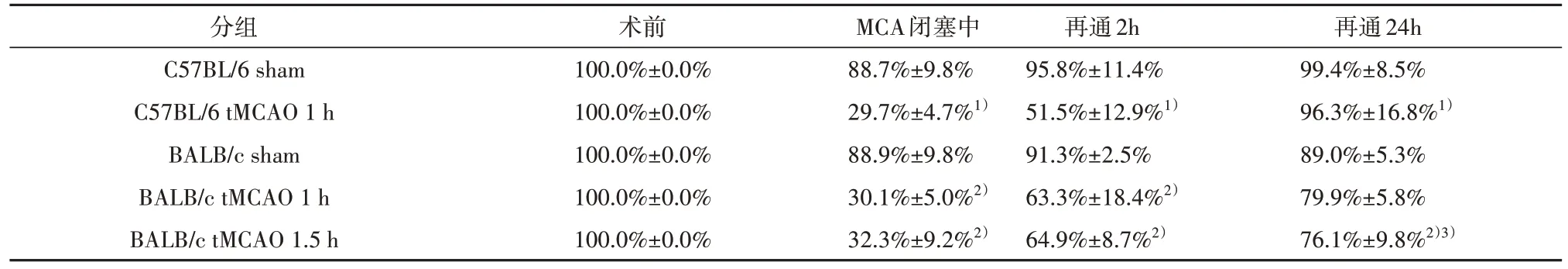
Tab.1 Changes in cerebral blood flow in mice assessed by laser scatter contrast imaging(±s,n=5)表1 激光散斑血流仪评估小鼠脑血流变化(±s,n=5)
1)与C57BL/6 sham 组比较,采用两因素重复测量方差分析,P<0.05;2)与BALB/c sham 组比较,采用两因素重复测量方差分析,P<0.05;3)与C57BL/6 tMCAO 1 h组比较,采用两因素重复测量方差分析,P<0.05。
分组C57BL/6 sham C57BL/6 tMCAO 1 h BALB/c sham BALB/c tMCAO 1 h BALB/c tMCAO 1.5 h术前100.0%±0.0%100.0%±0.0%100.0%±0.0%100.0%±0.0%100.0%±0.0%MCA闭塞中88.7%±9.8%29.7%±4.7%1)88.9%±9.8%30.1%±5.0%2)32.3%±9.2%2)再通2h 95.8%±11.4%51.5%±12.9%1)91.3%±2.5%63.3%±18.4%2)64.9%±8.7%2)再通24h 99.4%±8.5%96.3%±16.8%1)89.0%±5.3%79.9%±5.8%76.1%±9.8%2)3)
2.1.2 C57BL/6 与BALB/c 小鼠双光子活体成像多时间点血流对比 见图2。活体双光子显微镜观察中,C57BL/6 小鼠在大脑中动脉闭塞时,大脑中动脉主干远端的血流在缺血期间方向逆转(图2C 大白箭头指示),并且大脑中动脉流域内几乎所有毛细血管血流仍然流动。大脑中动脉阻塞期间BALB/c 小鼠大脑中动脉远端主干的血流几乎停滞。BALB/c 小鼠大脑中动脉区域内大多数毛细血管是阻塞状态,一些毛细血管在再通后2 h 和24 h后仍然阻塞。

Fig.2 Comparison of two-photon in vivo imaging of blood flow at multiple time points in C57BL/6 and BALB/c mice图2 C57BL/6与BALB/c小鼠双光子活体成像多时间点血流对比 A,颅窗位置示意图,黑色圆圈示意颅窗位置,覆盖了右侧感觉运动皮质。B,颅窗的显微镜图,标尺为500 μm。C、D,双光子活体成像代表图。C和D分别展示了C57BL/6 和BALB/c小鼠大脑中动脉阻塞时大脑中动脉远端分支及大脑中动脉流域毛细血管的双光子活体图像,及再通2 h和24 h大脑中动脉流域毛细血管的双光子活体图像。白色大箭头表示大脑中动脉血流反向,白色小箭头示意毛细血管阻塞部位,标尺为100 μm。
2.1.3 BALB/c sham 组、BALB/c tMCAO 1 h 组和BALB/c tMCAO 1.5 h 组多时间点皮质灌注对比 激光散斑血流仪监测BALB/c 小鼠缺血再通期间血流情况,脑血流数据采用两因素重复测量方差分析,发现组间(F=57.601,P<0.001)、时间(F=96.178,校正P<0.001)、时间与组间(F=15.960,校正P<0.001)存在交互效应,故进行成对比较。分析结果显示大脑中动脉阻塞时,BALB/c tMCAO 1 h 组与BALB/c tMCAO 1.5 h组皮质脑血流量下降无统计学差异(P>0.999)。在再通后2 h,BALB/c tMCAO 1 h 组(P<0.001)和BALB/c tMCAO 1.5 h 组(P<0.001)与BALB/c sham 组的差异有统计学意义。再通后24h,BALB/c tMCAO 1 h 组与BALB/c sham 组无明显差异(P=0.299),而BALB/c tMCAO 1.5 h 组与BALB/c sham组间的差异有统计学意义(P= 0.046)。见表1、图3。
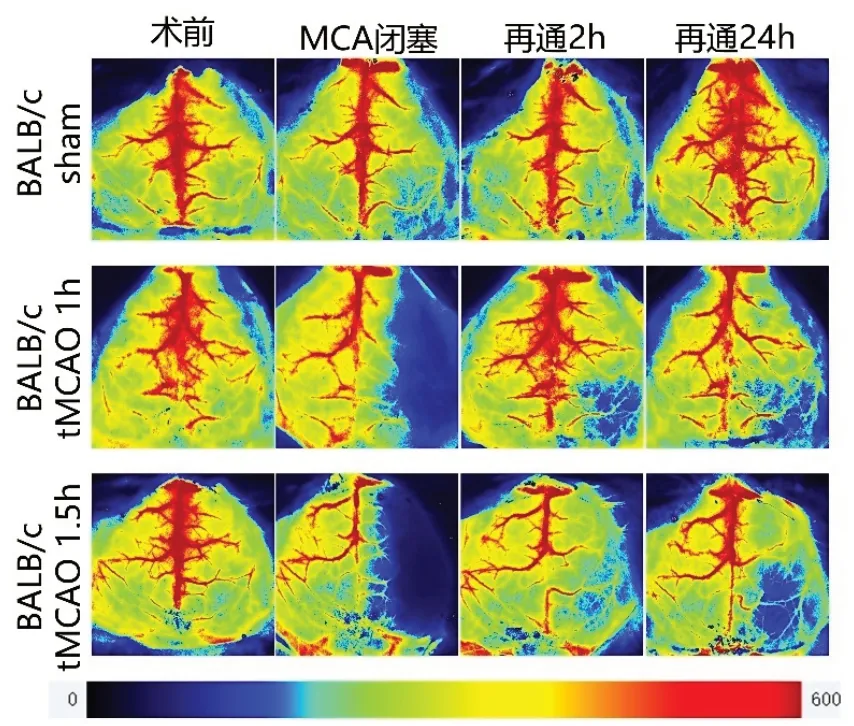
Fig.3 Scattered representative images of the BALB/c sham group,tMCAO 1 h and tMCAO 1.5 h groups at multiple time points showing cortical perfusion图3 BALB/c sham组、tMCAO 1 h 和 tMCAO 1.5 h 组多时间点的散斑代表图,显示皮质灌注情况
2.1.4 C57BL/6 tMCAO 1 h组和BALB/c tMCAO 1.5 h组多时间点皮质灌注对比 表1 可见C57BL/6 tMCAO 1 h 组与BALB/c tMCAO 1.5 h 组脑血流量对比,脑血流实验数据采用两因素重复测量方差分析,发现组间(F=138.900,P<0.001)、时间(F=88.026,校正P<0.001)、时间与组间(F=49.680,校正P<0.001)存在交互效应,故进行成对比较。结果显示大脑中动脉阻塞时,C57BL/6 tMCAO 1 h 组与BALB/c tMCAO 1.5 h 组皮质血流下降无统计学差异(P>0.999);再通2 h 后,两组血流比较仍无统计学差异(P=0.129)。而再通24 h 时,两组间的差异有统计学意义(P=0.008)。BALB/c tMCAO 1.5 h 组较C57BL/6 tMCAO 1 h组在大脑中动脉再通24 h后皮质脑血流量多降低20.2%。
2.2 BALB/c 小鼠短暂性大脑中动脉闭塞1.5 h 导致脑无复流的多维度评价
2.2.1 全脑切片灌注评估 再通24 h 后,用全脑切片梗死侧/对侧罗丹明B 异硫氰酸酯-葡聚糖平均荧光强度表示脑灌注,结果显示与BALB/c sham 组相比,BALB/c tMCAO 1.5 h 组再通后出现无复流。BALB/c tMCAO 1.5 h 组脑灌注量减少至75.1%,而BALB/c sham 组脑灌注量为100%,两组间差异有统计学意义(t=9.221,P<0.001,图4A、B)。
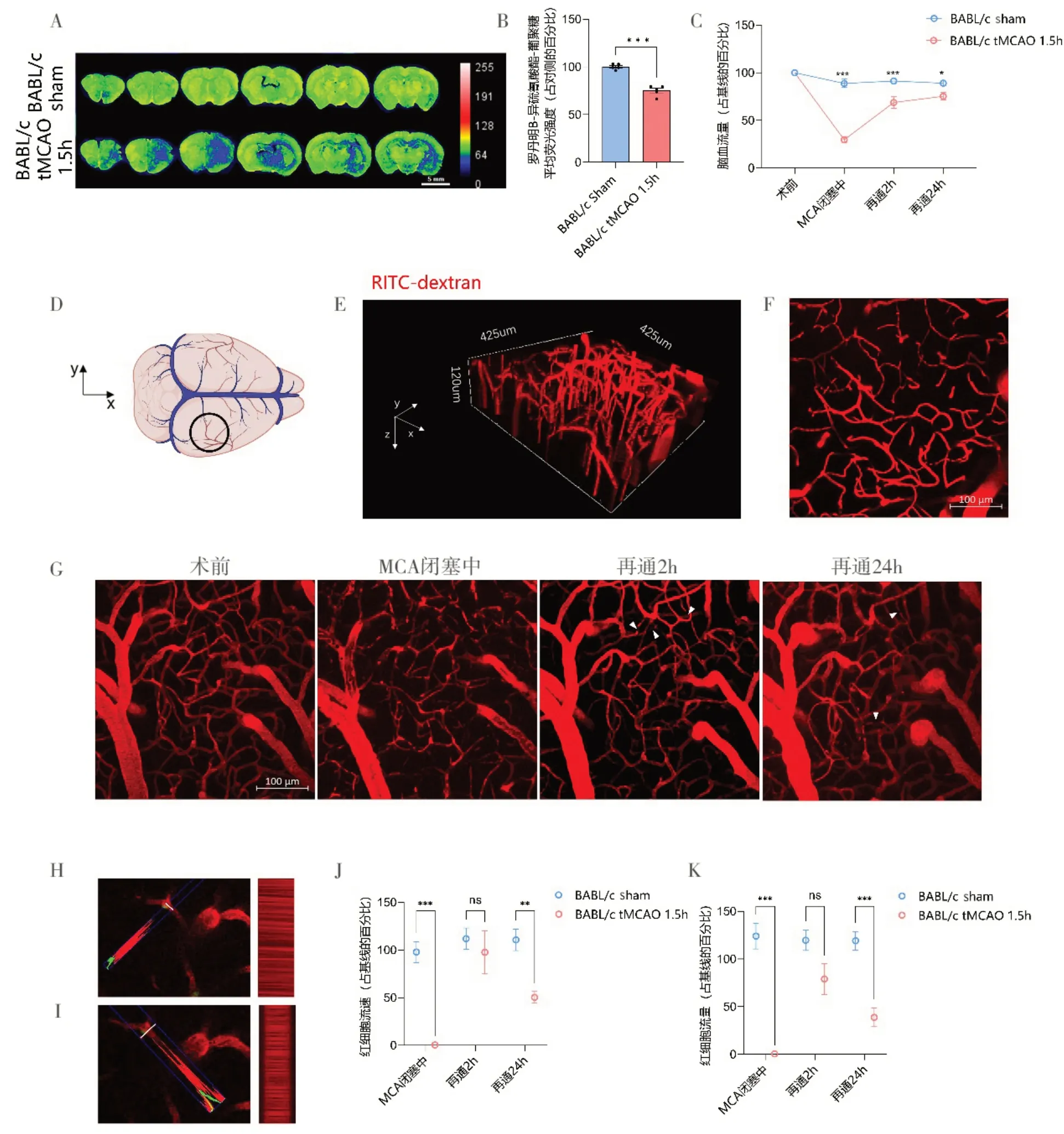
Fig.4 Decreased cerebral blood flow due to transient middle cerebral artery occlusion in BALB/c mice for 1.5 h图4 BALB/c 小鼠短暂性大脑中动脉闭塞1.5 h 导致脑血流量下降 A,活体灌注罗丹明B 异硫氰酸酯-葡聚糖后全脑切片示意图(伪彩),切片时间点为再通24 h。B,定量A 图中假手术组及tMCAO 1.5 h组再灌24 h的切片罗丹明B 异硫氰酸酯-葡聚糖的平均荧光强度,计算为梗死侧/对侧平均荧光强度比值,显示全脑灌注情况。每组数量n=5,数据用平均值±标准差表示,*** P<0.001,双侧t检验。C,激光散斑血流监测定量BALB/c 小鼠假手术组和tMCAO 1.5 h 组感兴趣区(图1A 中的方框所示意大脑中动脉流域)多时间点的脑血流灌注值,计算为与基线的比值。每组数量n=5,数据用平均值±标准差表示。* P<0.05,*** P<0.001,两因素重复测量方差分析。D,双光子图方位的示意图显示颅骨窗的位置。E,双光子拍摄血管的Z-堆3D 重建图(425μm × 425μm×120 μm),血流用静脉注射的罗丹明B 异硫氰酸酯-葡聚糖标记(红色)。 F,E 图中Z-堆血管图的Z轴最大密度投影(比例尺100 μm)。G,缺血前基线、大脑中动脉闭塞术中、大脑中动脉再通2 h和大脑中动脉再通24 h血管图的Z 轴最大密度投影,白色小箭头示意阻塞部位(比例尺100 μm)。H、I,双光子线性扫描代表图。(H 为沿着毛细血管长轴扫描,I 为垂直于毛细血管长轴扫描)。J、K,定量大脑中动脉闭塞术中、大脑中动脉再通2 h和大脑中动脉再通24 h红细胞流速(J)和流量(K)与缺血前基线的比值(占基线水平的百分比)。每组数量n=5,数据用平均值±标准差表示。** P<0.01,*** P<0.001,两因素重复测量方差分析。
2.2.2 激光散斑血流监测 激光散斑血流监测脑血流数据采用两因素重复测量方差分析,发现组间(F=102.52,P<0.001)、时间(F=50.081,校正P<0.001)、时间与组间(F=28.862,校正P<0.001)存在交互效应,故进行成对比较。分析结果显示再通2 h 后,BALB/c tMCAO 1.5 h组皮质血流与BALB/c sham 组的差异有统计学意义(P<0.001,图3C)。在再通后24 h 时,两组间差异仍有统计学意义(P=0.026,图4C)。
2.2.3 双光子显微镜获得的毛细血管Z-堆视频和红细胞流速流量 双光子成像位置及方位见图4D~F,颅骨窗位置位于右侧感觉运动皮质区,成像范围425 μm × 425 μm × 120 μm。双光子成像显示再通2 h 后,仍有部分毛细血管血流阻滞(图4G 小白箭头);红细胞流速数据采用两因素重复测量方差分析,发现组间(F=28.221,P<0.001)、时间(F=10.685,校正P<0.001)、时间与组间(F=5.973,校正P=0.010)存在交互效应,故进行成对比较。红细胞流量数据采用两因素重复测量方差分析,发现组间(F=79.743,P<0.001)、时间(F=5.501,校正P=0.010)、时间与组间(F=6.883,校正P=0.040)存在交互效应,故进行成对比较。分析发现BALB/c tMCAO 1.5 h 组红细胞流速恢复到基线水平的97.7%,而BALB/c sham 组为基线水平的111.9%,两组无统计学差异(图4J,P>0.999)。tMCAO 1.5 h 组红细胞流量恢复到基线水平的79.0%,BALB/c sham 组为基线水平的119.6%,两组无统计学差异(图4K,P=0.050)。当再通后24 h 时,仍有部分毛细血管血流阻滞(图4G 小白箭头),tMCAO 1.5 h 组红细胞流速降至基线水平的50.3%,BALB/c sham 组为基线水平的110.7%,两组间差异有统计学意义(图4J,P=0.010)。而tMCAO 1.5 h 组红细胞流量降至基线水平的38.9%,BALB/c sham 为基线水平的119.2%,两组间差异有统计学意义(图4K,P<0.001)。
2.2.4 高放大倍数的免疫荧光染色切片灌注评估更高放大倍率的切片免疫荧光染色显示,毛细血管大量阻塞(图5C)。50 μm 厚的共聚焦显微镜成像Z-堆图(212.45μm × 212.45 μm)显示,每个图像区域内BALB/c tMCAO 1.5 h 组总的有灌注的毛细血管长度减少了约76%(BALB/c sham 组 997 μm ±103 μm ,BALB/c tMCAO 1.5 h组 241 μm ± 33 μm,t=7.016,P<0.001),有灌注的毛细血管占据的总体积分数也减少了约76%(BALB/c sham 组0.0539 ±0.0055,BALB/c tMCAO 1.5 h 组0.0128 ± 0.0018,t=7.122,P<0.001,图5D和E)。

Fig.5 Transient middle cerebral artery occlusion in BALB/c mice for 1.5 h results in no cerebral microvascular re-flow图5 BALB/c小鼠短暂性大脑中动脉闭塞1.5 h导致脑微血管无复流 A,MAP2染色显示梗死区域(MAP2阴性区域),示意共聚焦成像所选感兴趣区位置。B、C, A中位置梗死区毛细血管代表图。B为假手术组,C为tMCAO 1.5 h组,切片时间点为再通24 h。图示分别为罗丹明B异硫氰酸酯-葡聚糖(红色)标记的有灌注的血管、抗胶原-IV抗体(绿色)标记所有的血管、罗丹明B异硫氰酸酯-葡聚糖和抗胶原-IV抗体的叠加,以及有灌注的血管的分析骨架(黄色)。比例尺50 μm。D、E,假手术组、tMCAO 1.5 h组再通24 h的切片总的有灌注的毛细血管长度(D)和有灌注毛细血管体积占比(E)的比较。切片为共聚焦拍摄的50 μm厚的Z-堆。每组小鼠数n=5,假手术组Z-堆图数量为19,tMCAO 1.5 h组Z-堆图数量为27。数据用平均值±标准差表示, *** P<0.01,双侧t检验。
2.2.5 梗死面积和行为学评估 用微管蛋白2 染色来评估缺血再通24 h 后的梗死面积,结果显示BALB/c tMCAO 1.5 h 组再通24 h 时梗死面积占全脑面积约36%(图6A、B),用mNSS评分评估血再通24 h后的行为学评分,结果显示BALB/c tMCAO 1.5 h组再通24 h时表现为中度行为学缺损,评分平均为9分(图6C)。
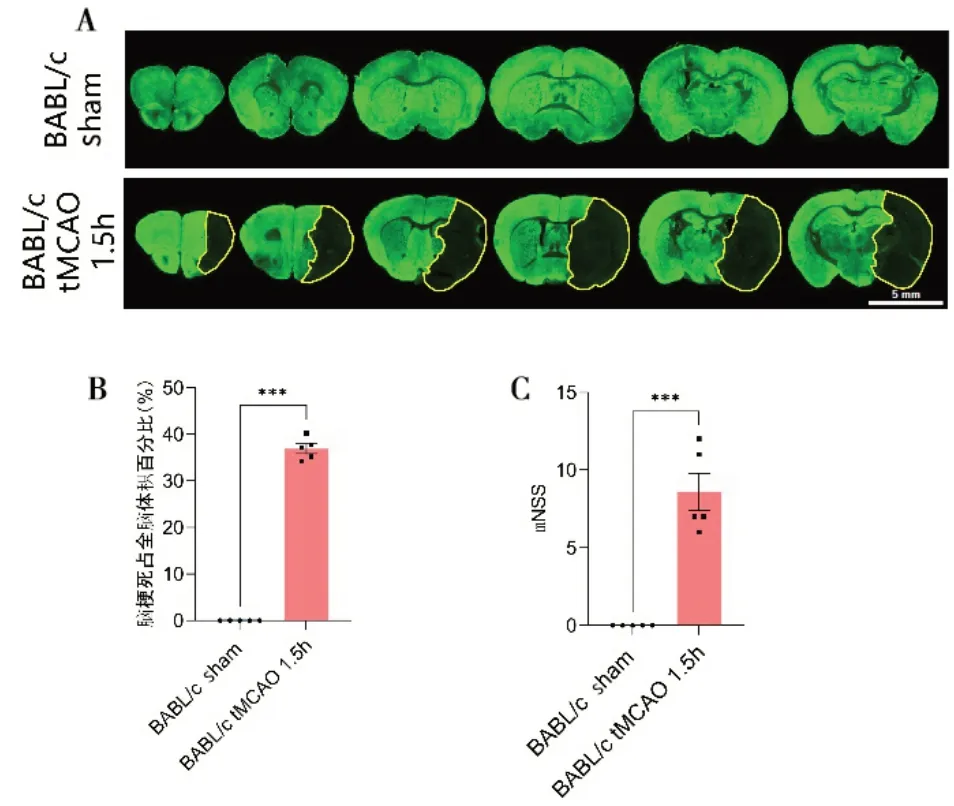
Fig.6 Transient middle cerebral artery occlusion in BALB/c mice for 1.5 h results in cerebral infarction and behavioural deficits图6 BALB/c 小鼠短暂性大脑中动脉闭塞1.5 h 导致脑梗死及行为学缺损 A,MAP2染色显示假手术组、tMCAO 1.5 h 组梗死区域的代表图(MAP2 阴性区域,黄线勾画)。B,柱状图显示假手术组、tMCAO 1.5 h组再通24h时的梗死面积占比。每组数量n=5,数据用均值±标准差表示,***P<0.001,双侧t 检验。C,柱状图显示假手术组、tMCAO 1.5 h 组再通24 h 的mNSS 评分。每组数量n=5,数据用平均值±标准差表示,***P<0.001,双侧t检验。
3 讨论
本研究发现BALB/c tMCAO 1.5 h 与既往研究中常用的C57BL/6 tMCAO 1 h相比更适合用于无复流模型的建立,它所导致的脑灌注量下降更为明显,无论皮质还是全脑灌注量均明显下降。结合切片全脑灌注评估、激光散斑血流监测活体评估皮质脑血流量、双光子活体成像评估大脑中动脉流域皮质表面毛细血管血流,以及高倍率切片成像评估毛细血管灌注对BALB/c 小鼠短暂性大脑中动脉闭塞1.5 h 导致的脑灌注下降以及毛细血管无复流进行多维度评估。本研究的数据提供了建立和评估脑无复流模型的合适条件,为后续脑无复流的动物研究提供了参考。
既往研究中,短暂性远端或近端大脑中动脉闭塞用于建立脑无复流模型。在短暂性远端大脑中动脉闭塞中,用血栓阻塞大脑中动脉远端主干或外力阻断大脑中动脉[8,15],然后静脉注射阿替普酶溶栓[7]或松解外力实现再通。在短暂性近端大脑中动脉闭塞中,用线栓阻塞大脑中动脉。近年,急性缺血性卒中机械取栓术后出现无复流一直是热点话题,而近端大脑中动脉闭塞更接近临床情况。因此,我们选择了血管内线栓阻塞大脑中动脉来建立脑无复流模型。至于缺血时间,既往研究中从30 min到2 h不等,所用实验动物品种也多样,包括C57BL/6、BALB/c、CB-17、SV129 和瑞士白化病小鼠等[6-7,16-18]。在血管内线栓阻塞大脑中动脉模型中,缺血少于1 h 会导致梗死体积不稳定[19]。同时,无复流与较长的缺血时间有关[20],但较长的缺血时间会导致高死亡率。不同品系小鼠对缺血的敏感性也不同[21-24]。既往研究最常用C57BL/6 小鼠缺血1h[6,8,10],因此我们首先尝试了此条件。然而,我们发现再通24 h 时,激光散斑血流监测显示C57BL/6 sham 组和C57BL/6 tMCAO 1 h 组之间大脑中动脉流域皮质脑血流量无显著差异(图1和表1)。
双光子成像进一步评估显示大脑中动脉阻塞期间,C57BL/6 小鼠大脑中动脉远端主干血流反向,大脑中动脉区域内大多数毛细血管中仍有血液流动。上述结果表明,C57BL/6 不是评估脑无复流的理想品系。考虑到侧支循环差可能与无复流有关,临床患者大多侧支代偿较差,并且与C57BL/6相比,BALB/c 小鼠侧支代偿较差[25],可能更贴合临床患者情况,因而我们转向BALB/c 小鼠。双光子成像显示BALB/c 小鼠大脑中动脉阻塞期间,大脑中动脉远端主干流动几乎停滞,同时大脑中动脉区域内大多数毛细血管也是阻滞状态,再通2 h和24 h时仍有部分毛细血管阻滞(图2C、D)。所以BALB/c小鼠可能是更合适的选择。
关于缺血时间,2 h 缺血意味着极高的死亡率,因此我们将缺血1 h和1.5 h组与BALB/c sham 组进行比较。结果显示,再通后2 h 缺血1 h 和1.5 h 组均导致大脑中动脉流域皮质脑血流量降低。然而,到再通后24 h时,虽然BALB/c tMCAO 1 h组脑血流量较BALB/c sham 组下降,但差异无统计学意义。而BALB/c tMCAO 1.5 h 组的脑血流量与BALB/c sham 组相比两组间的差异有统计学意义(图2B)。同时与前期常用的C57BL/6 tMCAO 1 h 相比,BALB/c tMCAO 1.5 h 在再通24 h 时,皮质脑血流量下降20.2%(表1)。因此,BALB/c 小鼠大脑中动脉闭塞持续1.5 h 可能更适用于评价脑无复流现象。这与前期研究一致,该研究表明,当近端大脑中动脉闭塞时间超过1h,血管再通后存在毛细血管的持续阻塞[17,26]。
无复流的评估包括激光散斑血流监测、激光多普勒、相位分辨光学相干断层扫描、双光子活体成像评估毛细血管停滞和流动状态、低倍全脑切片量化组织灌注、高放大倍数的图像评估毛细血管阻滞和荧光图像量化红细胞阻塞[7-8,15-16,27]。激光多普勒只能评估一个较小区域,激光散斑血流监测可以监测整个表面血流量,并计算感兴趣区的血流量。然而,检测范围仅限于表面,无法到达深层组织。相位分辨光学相干断层扫描可以测量深度为几百微米的皮质表面红细胞流速,双光子激光扫描显微镜的Z-stacks + 时间序列可以获取3D 血管网络图和血流视频。此外,线性扫描还可以获得所选血管的红细胞流速和流量。相位分辨光学相干断层扫描和双光子激光扫描显微镜的缺点是测量范围限制在小区域内。灌注后切片的低倍视图可以评估全脑灌注。我们使用同侧/对侧罗丹明B 异硫氰酸酯-葡聚糖平均荧光强度比值来评估梗死侧灌注减少的情况,类似于临床使用计算机断层扫描灌注或磁共振灌注的评估。切片的缺点在于它不是活体的评估。高放大倍数的图像可以观察到单根毛细血管阻滞,以及可以用荧光图像量化红细胞阻塞,反应微观情况下毛细血管的灌注情况。
我们结合激光散斑血流监测、灌注后切片的低倍视图、双光子显微镜获得的毛细血管Z-堆视频和红细胞流速流量,以及高放大倍数切片免疫荧光染色图像来评估短暂性大脑中动脉缺血再通后脑灌注的变化。活体评估了表面皮质大脑中动脉流域脑灌注量及毛细血管血流情况,同时用脑切片评估了全脑灌注情况和微观毛细血管的阻塞,从多维度较全面地评估了BALB/c 小鼠大脑中动脉缺血1.5 h后再通所致的毛细血管无复流和脑灌注下降,以支持此模型的可行性,并为脑无复流的动物研究评估提供了参考。
当然,我们研究也有一定局限性,只比较了常用的C57BL/6 和BALB/c 小鼠,可能有其他更适合的小鼠品系或转基因鼠,将来可增加品系或设计转基因鼠进一步研究;另外BALB/c 小鼠短暂性缺血1.5 h死亡率较高,使得实验成本稍有增加。
总的来说, BALB/c 小鼠与C57BL/6 小鼠相比更适合用于无复流模型的建立。另外,在BALB/c小鼠中,与缺血1 h 相比,短暂性缺血1.5 h 所导致的脑灌注量下降更为明显,无论皮质还是全脑灌注量均有明显下降,更适合用于无复流模型的建立。我们建立和多维度评估脑无复流模型的合适方法,为后续脑无复流的动物研究提供了支持。

