成人发病的伴钙化与囊变的脑白质病一例
吴赞 杨宇浩 尹宏伟 王炎强 杨廷舰
患者,男,22岁,因“头痛伴视物模糊20天”于2019年4月22日收入潍坊医学院附属医院。患者20天前无明显诱因出现头痛,伴右眼视物重影,伴恶心、呕吐,无头晕、意识障碍、肢体活动障碍,就诊于当地诊所,予对症治疗(具体用药不详)后头痛及视物模糊无好转。后患者于当地医院行颅脑CT检查,结果示多发占位(患者口诉,未见报告),为求进一步治疗遂来我院就诊。患者既往身体健康,无特殊病史及家族史。入院体格检查:T 36.7 ℃,P 91次/分,R 17次/分,Bp 131/85 mmHg,双肺呼吸音清晰,未闻及明显干湿啰音;心律规整,心音正常,心脏各瓣膜听诊区未闻及杂音及心包摩擦音;腹软,无压痛及反跳痛;四肢关节无肿胀及压痛。神经系统及专科体格检查:意识清醒,语言清晰流利,听力正常,双侧额纹及鼻唇沟对称,伸舌居中,示齿充分,双侧瞳孔等大等圆,直径3.00 mm,对光反应灵敏,辐辏反射正常,视力右侧重影,左侧无异常,视野及眼球活动均正常,浅感觉、四肢肌力及肌张力均正常,巴氏征阴性,颈部无抵抗感。初步诊断:颅内占位性病变。入院后实验室检查:血常规(含网织红细胞)、尿常规、C反应蛋白、降钙素原、磷酸肌酸激酶、磷酸肌酸激酶同工酶、电解质(包括钙、磷酸盐、碱性磷酸酶和乳酸)、肝、肾功能、凝血功能均正常。心电图和胸片均未见异常。入院辅助检查:心脏、腹部、肾脏彩超等均未见明显异常。2019年4月22日颅脑CT平扫结果示:右侧额叶、左侧顶叶囊性病变,可见双侧丘脑高密度钙化。诊断:囊变的脑白质病(图1)。2019年4月23日眼底镜检查:双眼视盘水肿,右眼著。2019年4月23日颅脑MRI(平扫及强化序列)示伴钙化囊变的脑白质病(图2)。结合病史、体格检查及各项辅助检查,修正诊断为:脑白质病。排除手术禁忌证后,于2019年4月25日全麻下行“开颅大脑病损切除术”。手术一次性完整切除了双侧额叶的囊变及囊壁,术中证实左侧额叶囊变内部存在棕黄色血性液体。术中见囊壁较韧,囊壁内存在红色血管瘤样结节。术后病理明确诊断,病理组织HE染色见血管瘤样扩张的微小血管病变,胶质细胞增生伴Rosenthal纤维和含铁血黄素沉积(图3)。免疫组化检查结果示:GFAP(+)、IDH1(+)、ATRX(+)、Olig-2(+)、S100(+)、NF(+)、CD68(-)、CD138(-)、CD34(vascular+)、CD3(T cells+)、CD20(B cell+)、NeuN(neurons+)。患者术后颅高压症状和右眼视物重影消失,病情好转出院。术后密切随访1年患者病情稳定,无新发症状。2020年7月10日复查颅脑MRI及增强MRI示双侧术区均未见囊变复发(图4)。
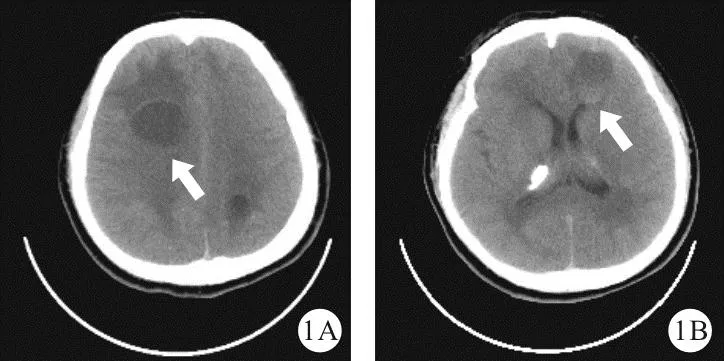
图1 2019年4月22日患者颅脑CT平扫结果(A:右侧额叶囊变和脑室周围可见低密度水肿样脑白质病变;B:左侧额叶囊变下半部分可见高密度出血表现;如箭头所示,横断面)
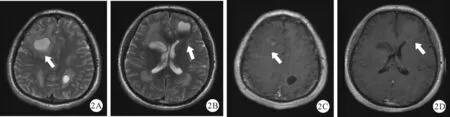
图2 2019年4月23日患者颅脑MRI平扫+强化结果(A:平扫,右侧囊变与脑白质病变在T2WI上更为明显;B:平扫,可见左侧出血囊变内“血液平面”;C:强化,右侧额叶囊变上可疑强化结节;D:强化,左侧额叶囊变周围轻微“环形强化”;如箭头所示,横断面)

图3 2019年4月30日患者组织病理检查结果(A:囊壁结节,HE染色,×40;B:含铁血黄素沉积,HE染色,×40;C:大量Rosenthal纤维沉积,HE染色,×100;如箭头所示)
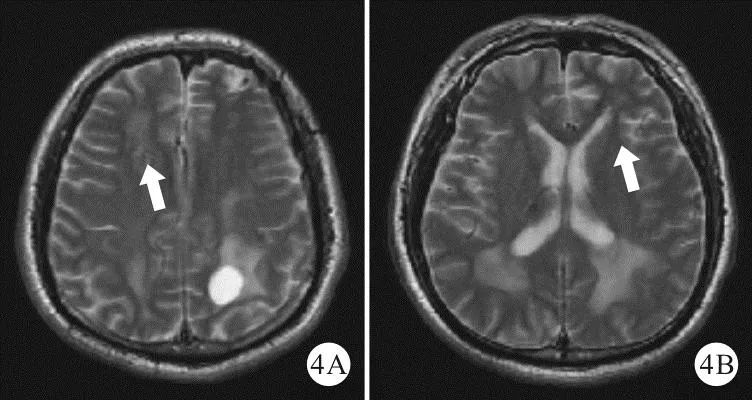
图4 2020年7月10日患者复查MRI平扫结果(A、B:双侧手术后的囊变及囊变周围的水肿样脑白质病变均消失,脑室周围及未手术的左顶叶囊变及周围水肿样脑白质病变仍存在;术区如箭头所示,横断面)
讨 论
伴钙化与囊变的脑白质病(LCC)是一种极为罕见的神经疾病。1996年,Labrune等[1]第1次通过3例儿童发病的病例描述了LCC,所以该疾病又叫Labrune综合征。LCC多在儿童时期即发病,成人时期发病更为少见[2]。2006年Corboy等[3]第1次报道了成人发病的LCC病例,之后相关的文献也多为个案报道。LCC发病机制尚不明确,多认为是一种微小血管病变[3]。由于该病脑内囊变存在出血风险,导致疾病进展,所以准确诊断并及时手术治疗尤为关键[4]。
LCC发病率低,多在儿童时期起病,成人起病的患者可能在出现症状前长期潜伏[5],女性患者相对多见[2]。2017年,Jenkinson等[6]提出LCC是一种与SNORD118基因突变有关的微小血管病。儿童时期发病的患者首发症状以癫痫多见,而成人以颅高压症状较为多见[6]。LCC通常具有典型的影像学“三联征”,即脑组织钙化、多发囊变及水肿样的脑白质病变,与疾病命名一致。钙化和囊变均可发生于颅内任何部位,钙化以大脑半球基底节区最为常见,囊变以大脑半球半卵圆中心区域多见[7]。囊变通常是导致患者临床症状及体征的责任病灶,所以神经功能受损的症状也主要取决于囊变的位置[5]。其次,囊变发生出血也是疾病进展或囊变增大的重要因素[4]。类似水肿样的脑白质病变多发于脑室或囊变周围,但并非单纯的脑水肿,洪柳等[8]认为可能也与脑白质脱髓鞘有关。本例患者同时出现“右眼视物重影”,而以往尚无此种病例报道,考虑可能为占位干扰动眼神经所致,但缺乏有力证据。
LCC往往需要通过术后组织病理检查确诊,其HE染色具有典型特点,通常表现为微小血管血管瘤样扩张病变、胶质细胞增生、Rosenthal纤维沉积、微小钙化及含铁血黄素沉积等。本例患者也均符合上述病理特点,同时组织病理检查结果进一步证实术中囊壁上的红色结节是一种微小血管病变,其中含铁血黄素沉积证实了患者的确存在出血的情况。
Coats Plus综合征也称为伴有钙化的囊肿的脑视网膜微血管病变,其影像学有着和LCC类似的“三联征”表现。在临床上,Coats plus综合征与LCC的区别在于渗出性视网膜病变和广泛的多器官受累,伴有视网膜毛细血管扩张、渗出和出血,还可能累及皮肤、毛发、胃肠道、肝脏和骨髓等[9]。除此之外,Coats Plus综合征的基因突变为调节端粒功能的CTC1,这与LCC的突变基因SNORD118亦不同[9]。本例患者心脏、腹部、肾脏超声等其他器官的检查均未发现异常,且眼底镜检查显示视网膜无异常。LCC的诊断还常常需要与脑囊虫疾病鉴别。脑囊虫病囊变在疾病后期会因为死亡和吸收逐渐缩小,虫体被机化和包裹后会形成多点状钙化[10]。此外,脑囊虫病囊肿与钙化位置主要位于皮髓交界区域,且极少发生微出血[11]。当影像学难以鉴别时,也可通过脑脊液和血液中寄生虫抗体升高的特异性表现来鉴别[12]。同时,脑脊液和血液中嗜酸性粒细胞数大多也会明显升高[12]。本例患者虽未行脑脊液及血液寄生虫抗体检测,但血液中嗜酸性粒细胞数并不高,且最终的术后病理检查并未发现囊虫头节。Fahr病又称特发性基底节钙化,其病理学特征为双侧基底节对称性钙质沉着,也可能发生弥漫性脑钙化,但Fahr病不会有囊肿和广泛脑白质改变[9]。此外,有部分多发性胶质瘤也可发生钙化,如少突胶质细胞瘤,但钙化仅在瘤内,相对便于鉴别。
目前,LCC尚无特效药物治疗,主要采取手术治疗,目的是解除压迫效应,缓解颅内高压。本例患者有颅高压症状,眼底镜检查显示双眼视盘水肿,已有手术指征。LCC手术治疗的方式主要是囊变穿刺囊液抽吸术和囊变切除术两种方式,少数患者因手术后囊变复发接受了多次手术甚至先后接受了两种手术方式进行治疗,也有少数患者为避免开放手术接受了囊变腹腔引流术和Ommaya囊植入术等术式[2-3,13]。部分患者在采取囊变穿刺囊液抽吸术后效果并不好,而最终采取了囊变切除术后病情趋于稳定[2,10]。我们考虑到囊变囊壁上结节是导致囊变出血的重要因素,所以采取了囊变及囊壁完整切除。我们术中也证实了囊壁上的确存在血管瘤样结节。Tamura等[13]也认为在手术可及的部位应该首选囊变切除,而在一些较深或功能区的位置可考虑囊肿穿刺替代治疗。但由于任何手术方式术后都存在复发的报道,且部分患者囊变位置多发无法一次性全部切除,所以术后仍需密切随访[2,5,14]。
综上所述,成人发病的LCC具有典型的影像学和病理学特点,囊变出血往往是导致疾病进展的重要因素,囊变切除术应为作为首选的治疗方式。

