HCA587/MAGE-C2蛋白联合CFA和CpG佐剂的免疫应答及抗肿瘤效应
焦薇 谭媛芳△ 陈惠媛 范秋颖 尹艳慧 陈娟娟 (.南昌大学第二附属医院检验科,江西省检验医学重点实验室,南昌 330006;.北京大学医学部免疫系,北京 009)
近年肿瘤免疫治疗备受关注,寻找表达于肿瘤组织的特异性或相关性抗原,制备抗原特异性疫苗靶向攻击肿瘤已成为肿瘤免疫治疗的新动向。肿瘤疫苗接种的前景将集中于更有效的免疫策略[1]。
肿瘤-睾丸(cancer testis,CT)抗原在多种恶性肿瘤中表达,但在正常组织中除睾丸生殖细胞外不表达,是多肽或蛋白质疫苗诱导的特异性CTL的有效靶点。许多CT抗原疫苗在小鼠模型中表现出强烈和特异的免疫应答,并产生抗肿瘤效应[2-3]。HCA587(又称MAGE-C2)是课题组前期用SEREX方法从HCC患者肝癌组织cDNA表达文库中克隆出的一种新CT抗原[4]。正常组织中,HCA587蛋白仅在免疫豁免的睾丸高表达;多种肿瘤组织中,如肝癌、黑色素瘤等,HCA587蛋白高表达[5]。另外肿瘤患者血清中能检测到自发的HCA587抗体产生,在体外用HCA587重组蛋白可从正常人外周血中诱导出特异的CD8+T细胞及CD4+T细胞应答[6]。表明HCA587抗原具有肿瘤组织表达特异性,且免疫原性强,具备作为肿瘤疫苗候选抗原的先决条件。
免疫佐剂通过激活共刺激因子和介导细胞因子产生提高多肽和蛋白质的免疫原性,不同程度激活早期固有免疫应答,并产生对疫苗抗原特异性更高的抗体和更强的细胞反应[7]。此外,多数佐剂诱导更广泛的适应性反应,对异型病毒等提供保护[8]。免疫佐剂可在诱导同等强度应答条件下使蛋白抗原剂量减少,并提高蛋白抗原的免疫原性,增强特异性体液免疫应答和细胞免疫应答[9]。近年蛋白疫苗临床试验中,佐剂应用极为广泛。因此,研究基于HCA587蛋白的不同免疫策略并检测其诱导的免疫应答具有重要意义。本研究拟比较HCA587蛋白在不同免疫策略下的细胞和体液免疫应答及抗肿瘤作用。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞系 6~8周龄SPF级C57BL/6J雌性小鼠购自浙江维通利华实验动物技术有限公司,许可证号:SCXK(浙)2019-0001,饲养于南昌乐悠生物科技有限公司洁净环境,20~25 ℃,相对湿度55%~65%,整个实验过程和实验操作符合国际实验动物认可和评估委员会认证要求,本研究经南昌大学第二附属医院医学研究伦理委员会批准(2015.056)。
1.1.2 主要试剂 pGEX-6P-1-HCA587重组质粒构建及HCA587重组蛋白表达和纯化由北京中美冠科生物科技公司完成,HCA587蛋白纯度为98%;OVA蛋白(>95%纯度)、弗氏完全佐剂(CFA)、弗氏不完全佐剂(IFA)购自Sigma公司;CpG ODN 1826(5'-TCCATGACGTTCCTGACGTT-3')佐剂由上海生工生物工程技术服务有限公司合成;小鼠IFN-γ酶联免疫斑点(ELISpot)检测试剂盒购自MABTECH公司,包括预包被抗小鼠IFN-γ单抗的96孔板、生物素标记的抗小鼠IFN-γ单抗、碱性磷酸酶(ALP)标记的链霉亲和素和BCIP-NBT底物;HRP标记的抗小鼠IgG抗体购自Promega公司;TMB显色液购自北京天根;胞内细胞因子染色试剂购自Biolegend。
1.2 方法
1.2.1 细胞转染、克隆及鉴定 将含有HCA587全长cDNA序列的质粒pEGFP-C1转染B16黑素瘤细胞,通过G418压力筛选和有限稀释法获得稳定表达HCA587的B16细胞克隆(B16-HCA587),Western blot检测其HCA587表达。
1.2.2 小鼠免疫模型构建 将小鼠随机分为7组,每组6只,分别给予HCA587蛋白结合CFA/IFA和不同剂量CpG佐剂(20 μg或50 μg),以及佐剂对照、PBS缓冲液对照。免疫分组:①HCA587+CFA+CpG 20 μg;②HCA587+CFA+CpG 50 μg;③HCA587+IFA;④HCA587+IFA+CpG 20 μg;⑤HCA587+IFA+CpG 50 μg;⑥CFA+CpG 50 μg;⑦PBS缓冲液对照组。HCA587蛋白10 μg/只,与CFA或IFA单独1∶1混合,必要时与不同剂量CpG(20 μg或50 μg)混合,尾根部皮下注射,于第0、21天免疫,颈椎脱臼法处死小鼠。
1.2.3 IFN-γ ELISpot测定 第2次免疫后2周采集小鼠脾细胞,5×105个/孔加入预包被抗小鼠IFN-γ单抗的96孔板,加入2.5 μg/ml HCA587蛋白,对照组包括培养基和OVA无关蛋白,各3个复孔,37 ℃孵育20 h。加入生物素标记的抗小鼠IFN-γ单抗(1.5 μg/ml),温育、洗板,加入ALP标记的链霉亲和素(1 μg/ml)室温避光孵育,洗板,加入BCIP-NBT显色液避光显色后冲洗,终止反应,统计各孔斑点数。
1.2.4 抗HCA587抗体ELISA测定 第2次免疫后2周采集小鼠血清,HCA587蛋白(1 μg/ml)包被,4 ℃过夜,37 ℃封闭2 h后洗涤。不同稀释度血清加入反应板,37 ℃反应2 h后洗涤。加入HRP标记的抗小鼠IgG抗体(1∶2 500) 37 ℃作用90 min后洗涤。加入TMB显色液100 μl室温反应3~5 min,2 mol/L H2SO4终止反应,测定各孔450 nm波长处OD值。阴性血清对应孔平均OD值的2倍为阳性。
1.2.5 胞内细胞因子染色分析 5×106个/ml脾细胞在含10 μg/ml HCA587蛋白及10%胎牛血清的1640培基中37 ℃孵育24 h,培养终止前6 h加入Brefeldin A。收集细胞,洗涤后用抗小鼠CD4和CD8抗体染色30 min,洗涤,离心,弃上清,500 μl固定液室温固定20 min,洗涤,离心,弃上清,用500 μl 1×通透液室温通透10 min,洗涤,离心,PE-anti-IFN-γ和APC-anti-IL-4抗体染色30 min,1×通透液洗2次,重悬,进行流式分析。
1.2.6 小鼠肿瘤治疗模型 取6~8周龄小鼠,每组6只。第0天,每只小鼠于右侧胁腹部皮下接种B16-HCA587肿瘤细胞(1×104个/只,100 μl)。第7、第28天进行免疫治疗,治疗分组:①HCA587+CFA+CpG 50 μg;②CFA+CpG 50 μg;③PBS缓冲液对照组;100 μl/只,尾根部皮下注射。每隔2~3 d用游标卡尺测量肿瘤体积,肿瘤体积=长轴×短轴2×0.52。
1.3 统计学处理 采用GraphPad Prism 5.0软件作图及统计分析。非配对t检验分析分泌IFN-γ的脾细胞频数、抗体滴度和小鼠组间肿瘤体积差异,Log-rank test评估生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 HCA587蛋白联合CFA和50 μg CpG诱导最强的细胞免疫应答 HCA587蛋白与不同佐剂联合免疫小鼠后,ELISpot分析各免疫策略诱导的分泌HCA587抗原特异性IFN-γ的脾细胞频数。结果表明HCA587联合CFA、CpG组均可检测到高强度的IFN-γ分泌,50 μg CpG组更为明显。HCA587与IFA、CpG联用时仅检测到微弱应答,HCA587与IFA联用时未见阳性应答。可见HCA587蛋白需要CFA和CpG才能诱导较强的IFN-γ分泌,而50 μg CpG比20 μg诱导能力更强(图1)。

图1 不同免疫策略诱导的HCA587特异性细胞免疫应答Fig.1 HCA587-specific cellular immune response induced by different strategies
2.2 HCA587蛋白与CFA和50 μg CpG联合免疫产生高滴度抗体 ELISA检测不同免疫策略诱导的抗HCA587 IgG抗体水平,HCA587蛋白与CFA或IFA联用均能检测到高水平的HCA587特异性抗体,这种能力不依赖于CpG存在与否或剂量高低(图2)。尽管组间抗体滴度差异无统计学意义,但HCA587联合CFA+50 μg CpG在多倍稀释条件下产生的抗HCA587抗体滴度最高。
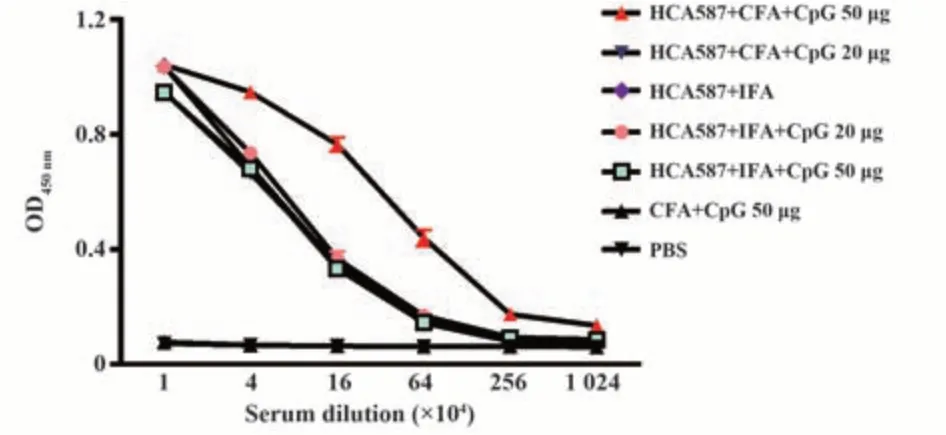
图2 不同免疫策略诱导的抗HCA587特异性抗体滴度Fig.2 Anti-HCA587 IgG antibody titers induced by different strategies
2.3 HCA587蛋白联合CFA和50 μg CpG诱导最高比例的IFN-γ+CD4+T细胞 对免疫后的脾细胞进行胞内细胞因子染色。结果表明,与IFA和CpG联用相比,HCA587联合CFA和CpG免疫的CD4+T细胞分泌IFN-γ的比例更高,且50 μg CpG下分泌IFN-γ的能力强于20 μg(图3)。但CD8+T细胞中未检测到显著的IFN-γ分泌;同样,CD4+T和CD8+T细胞亚群中均未检测到显著的IL-4分泌。说明HCA587蛋白联合CFA和50 μg CpG能诱导强大的Th1型免疫应答,且效应细胞亚群主要为CD4+T细胞。
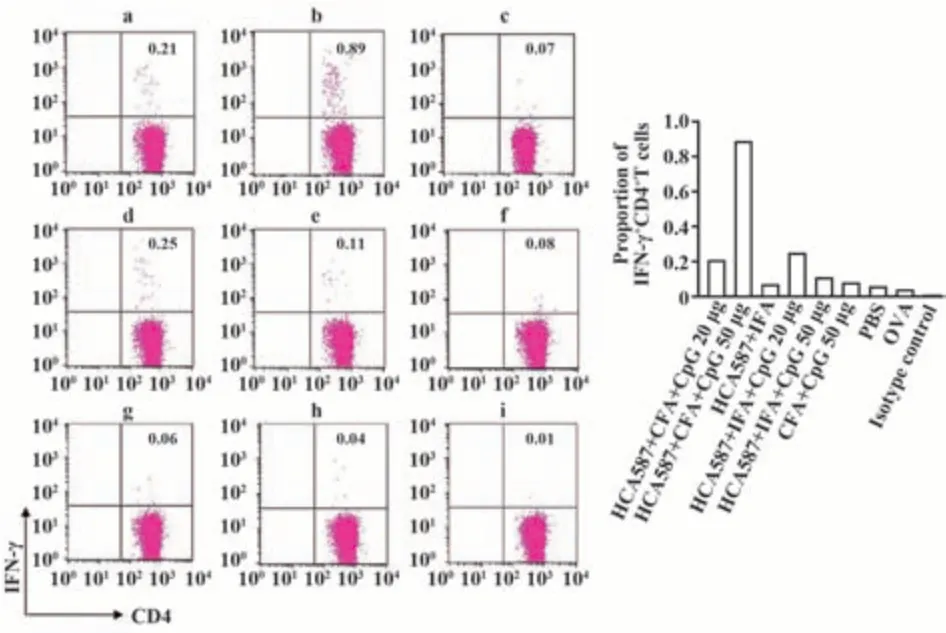
图3 不同免疫策略诱导的IFN-γ+CD4+T细胞比例Fig.3 IFN-γ secreted by CD4+T cells from splenocytes following vaccination with different strategies
2.4 HCA587蛋白联合CFA和50 μg CpG在小鼠模型中的抗肿瘤作用 基于以上研究结果,选择HCA587蛋白联合CFA和50 μg CpG作为最终疫苗策略观察其在小鼠体内的抗肿瘤效果。结果显示,该疫苗策略在体内能显著延缓肿瘤生长(图4A),但并不能显著改善荷瘤小鼠存活率(图4B)。

图4 HCA587蛋白联合CFA和50 μg CpG对B16-HCA587荷瘤小鼠的治疗效果Fig.4 Anti-tumor effect of HCA587 protein formulated with CFA and 50 μg CpG against B16-HCA587 cells in tumor-bearing mice
3 讨论
蛋白疫苗的优点包括不受MHC型别限制,在体内能被专业抗原提呈细胞摄取和呈递,诱导高强度的包含CD4+T、CD8+T细胞和B细胞的综合免疫应答[10]。本研究发现HCA587联合CFA和50 μg CpG能诱导强大的细胞和体液免疫应答,并在小鼠体内呈现一定抗肿瘤作用。
佐剂对建立理想的免疫应答至关重要。免疫应答启动时使用佐剂可增强天然免疫应答及适应性免疫应答[11-12]。佐剂是激活树突状细胞、诱导良好免疫环境的必要条件[13]。弗氏佐剂是一种经典佐剂,分为CFA和IFA,广泛用于蛋白疫苗,并显著增强人体宿主免疫应答[13-14]。可以解释本研究中无论有无CpG存在,HCA587蛋白与CFA/IFA联合免疫均可诱导较强的体液免疫应答。
一些临床研究表明弗氏佐剂需要与其他佐剂结合才能增强其活性,如Toll样受体3(TLR3)激动剂和TLR4激动剂CpG ODN[15-17]。MELSSEN等[15]研究表明,LPS和Polyiclc与IFA联用是安全有效的疫苗佐剂,加入TLR激动剂时,IFA增强了T细胞对肽疫苗的反应。SPEISER等[17]研究表明,多肽、IFA和CpG ODN 7909疫苗可引起快速强烈的人类CD8+T细胞反应。此外,报道显示,含有Montanide ISA 51佐剂的乳剂(油包水乳剂)中免疫多肽可能诱导以Th2为主的微环境,表明疫苗部位微环境并未诱导Th1/Tc1应答,而是诱导Foxp3+细胞和嗜酸性粒细胞,表明可能存在Th2主导的微环境[16]。以上结果支持了本研究结论,即弗氏佐剂需要其他佐剂帮助诱导足够的细胞免疫应答。
CpG寡脱氧核苷酸是TLR9的配体,正广泛作为刺激癌症反应性CTL的多肽和蛋白质癌症疫苗的有效佐剂[17]。CpG是一种含CpG基序的人工合成的寡核苷酸,是B细胞和Th1型免疫应答的有力驱动因素,并通过交叉递呈促进分泌IFN-γ的细胞毒细胞产生[18-19]。疫苗有效性的基础是宿主对抗原的免疫应答能否够随着时间推移而引起记忆T细胞反应[20]。疫苗接种试验中,CpG佐剂可诱导较强的免疫应答。研究表明将合成的长NY-ESO-1多肽与强大的免疫佐剂CpG-B联合接种,可在黑色素瘤患者中诱导完整和功能强大的CD8+T和CD4+T细胞反应,并显著增强肿瘤抗原特异性抗体[21-22]。T细胞分泌的Ⅰ型细胞因子,如IFN-γ在T细胞介导的抗肿瘤机制中发挥重要作用[23]。本研究采用IFN-γ ELISpot实验对几种免疫策略进行比较,结果表明HCA587蛋白与CFA和CpG 50 μg联合免疫可诱导大量分泌IFN-γ的脾细胞。同时,为了解免疫后的免疫应答类型和免疫细胞分泌细胞因子的能力进行了胞内细胞因子染色,HCA587和50 μg CpG诱导的脾细胞分泌IFN-γ的主要细胞群为CD4+T细胞,提示HCA587蛋白疫苗能诱导小鼠产生特异性Th1型细胞免疫应答,而CpG的存在是诱导Th1型细胞免疫应答的关键。
为评价HCA587蛋白疫苗在体内的抗肿瘤作用,本研究构建了稳定表达HCA587阳性的B16黑色素瘤细胞接种C57BL/6J小鼠。HCA587蛋白联合CFA和50 μg CpG可特异性抑制HCA587抗原阳性小鼠肿瘤细胞,但不能延长荷瘤小鼠生存时间,可能与肿瘤微环境的复杂性有关。PD-1/PD-L1信号通路可抑制T细胞免疫应答,促进肿瘤免疫逃逸,适应性免疫维持的平衡状态被破坏[24-25]。Tregs也可能在肿瘤微环境中通过各种直接和间接机制抑制T细胞反应和功能[26]。此外,IFA诱导的抗原特异性CD8+T细胞在细胞因子产生和增殖能力方面存在紊乱,可能是弗氏佐剂产生瞬时免疫应答和低临床缓解率的重要机制[13]。佐剂可促进疫苗接种地点内T细胞招募、耗尽和最终死亡[27]。因此,基于以上结果,可以考虑改善免疫策略:使用更好的佐剂组合,如使用CpG和ISCOM佐剂组合诱导更强大的细胞和体液免疫应答[28-29];联合检查点抑制剂PD-1抗体治疗;抑制PCSK9,有效减少MHCⅠ在溶酶体中的降解,显著提高肿瘤细胞表面MHCⅠ表达和抗原递呈,增强机体抗肿瘤免疫应答[30]。
综上,HCA587蛋白联合CFA和50 μg CpG佐剂能诱导小鼠产生强大的细胞和体液免疫应答,并具有一定抗肿瘤作用,为肿瘤抗原蛋白疫苗进入临床试验提供了新的依据。

