糖尿病肾病小鼠CD4+T细胞的脂质组学研究
张小雨 谭海波 黄敏仪 贝伟剑 杨祎琦 (广东药科大学中医药研究院,广州 510006)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最严重的微血管并发症之一,也是终末期肾病的主要病因[1]。近年来,糖尿病在我国的发病率急剧增加,这就导致了DKD的发病率也持续攀升[2]。2021年国际糖尿病联盟(IDF)公布全球糖尿病患者已突破5.73亿,而中国已破1.4亿成为世界之最,其中10%~40%的糖尿病患者会进展为DKD,给我国国民健康带来了巨大的威胁和挑战[3]。DKD发生过程中会伴随大量的CD4+T细胞水平升高和IL-17促炎因子的释放,并刺激和趋化巨噬细胞、树突状细胞和单核细胞向肾脏组织迁移,导致足细胞病变、肾小球硬化和蛋白尿的增加,最终导致DKD[4]。越来越多证据表明,T淋巴细胞激活和细胞因子诱导的炎症反应和2型糖尿病及DKD密切相关[5]。机体内T淋巴细胞是重要的免疫细胞群,外周血成熟T细胞主要有CD4+T和CD8+T两个亚群,其中CD4+T细胞识别主要是组织相容性复合物(MHC)Ⅱ递呈的抗原肽,经激活分泌细胞因子,调节或协助免疫反应[6]。然而CD4+T细胞在DKD中是如何被激活的还有待进一步研究[7]。由于DKD患者常伴随脂代谢异常,因此本研究从细胞分选与非靶向脂质组学相结合的角度初步探讨了db/db小鼠CD4+T细胞在脂代谢中的差异,明确了差异代谢产物的数量和种类,分析其可能的代谢途径,以期揭示DKD的免疫细胞脂质代谢特征,为以CD4+T细胞为靶标的DKD临床药物研发提供新思路和实验基础。
1 材料与方法
1.1 材料
1.1.1 动物 本研究采用SPF级BKS.Cg-Dock7m+/+Lepr db/J自发性DKD雄性小鼠为研究对象,设置正常组(m/m,25~30 g,10~12周龄)和DKD模型组(db/db,45~50 g,10~12周龄),饲养至12周,取小鼠脾脏备检。小鼠均购自中国常州卡文斯实验动物有限公司[SCXK(苏)2016-0010],合格证号:NO.202006494。本实验经广东药科大学实验动物伦理委员会批准(gdpulac2019180)。
1.1.2 试剂及耗材 耦联大鼠抗小鼠CD4单克隆抗体的磁珠(德国美天旎生物技术有限公司,140-005-121);BSA(威佳科技,Y170720,批号:180728);LS柱(5190923106)、MS柱(5191015024)、MidiMACSTMSeparator(5190814151)、MiniMACSTMSeparator(5190807507)、MACS MultiStand磁力架(50495) 均购自德国美天旎生物技术有限公司。
1.1.3 仪器 BT125D精密电子天平(Sartorius);Mithras LB940微孔板式多功能酶标仪(Berthold technologies);多光谱显微镜(Olympus);CytoFLEX流式细胞仪(美国贝克曼库尔特);Centrifuge 5810R高速离心机(Eppendorf);OPTION-S 7超纯水仪(ELGA Lab Water);8000直热气套式二氧化碳培养箱(Thermo Fisher Scientific);AE240电子天平(梅特勒-托利多仪器公司);血糖仪(罗氏-卓越金采型);LC-MS/MS(ExionLC AD UPLC-QTRAP,SCIEX);离心机(5424R, Eppendorf);电子天平(AS 60/220.R2,RADWAG);球磨仪(MM400,Retsch);离心浓缩仪(CentriVap,LABCONCO);涡旋混合器(VORTEX-5,Kyllin-Bell);超声清洗仪(KQ5200E,昆山市超声仪器有限公司)。
1.2 方法
1.2.1 db/db小鼠DKD特征检测 检测小鼠体质量及空腹血糖(fasting blood glucose,FBG)情况,当FBG>11.1 mmol/L时认为糖尿病模型成功;通过试剂盒检测尿白蛋白/肌酐比值(UACR),模型组UACR显著高于正常组,则认为DKD模型成功[7-8]。通过HE染色法检测肾脏组织病理改变情况,当肾小球体积变大,并呈现明显的系膜扩张,肾间质出现炎症细胞浸润,即可认为DKD小鼠达到备检要求[9-10]。
1.2.2 脾脏淋巴细胞悬液的制备 研磨脾脏,用70 μm细胞滤网过滤,并收集单细胞悬液置于15 ml离心管中,将装有细胞悬液的15 ml离心管置于离心机(4 ℃、300 g离心5 min),弃上清;加1 ml红细胞裂解液,室温避光孵育10 min,400 g离心5 min,去上清,加1 ml PBS,400 g离心5 min,弃上清;然后重悬进行细胞计数;并取适量悬浮液进行CD4流式抗体标记30 min,采用PBS洗涤2次,200 μl PBS重悬,采用流式细胞仪鉴定CD4+T细胞在分选前的比例。
1.2.3 脾脏CD4+T细胞磁珠分选及纯度鉴定 根据CD4+T细胞磁珠分选试剂盒进行操作,首先将含1×107个脾脏单细胞悬液离心后弃上清,再加入90 μl缓冲液及10 μl CD4(L3T4)Microbeads(磁珠),充分混合,置于4 ℃冰箱中孵育10 min,进行后续的磁性细胞分离。将LS柱置于适当的MACS分离器磁场中,用适量缓冲液冲洗柱(MS:500 μl,LS:3 ml),将细胞悬液涂在色谱柱上,收集含有未标记细胞的流出物,即为CD4+T细胞部分。用适量的缓冲液洗涤色谱柱,收集流出的未标记细胞,并与以上未标记细胞的流出物混匀(MS:2×500 μl,LS:1×3 ml)。从分离器中取出色谱柱并将其放在合适的收集管中,用移液管将适量的缓冲液移到柱上,通过将柱塞牢牢地推入柱中,立即冲洗出磁性标记的CD4+T细胞,最后用流式细胞仪进行纯度鉴定[11]。
1.2.4 脾脏CD4+T细胞非靶向脂质组学检测前处理 取分选的细胞(8×106个),加入400 μl 80%甲醇溶液,放入预冷的-80 ℃冻干机中冻干;将冻干好的样本取出,加入1 ml脂质提取剂,涡旋5 min,4 ℃静置15 min;加入200 μl超纯水,涡旋3 min,4 ℃静置分层;12 000 r/min、4 ℃离心10 min,取200 μl上清液浓缩;向浓缩干的样本中加入200 μl复溶剂,振荡5 min,离心5 min;取150 μl上清液到进样瓶,并上机检测。
1.2.5 脾脏CD4+T细胞非靶向脂质组学检测色谱质谱采集条件 色谱采用超高效液相色谱(UPLC)系统[12]。色谱条件为:Thermo AccucoreTMC30 色谱柱(2.1×100 mm,2.6 μm),流动相A为乙腈/水(60/40,V/V)(含0.1%甲酸,10 mmol/L甲酸铵);流动相B为乙腈/异丙醇(10/90,V/V)(含0.1%甲酸,10 mmol/L甲酸铵);梯度系统:0~2 min,80%~70% A;2~4 min,70%~40% A;4~9 min,40%~15% A;9~14 min,15%~10% A;14~15.5 min,10%~5% A;15.5~17.3 min,5% A;17.3~17.5 min,5%~80%A;17.5~20 min,80% A;流速0.35 ml/min;柱温45 ℃,进样量 2 μl。
质谱采用串联质谱(MS/MS)系统[13]。质谱条件为:电喷雾离子源(ESI)500 ℃,正离子模式下质谱电压5 500 V,负离子模式下质谱电压-4 500 V,离子源gas 1(GS1)45 psi,gas 2(GS2)55 psi,帘气(CUR)35 psi,碰撞诱导电离(CAD)参数设置为Medium。在三重四极杆中,每个离子对是根据优化的去簇电压(DP)和碰撞能(CE)进行扫描检测。
1.3 统计学处理 采用Analyst 1.6.3处理质谱数据,进行峰识别、峰过滤等预处理,得到保留时间、离子检测的离子流强度及峰面积。采用R软件进行多元统计分析,包括主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)多元统计分析。根据VIP值,结合t检验,筛选出“VIP≥1,P<0.05”的差异代谢物。基于自建靶向标品数据库MWDB,根据检测物质的保留时间RT、子母离子对信息及二级谱数据进行定性分析。利用KEGG数据库对差异代谢物进行通路富集分析,预测脂质代谢信号通路。
2 结果
2.1 db/db小鼠DKD特征检测结果 与正常组(m/m)相比,模型组(db/db)的体质量和血糖显著升高(P<0.05),UACR、低密度脂蛋白(LDL-C)显著增加(P<0.01),高密度脂蛋白(HDL-C)显著降低(P<0.01),总胆固醇(TC)显著增加(P<0.01),且模型组小鼠肾脏肾小球体积变大、呈现明显的系膜扩张,并伴随炎症细胞浸润,见图1。提示该db/db小鼠具有DKD表型。
2.2 CD4+T细胞分选及纯度鉴定结果 与正常组(m/m)相比,db/db小鼠CD4+T细胞比例显著升高(P<0.05),db/db小鼠分选后CD4+T细胞比分选前显著升高(P<0.01),m/m小鼠分选后CD4+T细胞比分选前显著升高(P<0.01),且CD4+T细胞在分选前后纯度由10%提高至80%,见图2。

图2 CD4+T细胞分选流式结果Fig.2 Flow cytometry results of CD4+T cell sorting
2.3 非靶向脂质组学结果
2.3.1 代谢物定性定量分析结果 代谢物定量采用三重四极杆质谱的多反应监测模式(MRM)分析完成。并采用软件Analyst 1.6.3进行质谱数据分析。经过LC-MS法共检测出463个代谢产物。见附图1(www.immune99.com)。
2.3.2 主成分分析(PCA)结果 利用PCA了解各组样本之间的代谢物差异大小。正常组(m/m)和模型组(db/db)在PCA二维结果,见图3A。横坐标PC1表示第一主成分,占样品差异的58.43%。纵坐标PC2表示第二主成分,占样品差异的16.42%,而在两组PCA三维结果,见图3B。横坐标PC3表示第三主成分,占样品差异的8.87%。说明纵向分布显著分开,但横向仍有部分交叉,代谢组分能够在两组间实现有效分离。
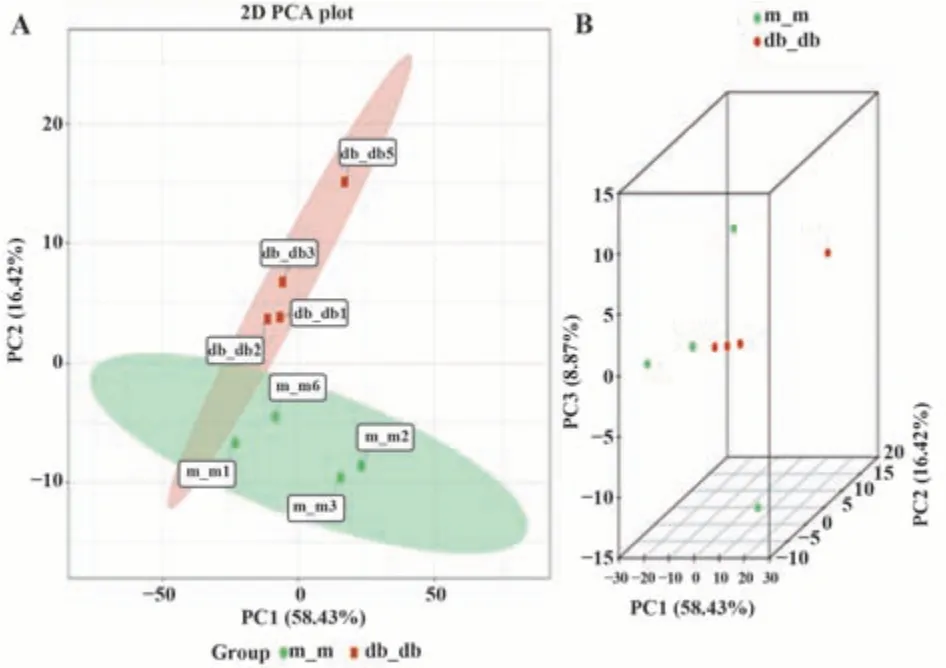
图3 主成分分析图Fig.3 Principal component analysis
2.3.3 正交偏最小二乘法判别(OPLS-DA)分析结果 为了更好地识别正常组和DKD组CD4+T细胞差异脂质的变化,进一步进行两组间OPLS-DA分析。为防止模型过拟合,进一步采用200次置换检验验证模型。OPLS-DA模型中R2X=0.808;R2Y=0.999,Q2=0.882,表明模型拟合度和预测能力良好。对463个代谢产物按照物质一级分类,分别是甘油磷脂类、甘油脂类、鞘脂类、脂肪酰类以及异戊烯醇酯类。其中甘油磷脂类在代谢产物中的分类占比最大,有301个物质,其中大部分是磷脂酰胆碱、其次是磷脂酰乙醇胺、溶血磷脂酰胆碱、磷脂酰丝氨酸以及磷脂酰肌醇等物质。证明了磷脂酰胆碱是DKD组CD4+T细胞改变的关键差异脂质,见图4。
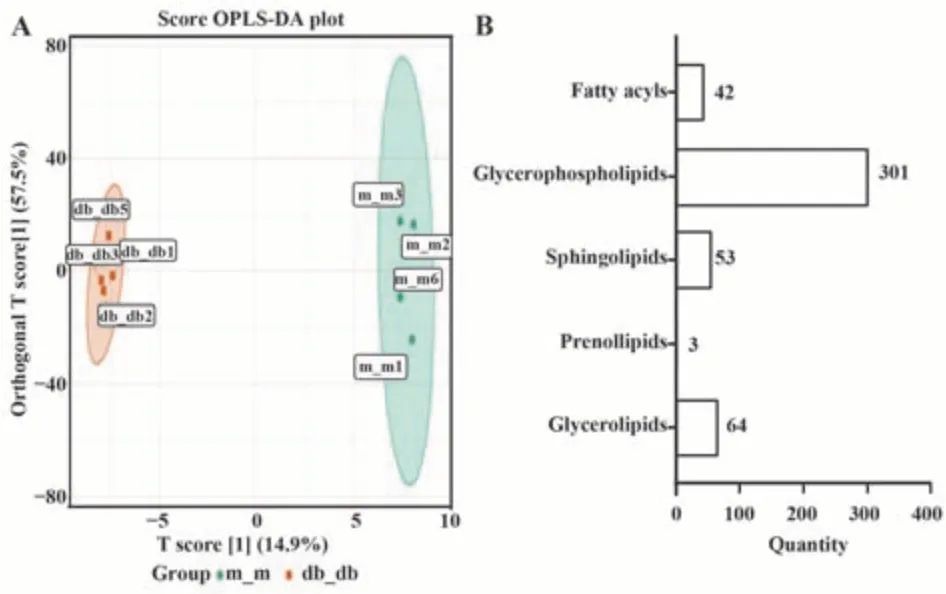
图4 OPLS-DA分析图及脂质代谢物占比图Fig.4 OPLS-DA analysis diagram and lipid metabolite proportion diagram
2.3.4 差异代谢物筛选结果 以差异倍数值(fold change)≥2和差异倍数值(fold change)≤0.5以及VIP≥1为条件筛选差异代谢物。差异代谢物火山图显示(图5):两组共有439种代谢物无显著性差异,一共有24个代谢物有显著性,且上调和下调的差异代谢物的定量差异倍数较大。db/db小鼠中,有15个差异代谢物下调,分别是磷脂酰胆碱_PC(18:2_18:2)、磷脂酰甘油_PG(18:1_22:5)、肉碱C12-OH、甘油二酯_DG(18:2_18:2)、甘油二酯_DG(18:2_20:4)、溶血磷脂酰胆碱_LPC(0:0/20:0)、溶血磷脂酰胆碱_LPC(20:0/0:0)、溶血磷脂酰胆碱_LPC(20:2/0:0)、磷脂酰胆碱_PC(17:1_18:1)、磷脂酰胆碱_PC(19:0_18:2)、磷脂酰胆碱_PC(17:0_20:3)、磷脂酰胆碱_PC(19:0_20:4)、磷脂酰乙醇胺_PE(17:1_18:1)、磷脂酰乙醇胺_PE(18:1_18:1)、磷脂酰乙醇胺_PE(19:0_18:2)等物质;有9个差异代谢物上调,分别是磷脂酰乙醇胺_PE(18:1_22:5)、磷脂酰甘油_PG(18:0_20:4)、磷脂酰甘油_PG(18:1_20:4)、磷脂酰甘油_PG(18:1_20:5)、糖鞘脂_HexCer(d18:1/24:0)、溶血磷脂酰乙醇胺_LPE(P-18:1)、磷脂酰丝氨酸_PS(18:0_20:5)、磷脂酰丝氨酸_PS(18:1_22:6)、三酰甘油_TG(16:1_18:1_18:1)等物质。见表1。
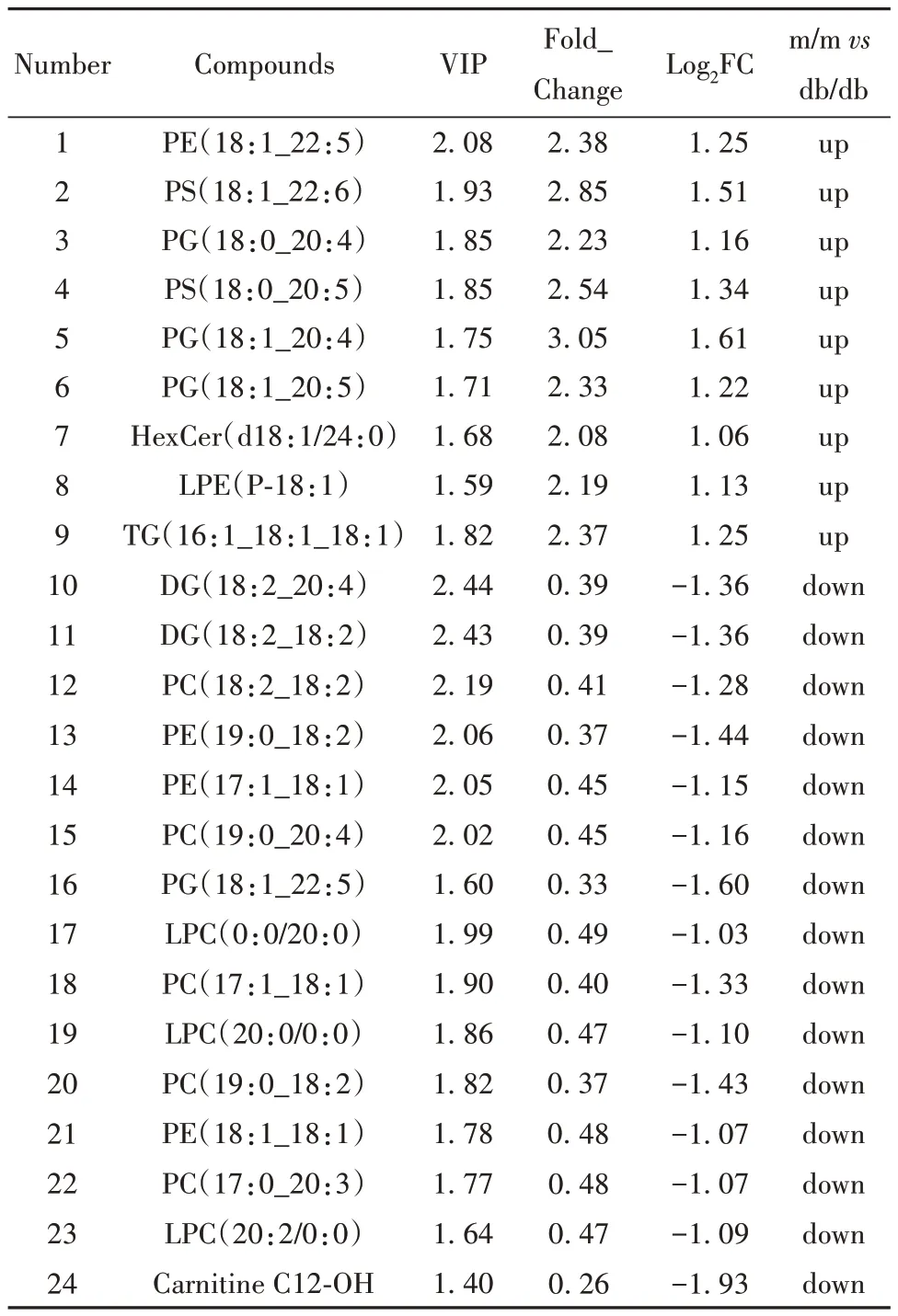
表1 差异代谢物筛选结果Tab.1 Screening results of differential metabolites
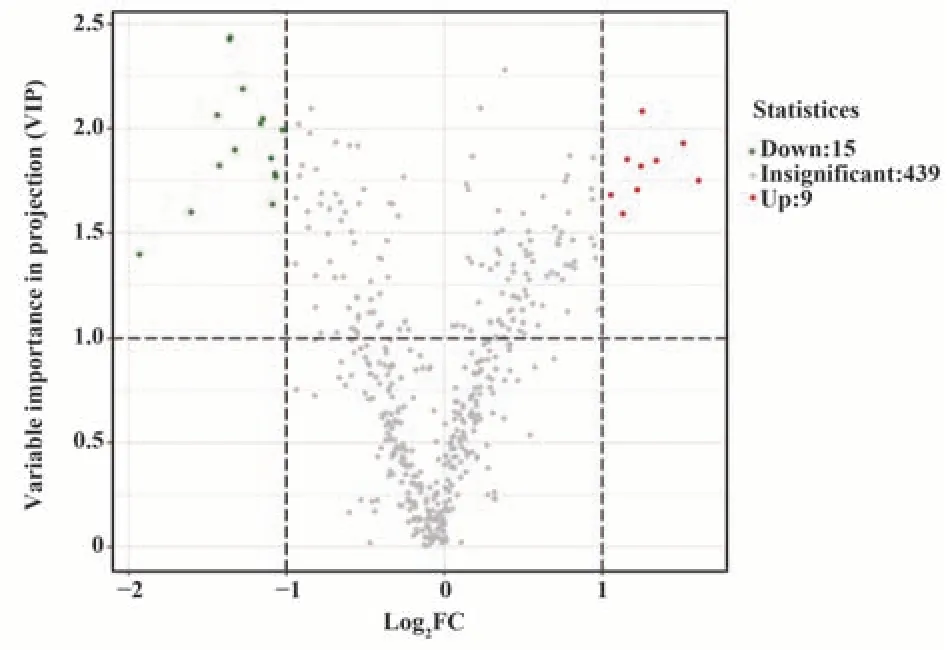
图5 差异代谢物火山图Fig.5 Volcano map of differential metabolites
差异代谢物小提琴图利用violin plot分析比较单个脂质差异代谢物在两组中的表达情况,结果显示:在正常组(m/m)和模型组(db/db)中磷脂酰胆碱、溶血磷脂酰胆碱等脂质差异代谢物的表达量差异较大(图6)。说明了磷脂类代谢与DKD的发生发展密切相关。

图6 差异代谢物小提琴图Fig.6 Violin chart of differential metabolites
2.3.5 差异代谢物KEGG分类以及富集分析图7A结果显示:差异代谢物KEGG分类主要分为有机系统类、代谢类、人类疾病相关类、环境信息处理类以及细胞进程类。其中差异代谢物属于甘油磷脂代谢通路以及代谢途径通路占比最大,分别占84.21%和78.96%。该结果证明了正常组(m/m)和模型组(db/db)的CD4+T细胞的脂质差异代谢物在甘油磷脂代谢通路和代谢途径通路上有显著差异。对KEGG通路进行富集分析,结果表明正常组(m/m)和模型组(db/db)的CD4+T细胞的脂质差异代谢物主要涉及甘油磷脂代谢、癌症中的胆碱代谢、花生四烯酸代谢、亚油酸代谢、α-亚麻酸代谢、甘油脂代谢、磷酸肌醇代谢、甘氨酸、丝氨酸和苏氨酸代谢等代谢途径。其中甘油磷脂代谢的点颜色最红,表示参与其中的代谢物或代谢通路发生的变化越明显。其次是癌症中的胆碱代谢也较为显著,见图7B。说明了DKD CD4+T细胞甘油磷脂类代谢通路的紊乱与DKD发生发展密切相关。
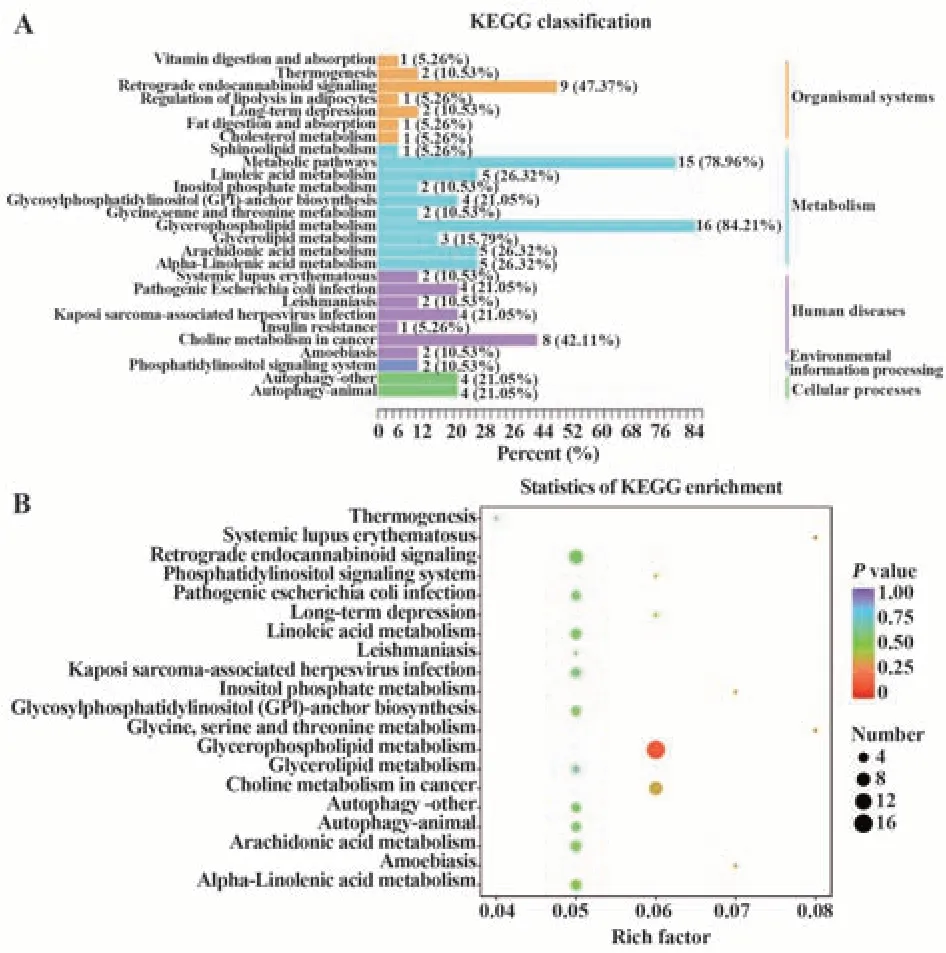
图7 差异代谢物KEGG分类以及富集分析Fig.7 KEGG classification and enrichment analysis of differential metabolites
3 讨论
DKD是慢性肾脏疾病进展为终末期肾病(end stage renal disease,ESRD)的主要原因[14]。大量研究显示CD4+T细胞与ESRD的发生发展密切相关[15-16]。CD4+T淋巴细胞的募集和浸润可能参与了DKD进展过程中免疫发病机制的启动和进展[17-18]。近年来,越来越多的研究发现DKD患者常伴有脂代谢紊乱,然而具体机制及内在联系仍未十分明确[19-20]。本文主要通过对DKD小鼠脾脏CD4+T细胞脂质代谢差异进行研究,发现正常组(m/m)和模型组(db/db)小鼠内源性脂质代谢产物差异主要为磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰甘油、溶血磷脂酰胆碱、磷脂酰丝氨酸、溶血磷脂酰乙醇胺等物质的改变。有研究表明,甘油磷脂代谢通路与机体脂代谢和糖代谢紊乱密切相关,磷脂酰胆碱和磷脂酰乙醇胺都是甘油磷脂的代谢产物,糖尿病与慢性肾病等代谢性疾病的患者血清中磷脂酰胆碱和磷脂酰乙醇胺的含量均有异常改变,且这两类脂质中间产物与糖尿病并发的炎症、氧化应激和动脉硬化等密切相关[21]。溶血磷脂酰胆碱是磷脂酰胆碱合成的中间产物,同时也是细胞膜与介导信号转导的基本组成部分,而磷脂酰胆碱是细胞膜脂质双分子层的主要成分[22]。在细胞膜融合、胞饮作用、膜运转作用及膜中酶的催化活性等方面起重要的作用。能使血浆中胆固醇水平降低20%[23-24]。本研究结果显示溶血磷脂酰胆碱和磷脂酰胆碱在db/db脾脏CD4+T细胞中显著下调,且主要涉及甘油磷脂代谢通路紊乱,可能是DKD进展的潜在新机制。
综上所述,脂质代谢组学是脂代谢疾病生物标志物发现的新方法[25]。由于DKD患者常伴随脂代谢异常[26]。因此本研究从细胞分选及脂代谢组学相结合的角度初步探讨了DKD小鼠CD4+T脂代谢中的差异,通过PCA、OPLS-DA分析、差异代谢物筛选、KEGG功能注释及富集分析,完成了组间的区分和对差异代谢物的筛选,明确了差异代谢产物的数量和种类[27]。筛选得到的差异代谢物主要参与甘油磷脂代谢途径,提示磷脂类代谢与DKD的发生发展密切相关。本研究结果为以CD4+T细胞为靶标的DKD临床药物研发提供新思路和实验基础。

