38%咪铜·多菌灵悬浮剂分析方法研究
罗琳,袁玉兵
(1.安道麦辉丰(江苏)有限公司,江苏 盐城 224100;2.江苏辉丰石化有限公司,江苏 盐城 224100)
38%咪铜·多菌灵悬浮剂是由30%咪鲜胺铜盐与8%多菌灵复配的低毒杀菌剂,具有良好的保护、治疗和渗透作用。已有小麦赤霉病对多菌灵产生抗性的报道,可采用多菌灵与其他农药混配成复配制剂,或者与其作用机理不同的杀菌剂交替使用以达到防治小麦赤霉病的效果[1]。咪鲜胺是一种广谱低毒杀菌剂,对炭疽病[2-3]、水稻纹枯病[4]、小麦赤霉病[5]等具有良好的效果,故多菌灵与咪鲜胺复配可用于防治对多菌灵抗性的小麦赤霉病。38%咪铜·多菌灵悬浮剂的分析方法已有报道,但2 者需分别进行测定[6],或可以同时测定咪鲜胺与多菌灵质量分数[7],但在38%咪铜·多菌灵悬浮剂产品中存在干扰;还有采用液质联用方法可以同时测定咪鲜胺与多菌灵质量分数[8-9],但分析成本较高且过程复杂。本文开发了HPLC 方法同时测定该产品中咪鲜胺与多菌灵质量分数并能很好的分离,且互不干扰。
1 材料与方法
1.1 试剂和溶液
乙腈(色谱纯,赛默飞世尔科技),水(超纯水),N,N-二甲基甲酰胺(DMF,美国TEDIA,纯度99.80%),乙酸铵(麦克林试剂),99.45%咪鲜胺标样、98.0%多菌灵标样[国家质量监督检验中心(沈阳)]。
1.2 仪器设备
Agilent 1260 InfinityⅡ液相色谱仪(具ALS 自动进样器,VWD 外检测器)、Chemstation 色谱工作站(美国安捷伦公司),ML 104/02 电子天平(梅特勒-托利多仪器公司),超纯水机(德国达姆施塔特默克集团)。
1.3 液相色谱测定条件
试样用DMF 溶解,以0.1 mol/L 乙酸铵水溶液为流动相A,乙腈为流动相B,使用以Eclipse XDB-C84.6 mm×250 mm、5 μm 色谱柱和紫外检测器(235 nm),对试样中的咪鲜胺与多菌灵进行分离和定量。
流速:1.2 mL/min;柱温:25 ℃;检测波长:235 nm;进样体积:1 μL;运行时间:16 min;后运行时间:2 min;流动相A:0.1 mol/L 乙酸铵水溶液,流动相B:乙腈,采取梯度方式(表1);保留时间:多菌灵3.2 min,咪鲜胺12.2 min。溶剂、咪鲜胺、多菌灵标样和试样的色谱图(图1~图4)。
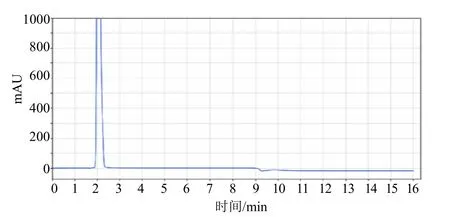
图1 溶剂空白(DMF)

图2 多菌灵标样色谱图
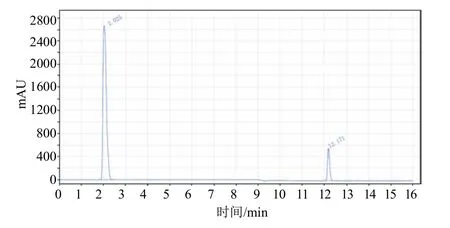
图3 咪鲜胺标样色谱图
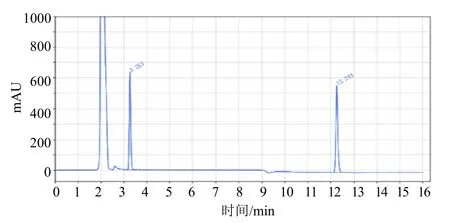
图4 38%咪铜·多菌灵SC 试样色谱图

表1 流动相
1.4 测定步骤
1.4.1 标样溶液的配制
准确称取多菌灵标样50.0 mg(精确至0.0002 g)、咪鲜胺标样172.0 mg(精确至0.0002 g)置于50 mL容量瓶中,用DMF 溶解定容到刻度,摇匀。
1.4.2 试样溶液的配制
准确称取625.0 mg左右(精确至0.0002 g)38%咪铜·多菌灵SC 试样置于50 mL 容量瓶中,用DMF溶解定容到刻度,超声5 min,用0.45 μm 滤膜过滤备用。
1.4.3 测定
在上述色谱条件下,待仪器稳定后,先注入数针标样溶液,直至标样的响应值基本稳定后,按标样溶液、试样溶液、试样溶液、标样溶液顺序进样。
1.4.4 计算
将测得的2 针试样溶液以及试样前后2 针标样溶液中的多菌灵与咪鲜胺的峰面积分别进行平均,试样中多菌灵与咪鲜胺的质量分数X1按下式计算:
式中:A1为试样溶液中多菌灵、咪鲜胺峰面积的平均值;A2为标样溶液中多菌灵、咪鲜胺峰面积的平均值;m1为试样的质量(g);m2为多菌灵标样、咪鲜胺标样的质量(g);P为多菌灵标样、咪鲜胺标样纯度(%)。
2 结果与分析
2.1 方法特异性和非分析物的干扰分析
按照配方比例,将除多菌灵原药、咪鲜胺原药以外的所有助剂混匀,配制制剂空白试样。称取约625 mg 空白制剂,按照上述方法进行分析测定。在有效成分保留时间处(多菌灵约3.2 min,咪鲜胺约12.2 min)无响应,证明非分析物对有效成分多菌灵、咪鲜胺的测定无干扰。
2.2 色谱条件的优化
多菌灵与咪鲜胺的紫外吸收光谱图见图5、图6,从图中可知多菌灵最大吸收波长214、242、286 nm,咪鲜胺最大吸收波长220 nm,空白制剂试样在235 nm 处无干扰峰,综合考虑检测波长选择235 nm。
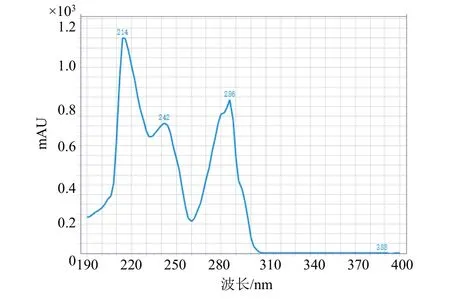
图5 多菌灵的紫外吸收光谱图
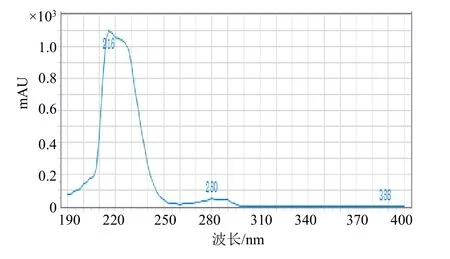
图6 咪鲜胺的紫外吸收光谱图
色谱柱为常规的Eclipse XDB-C8反相色谱柱。由于多菌灵在甲醇、乙腈中的溶解度较小,选择N,N-二甲基甲酰胺(DMF)作为溶剂,以乙腈与乙酸铵溶液为流动相,由于多菌灵流出较快,与溶剂DMF 出峰时间较为接近,咪鲜胺流出较慢,为节省分析时间并能达到很好的分离效果,多菌灵流出前减小有机相比例,咪鲜胺流出前增加有机相比例,最终流速选择1.2 mL/min,流动相采用梯度方式。结果证明采用以上条件进行测定时,有效成分与溶剂分离度能满足要求,且峰型对称。
2.3 线性相关
2.3.1 标准系列溶液的配制
分别准确称取多菌灵标样40.0、46.3、50.2、55.5、60.3 mg,咪鲜胺标样138.2、154.3、172.2、183.5、206.2 mg,精确到±0.1 mg,对应的多菌灵和咪鲜胺分别置于5 个50 mL 容量瓶中,用DMF 溶解定容到刻度,摇匀,分别标为SD1~SD5。
2.3.2 线性关系测定
在上述色谱条件下,待仪器稳定后,进不同浓度的标准溶液,测定其相应的峰面积,以质量浓度为横坐标、峰面积值为纵坐标进行线性回归。结果表明:多菌灵质量浓度为0.7840~1.1819 mg/mL 时具有良好的线性范围,线性回归方程为y=2831.2x-102.01,相关系数R2=0.9998 (表2);咪鲜胺质量浓度为2.7488~4.1013 mg/mL 时具有良好的线性范围,线性回归方程为y=981.31x-66.187,相关系数R2=0.9993(表3)。
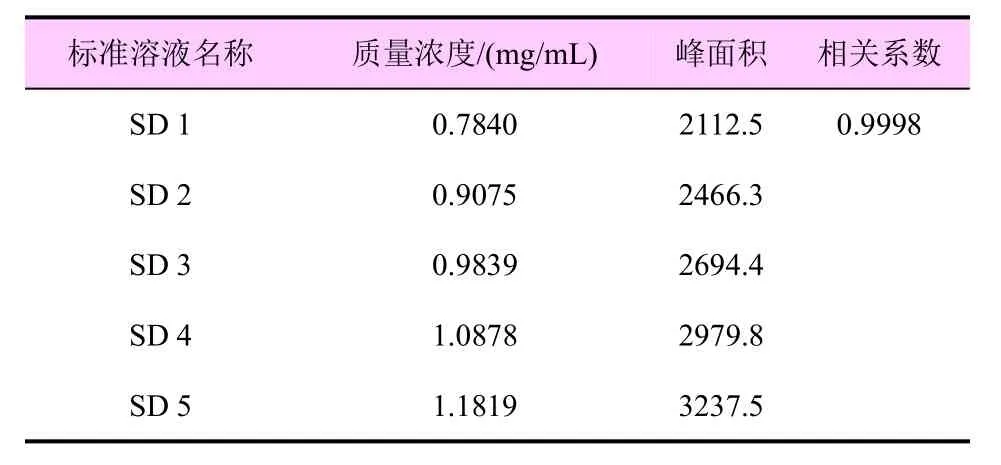
表2 多菌灵的线性范围测定结果
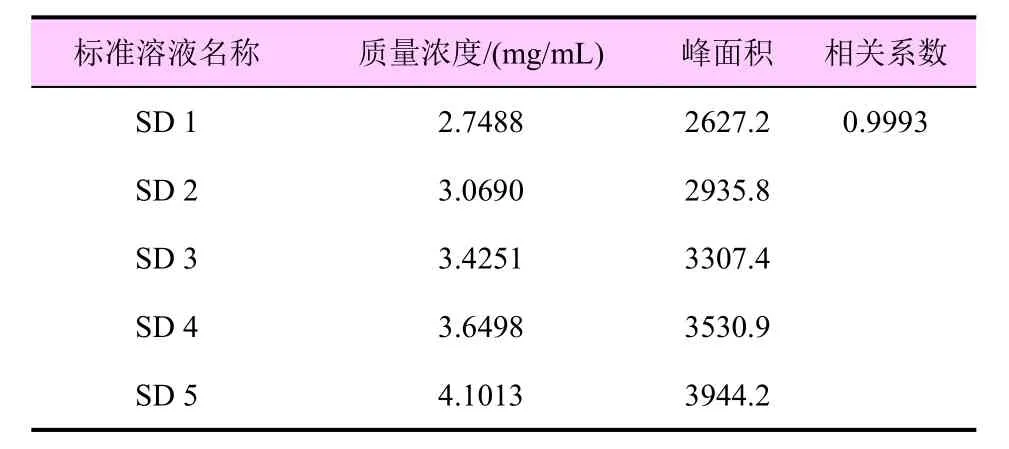
表3 咪鲜胺的线性范围测定结果
2.4 准确度测定
在1.3 的色谱条件下,空白试样中加入一定量的多菌灵与咪鲜胺标样,测定其质量分数,计算回收率(表4、表5)。
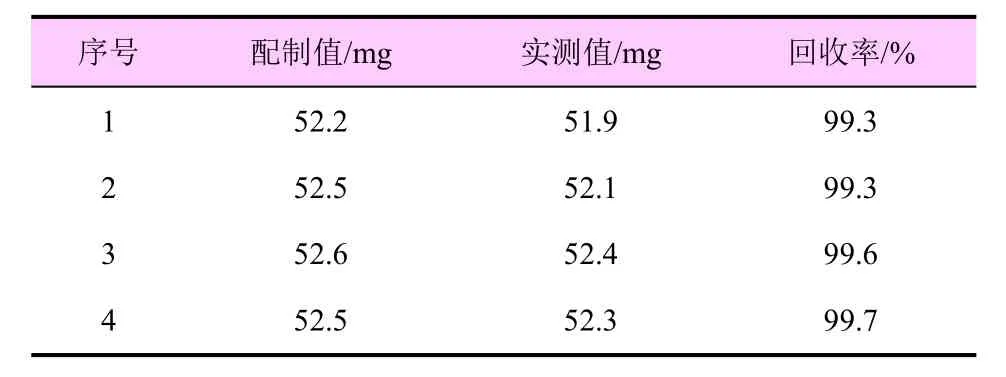
表4 多菌灵的准确度测定
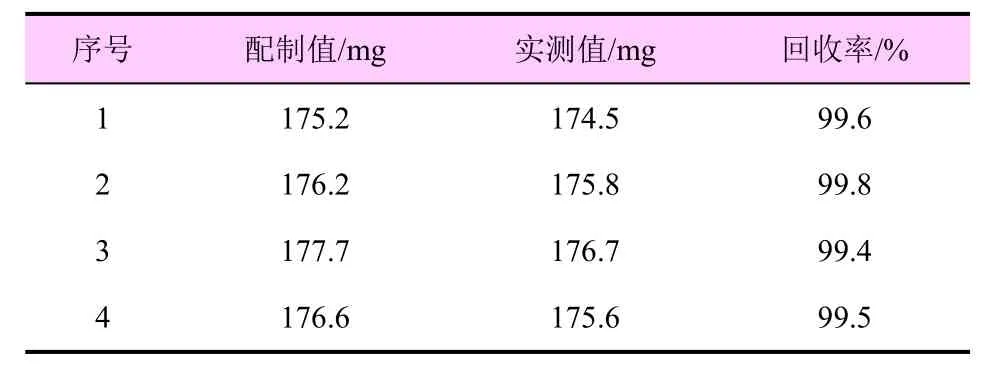
表5 咪鲜胺的准确度测定
多菌灵的回收率为99.3%~99.7%,咪鲜胺的回收率为99.4%~99.8%,表明本方法用于38%咪铜·多菌灵悬浮剂中多菌灵和咪鲜胺的定量分析是可行的。
2.5 精密度测定
分别称取6 个38%咪铜·多菌灵悬浮剂试样至50 mL 容量瓶,按照1.3 中方法进行分析,测得多菌灵与咪鲜胺质量分数的相对标准偏差(RSD)分别为0.4%、0.36%(表6、表7)。结果表明:RSD 小于修改的Horwitz 公式×0.67,该方法精密度符合质量检测的要求。
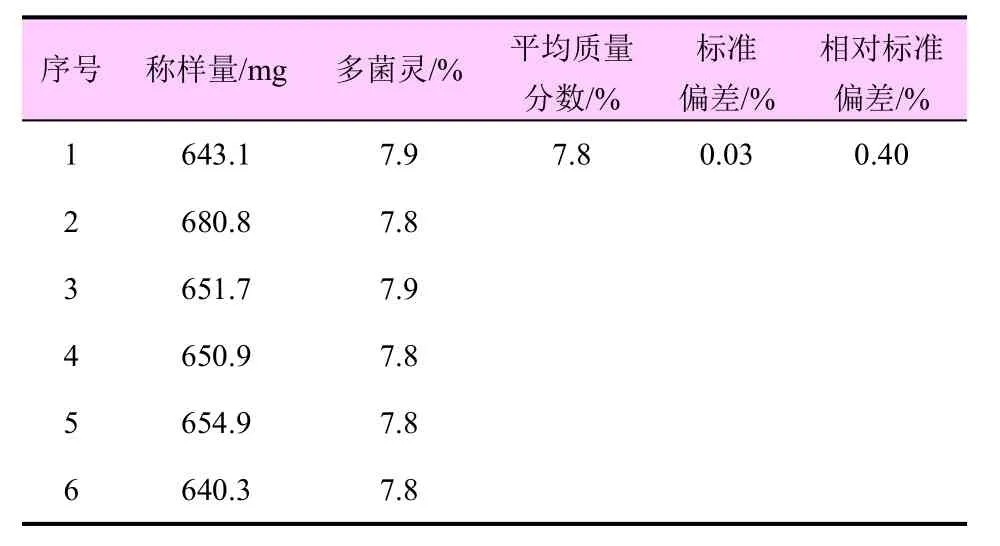
表6 多菌灵的精密度测定

表7 咪鲜胺的精密度测定
3 结论
本文对38%咪鲜胺铜盐·多菌灵悬浮剂的有效成分质量分数分析方法进行分析研究,经过方法特异性验证无干扰,线性关系分别为0.9993 和0.9998,准确度分别为99.6%和99.5%,相对标准偏差分别为0.36%和0.40%,各项验证均证明该方法能准确测定咪鲜胺和多菌灵质量分数,且简单易操作,节约了分析时间和成本,可用于该制剂的质量检测。

