衣藻对盐胁迫下小麦幼苗生长和生理指标的影响研究
王彦钦,李武阳,孟宪刚*,罗光宏
(1.兰州交通大学 生物与制药工程学院,甘肃 兰州 730070;2.河西学院 甘肃省微藻工程技术研究中心,甘肃 张掖 734000)
盐胁迫现已成为生物所面临的主要非生物胁迫之一,我国盐渍化土壤在19个省份均有分布。据报道,中国西北、东北及滨海地区受盐碱胁迫的土地面积超过3.3×107hm2,其中接近一半尚有农业利用潜力[1]。而且,中国西北土壤荒漠化形势严峻,其中盐渍化是主要诱发因子。研究表明,盐胁迫通过渗透胁迫、离子伤害等过程损伤植物,抑制生长[2]。当盐浓度过高时幼苗生长会受到抑制,主要原因是盐分过高破坏了细胞质的完整性,导致细胞选择透过性下降甚至丧失,Na+、Cl-等在细胞内大量积累,降低了K、Ca等元素的含量,细胞内离子平衡失调,引发一系列功能紊乱,从而影响幼苗的生长[3]。此外,在盐碱地上种植的小麦等作物,由于盐胁迫下,光合系统和酶系统受到干扰,进而影响产量和质量。
微藻是一类光合利用度高的低等自养生物,分布广泛,种类繁多,具有固碳、固氮等特性[4]。文献报道,微藻细胞能分泌多聚阴离子大分子胞外多糖(EPS)黏液层,对Na+有强吸附能力,具有优良的脱盐效果。徐嘉男[5]利用螺旋藻和紫球藻处理盐碱土,发现螺旋藻可以使土壤有机质含量增加到19.60 g·kg-1,紫球藻分泌的可溶性多糖能够吸附土壤中的Na+,使可交换性钠含量降低0.10 cmol·kg-1,土壤碱化度降低16.30%,土壤pH值降至8.3。Liu等[6]的研究发现,丝藻多糖(GFP)和低分子量丝藻多糖(LGFP)显著提升了盐胁迫下水稻种子的活力指数。此外,LGFP提升了盐胁迫下水稻幼苗清除活性氧的能力和抗氧化酶活性,并通过提升Na+/H+逆向转运基因的表达水平影响了其根系Na+的转运。另有研究表明[7],泡叶藻提取物处理可以使盐胁迫下拟南芥转录组发生显著改变,调节大量响应胁迫的基因表达,从而提高拟南芥的耐盐性。以上研究表明,微藻可以改良盐碱化土壤,微藻中的活性成分可以从生理层面和分子层面改变高等植物的耐盐能力,因此,微藻生物肥料在盐胁迫下农作物上有良好运用前景。但是鲜有将藻肥运用到盐胁迫下植物的报道,此外,直接将活体藻类作为生物肥料的应用研究不多,活藻对盐胁迫下植物生理特性的影响也不明确。
衣藻是绿藻门衣藻科的单细胞藻类,其产生的孢子具有极强的耐受性,且藻株对环境无污染,对人畜没有致病性[8]。衣藻具有作为生物肥料的良好潜能,衣藻可以分泌大量海藻糖,这种物质具有优良的渗透调节和胁迫保护的作用[9-10]。另有研究表明,在正常光照下,衣藻不仅可以促进土壤微生物的生长,还能够将磷矿粉中作物不能吸收的磷转化为可吸收的磷,从而提高土壤中有效磷的含量,进而增强土壤酶活性,最终达到改善土壤质量以及促进作物生长的效果[11]。除此之外,刘翔等[12]的研究发现,沙角衣藻对重金属胁迫下的小麦幼苗有一定的保护作用。这表明衣藻有提升土壤肥力和提高植物抗逆性的作用。因此,衣藻作为生物肥料具有良好开发前景,此外,衣藻藻粉对盐胁迫下植物生理指标的影响鲜见报道。
本实验采用德巴衣藻(Chlamydomonasdebaryana)藻粉作为生物肥料,将不同浓度的衣藻藻粉添加到高盐胁迫的小麦幼苗中,测定了小麦生物量、可溶性糖含量及可溶性蛋白含量和离子平衡等生理指标。分析了添加不同浓度的衣藻藻粉对盐胁迫下小麦生长和生理指标的影响。
1 材料与方法
1.1 试验材料
小麦长丰2112购自张掖当地农贸市场。衣藻藻粉由甘肃凯源微藻工程技术中心生产的微藻(德巴衣藻)干燥制成粉状,按比例利用无菌水配制藻液,与无菌水(CK)对照,进行试验研究。
1.2 小麦不同处理
首先用20%的过氧化氢对小麦种子表面消毒15 min,然后用无菌水冲洗3次后置于温度为25 ℃的培养箱内,在黑暗状态下萌发24 h。待种子发芽后,挑选萌发一致的种子放入清洗灭菌后的沙土盆中,并将其置于25 ℃、12 h/12 h (300 μmol·m-2· s-1光照/黑暗)的培养箱内进行培养。培养期间,向沙土盆内继续添加清水保持沙土湿润,用于催发小麦种子。待小麦长至两心一叶时,对T0~T4处理组连续施加50 mL 150 mmol·L-1NaCl溶液10 d,期间T0(150 mmol·L-1NaCl溶液)处理组每天补加等量无菌水,T1~T4(藻处理组:衣藻浓度为分别0.25、0.5、1.0、2.0 g·L-1)每3 d添加50 mL藻液,T0组同时添加50 mL无菌水。
1.3 指标测定
待所有处理完成后12 d时取样,先用蒸馏水将样品小麦冲洗3次,再用滤纸擦干植株表面残留水分,然后用剪刀使小麦根茎分离,再用直尺测定其根长和茎长。之后用分析天平称得鲜重,再将样品材料置于烘箱中120 ℃杀青15 min后转至80 ℃烘箱烘至恒重,称得干重,以3株幼苗的平均值表示干重和鲜重,单位为 g。测定下列指标:小麦茎长、根长,采用直尺测量;地上部分、地下部分鲜重并进行根系扫描。
取测定鲜重后健康叶片,称取0.1 g样品,采用考马斯亮蓝法测定可溶性蛋白的含量[13],采用硫酸蒽酮比色法测定小麦叶片中的可溶性糖含量[14]。
采集处理完成后3、6、9、12 d的健康小麦叶片,称重0.1 g后在-80 ℃冰箱保存。采用硫代巴比妥酸法测定丙二醛(MDA)含量,超氧化物歧化酶(SOD)活性以氮蓝四唑法测定,过氧化物酶 (POD)活性以愈创木酚法测定,过氧化氢酶(CAT)活性的测定采用可见光法[15],上述参数采用DR 600 紫外分光光度计测定。
1.4 数据处理
试验数据采用Excel 2013进行整理,用SPSS 21.0软件进行方差分析,用OriginPro 8.5软件制图。
2 结果与分析
2.1 藻粉对盐胁迫下小麦生长指标的影响
2.1.1 藻粉处理对盐胁迫下小麦根长和茎长的影响
小麦幼苗经过盐胁迫后,T0组小麦茎长和根长有了明显的下降,与CK相比分别下降了29%和60%。和T0相比,T1的根长茎长没有显著性差异。而T2~T4处理组效果明显,与T0相比,其茎长分别增加了44.4%、34.7%、37.1%,根长增加了84.0%、53.6%、52.6%。在盐胁迫下,施加藻粉对小麦地下部的促进比地上部更加明显(图1)。
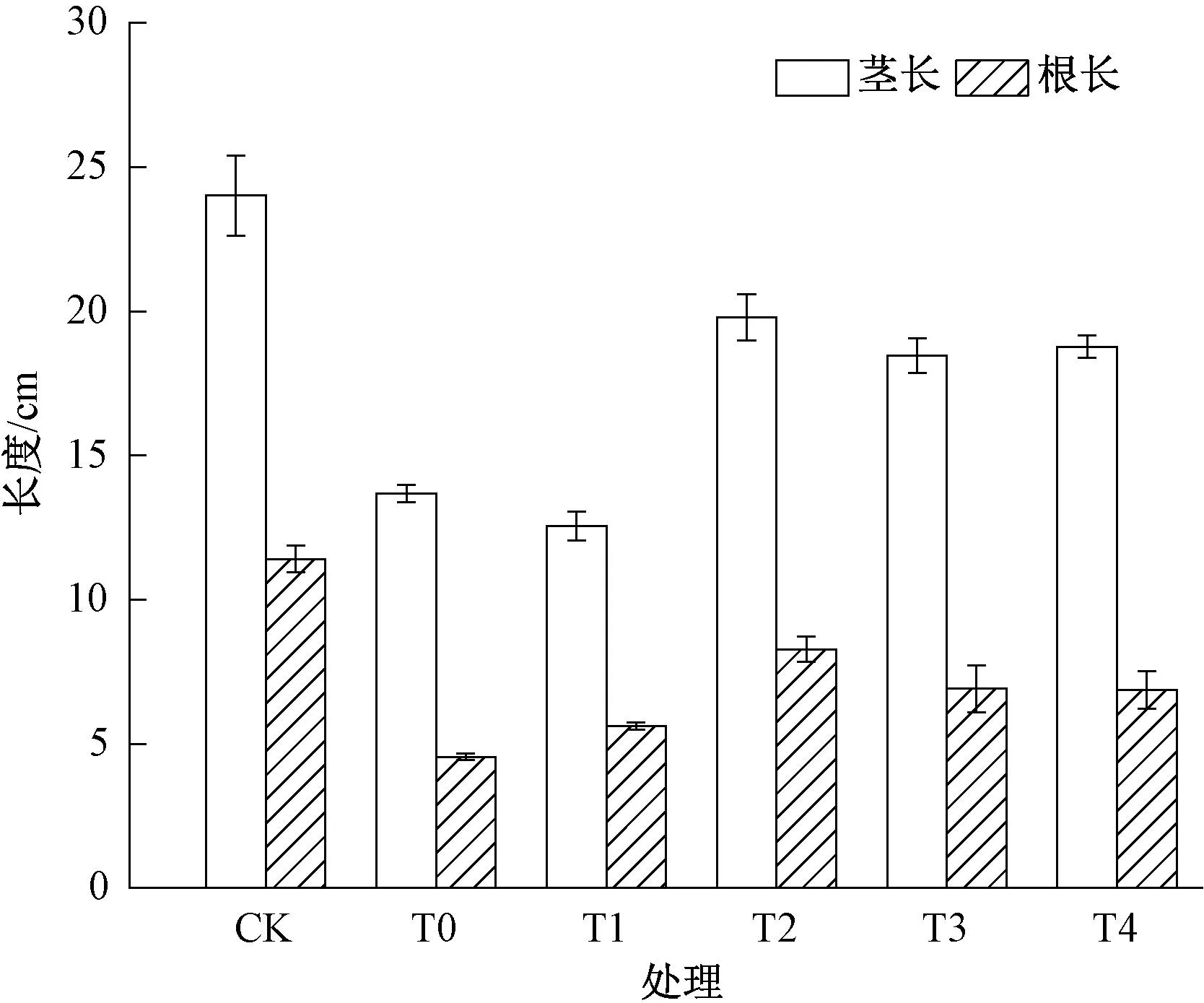
图1 藻粉对盐胁迫下小麦根长和茎长的影响Fig.1 Effects of algae powder on root and stem length of wheat under salt stress
2.1.2 藻粉对盐胁迫下小麦根和茎干重、鲜重的影响
由图2、图3可见,不同浓度藻粉处理对盐胁迫条件下小麦干重具有明显的影响。其中,T0处理组茎干重和根干重相比于对照组分别下降了46%和61%。在添加藻粉后,T1处理组茎干重未见明显变化,但根干重相比于T0处理组增加了61%,T2~T4处理组相比于T0处理组茎干重和根干重均有明显上升,其中茎干重分别增加了17%、17%、11.1%,根干重增加了112%、81%、132%。藻粉处理对小麦地下部的促进作用更为明显。鲜重测量亦发现,各处理组与对照组相比,鲜重皆有明显下降,其中,T0与对照相比其茎鲜重和根鲜重分别下降了54.2%和19.4%,而添加藻粉处理各组,其茎鲜重和根鲜重相比于T0处理组,都有不同程度的提高,其中T2~T4增长较为明显,各处理组茎鲜重与T0处理组相比,分别增加了29.9%、58.8%、53.6%,根鲜重分别增加了69.7%,60.6%,121.2%。由此可见,在盐胁迫下,藻粉处理对小麦地下部鲜重的促进较地上部更为明显。

图2 藻粉对盐胁迫下小麦干重的影响Fig.2 Effect of algae powder on dry weight of wheat under salt stress

图3 藻粉对盐胁迫下小麦鲜重的影响Fig.3 Effect of algae powder on fresh weight of wheat under salt stress
2.1.3 藻粉处理对盐胁迫下小麦根系生长的影响
对不同浓度藻粉处理下的盐胁迫小麦根系扫描结果如图4所示。

图4 小麦根系扫描照片Fig.4 Scanning photos of wheat roots
由表1可见,在经过盐胁迫后,T0根部的各项指标都有不同程度的显著下降,其中根表面积分枝数、分叉数下降较为明显,在添加藻粉处理后,各处理组小麦根部的生长状态得到明显好转。

表1 小麦根系扫描数据Table 1 Scanning data of wheat roots
2.2 藻粉处理对盐胁迫下小麦可溶性蛋白及可溶性糖含量的影响
可溶性蛋白是植物体内用于调节渗透胁迫的重要物质之一。本实验发现,在经过盐胁迫12 d,藻粉处理9 d后,小麦叶片内各处理组可溶性蛋白的含量有了明显的下降,其中T0处理组最为显著,相比于对照组CK下降了38.5%,而经过添加不同浓度的藻粉处理后,各处理组(T1、T2、T3、T4)可溶性蛋白的含量分别比盐胁迫处理组T0提高了14.7%、15.2%、46.2%和18.1%,其中以T3处理组最为显著,而T1和T4处理组无显著性差异(图5)。由此说明,用一定浓度的藻粉处理能有效地缓解盐胁迫带来的叶片中可溶性蛋白含量的下降。

同组柱上无相同小写字母表示不同处理间差异显著(P<0.05)。图6同。图5 藻粉对盐胁迫下小麦可溶性蛋白含量的影响Fig.5 Effect of algae powder on soluble protein content of wheat under salt stress
可溶性糖也是植物体内重要的渗透调节物质之一,其含量的变化能直观地反映出植物受到盐胁迫后体内的渗透调节过程。本实验发现,小麦盐胁迫处理12 d,藻粉处理9 d后,小麦叶片中可溶性糖含量如图6所示。
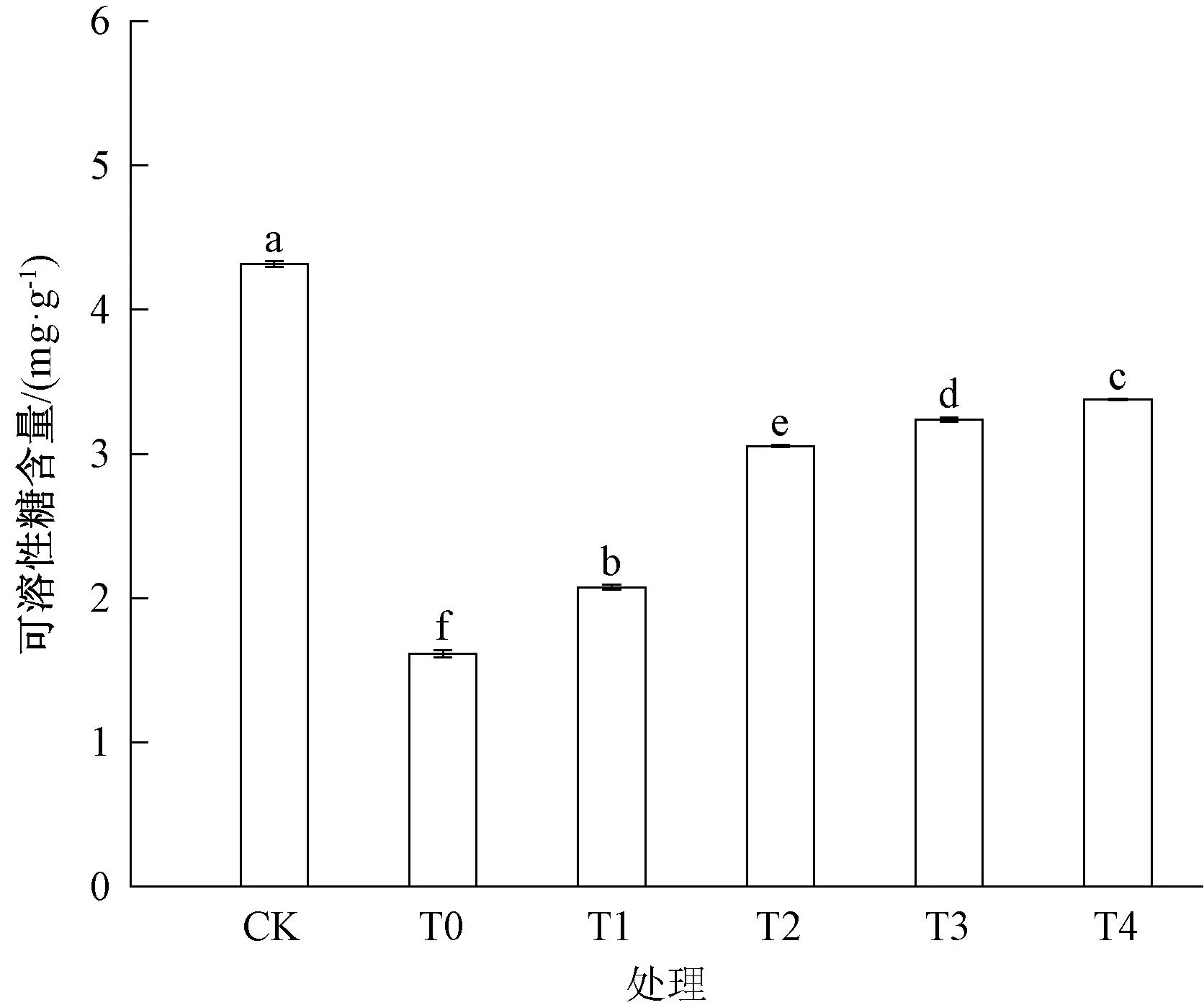
图6 藻粉对盐胁迫下小麦可溶性糖含量的影响Fig.6 Effect of algae powder on soluble sugar content of wheat under salt stress
由图6可见,在盐胁迫条件下,各处理组可溶性糖含量都有了明显的下降,其中盐胁迫处理组T0相比于对照组,其可溶性糖含量大幅下降了62.6%,而经过不同浓度的藻粉处理后,各处理组(T1、T2、T3、T4)与T0相比可溶性糖的含量都有了不同程度的提高,分别提高了28.5%、89.1%、100.5%、109.1%,各处理组提升的比例也有显著性差异,其中T1处理组可溶性糖含量的提升水平显著低于T2、T3和T4处理组,说明高浓度的藻粉处理对小麦叶片可溶性糖含量的提升要高于低浓度藻粉处理。
2.3 藻粉处理对盐胁迫下小麦抗氧化酶活性及丙二醛含量的影响
2.3.1 藻粉处理对盐胁迫小麦超氧化物歧化酶(SOD)活性的影响
如图7所示,在处理后0~12 d对照组 CK的SOD活性呈缓慢上升的趋势,而T0处理组SOD活性则呈现先上升后下降的趋势,在6 d时其SOD活性达到最大,相比于对照组T0处理SOD活性显著增加了24.7%。处理后3 d,各处理组SOD活性相比对照组显著性上升,其中盐胁迫处理组T0比CK增加了22%,在盐胁迫处理6 d,各处理组SOD活性继续增加,其中T3处理组增加最为显著,相比于处理3 d时增加了27%。处理9 d时,各处理组之间SOD活性开始出现显著性差异,其中T0和T1处理组SOD活性开始下降,相比于盐胁迫6 d时分别下降了23.7%和30.2%,盐胁迫12 d时,各处理组SOD活性开始维持稳定。
2.3.2 藻粉处理对盐胁迫小麦过氧化物酶(POD)活性的影响
如图8所示,在整个生长过程中,对照组CK 的POD活性随着时间缓慢上升并维持稳定,而盐胁迫处理组T0,在处理3 d,其POD活性相比于对照组显著提高了59%,而后其POD活性随着时间缓慢上升,在6 d时达到最大值,然后下降,在12 d达到最小。而添加藻粉处理使盐胁迫下小麦POD活性得到回升,在9 d时,T2、T3和T4处理组POD活性显著升高,分别相比于同期对照组提高了56.5%、71.2和53.1%,T1处理组无显著变化。到12 d时,各藻粉处理组(T1~T4)POD活性均显著高于T0,其中T2处理组的POD活性相比于T0显著增加了133.5%。
2.3.3 藻粉处理对盐胁迫小麦过氧化氢酶(CAT)活性的影响
由图9可知,盐胁迫3 d时,各处理组CAT活性均有显著性升高,随着时间的增加,对照组CK的CAT活性变化不大,而盐胁迫处理组T0和各藻粉处理组CAT均呈先上升后下降的趋势,其CAT活性在6 d达到最大,而后开始缓慢下降。9 d时,各处理组之间CAT活性开始出现显著差异性,其中相比于3 d,T0和T1处理组的CAT活性显著下降了34.3%和42.8%,而T3和T4处理组CAT活性略有下降但不显著,T2处理组CAT活性的下降远小于T0和T1处理组。到12 d时,各处理组CAT活性开始趋于稳定,各对照组和处理组CAT活性相比于9 d无显著性变化。

图9 藻粉对盐胁迫下小麦过氧化氢酶活性的影响Fig.9 Effect of algae powder on CAT activity of wheat under salt stress
2.3.4 藻粉处理对盐胁迫小麦丙二醛(MDA)含量的影响
由图10可知,在处理3 d后,各处理组MDA含量有了明显的上升,盐胁迫处理组T0叶片中MDA含量随处理时间开始缓慢升高,处理6 d时,各处理组MDA含量略有上升,但变化并不显著,各处理组也没有明显的差异。盐胁迫处理9 d时,T2、T3和T4处理组MDA含量出现显著下降,相比于T0分别低了35.8%,42.3%和36.4%。盐胁迫12 d时,各组MDA含量趋于稳定,相比于9 d的MDA含量没有显著性变化。
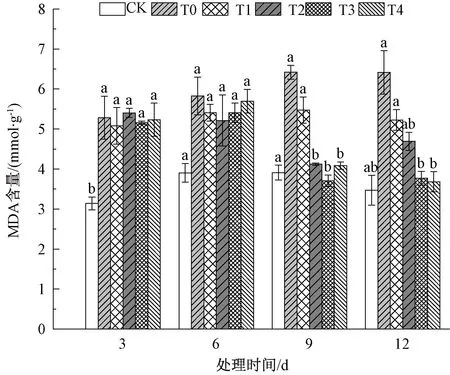
图10 藻粉对盐胁迫下小麦丙二醛含量的影响Fig.10 Effect of algae powder on MDA content of wheat under salt stress
2.4 藻粉处理对盐胁迫下小麦Na+/K+的影响
本研究发现,在盐胁迫条件下,小麦盐胁迫对照组T0地上部和地下部的Na+/K+显著升高,相比于对照组增大了958.7%和1 362.1%。而T3藻粉处理后有所下降,相比于T0组分别降低了54.3%和7.8%(图11)。

图11 藻粉对盐胁迫下小麦幼苗Na+/K+的影响Fig.11 Effect of algae powder on Na+/K+in wheat seedlings under salt stress
3 讨论
盐胁迫是影响植物生长的非生物胁迫因子之一,盐浓度超过植物耐受阈值时会出现植物生长发育受到抑制和光合作用效率下降等现象,影响植物生长。微藻可以分泌多种生物活性物质,如植物激素和胞外多糖等,这些物质能够促进植物生长,改善土壤质量,减缓盐胁迫对植物生长的抑制作用。本研究中,盐胁迫处理组T0小麦幼苗的根长、茎长、干重和鲜重相比于对照组CK都有了明显下降,说明小麦生长发育和物质积累受到严重抑制。而在添加藻粉处理后,各处理组小麦幼苗的各项生长指标都有了明显增长。可能的原因是微藻分泌的多糖物质和生长刺激素促进了小麦幼苗的生长[16];或者衣藻自身富集了大量的NaCl,减轻了植株受胁迫的程度。该试验结果与Arroussi等[17]研究结果相一致。说明添加衣藻能够促进植物在盐胁迫条件下的生长。
可溶性糖和可溶性蛋白是植物体内重要的渗透调节物质,其含量的变化反映了小麦渗透调节能力的变化[18-19]。植物遭受盐胁迫时,细胞内的蛋白质分解成氨基酸的速率提高,蛋白质合成受阻,故可溶性蛋白含量下降[20];而外源物质可以使受盐胁迫的植物渗透调节能力恢复[21],从而使受盐胁迫植物的可溶性糖含量和可溶性蛋白含量增加[22];这与本实验结果一致。说明衣藻藻粉可能参与植物渗透调节,维持正常生理代谢活动。在本实验中,经过12 d的盐胁迫后,T0处理组的可溶性糖和可溶性蛋白的含量相比于同期对照组CK出现明显下降,表明小麦细胞在高浓度盐胁迫(150 mmol·L-1NaCl)的条件下逐渐失去了渗透调节能力,而添加藻粉的各处理组(T1~T4)其可溶性糖含量和可溶性蛋白含量均出现不同程度的回升。综上,本研究表明藻粉可以帮助受到盐胁迫的小麦细胞恢复一定的渗透调节能力。而高浓度藻粉处理(1 g·L-1)显著高于低浓度处理(0.25 g·L-1),这表明藻液处理的作用效果跟浓度有很大关系,以1 g·L-1最为适宜。
当植物面临各种胁迫时,植物体内积累活性氧(ROS)增多会引起植物细胞遭受氧化胁迫[23],最终使植物细胞功能失常,植物生长受阻。SOD、POD和CAT是植物体内应对外部胁迫的抗氧化酶,当植物受到盐胁迫时,植物体内出于自我防御的需要,会提高这些酶的活性,从而提高自身抗逆性。本试验发现,当盐胁迫3 d时,各处理组的SOD、POD和CAT的活性均持续上升,在处理后6 d时达到最大。这表明盐胁迫对小麦自身抗氧化酶的活性有抑制作用。小麦幼苗体内抗氧化酶不足以清除积累过多的ROS,可能影响小麦生长。而在添加藻粉后,各处理组抗氧化酶的活性明显升高,其中POD活性的提升最为明显。这说明藻粉处理能够有效增加小麦抗氧化酶的活性从而加快清理因盐胁迫而积累在小麦体内的ROS,从而减缓盐胁迫对植物的损伤。MDA是植物膜脂质过氧化的主要产物之一,其在植物体内含量的变化能直观地反映植物细胞氧化损伤程度[24]。本研究中,在处理后3 d时,小麦叶片中MDA含量有了明显上升。而添加藻粉处理后,抗氧化酶活性得到明显提升,MDA含量也开始下降。这与其他生物肥料处理[25-26]对盐胁迫下小麦的抗氧化酶活性和MDA含量的影响类似,这说明衣藻藻粉可有效降低小麦细胞氧化损伤程度,从而维持其正常功能,进而增强小麦的抗逆性并促进其生长。而在处理3~12 d期间,T3处理组的POD、SOD、CAT活性基本是最高的,而MDA含量却是最低的,因此,1 g·L-1藻液处理效果最佳。
K+是所有高等植物里含量最多的离子,能够参与调控植物离子平衡、参与蛋白质合成、参与光合作用、调节细胞渗透压,是植物生长发育很重要的一种微量元素。而Na+元素因为其离子半径和水合能与K+类似,能够抢占细胞中K+的吸收位点,从而导致细胞对K+的吸收能力下降。因而,植物细胞内K+含量的稳定和较低的Na+/K+能反映细胞内离子平衡状态[27]。而在盐胁迫环境中,植物的Na+/K+会急剧增加直到超过其生长所能承受的最大临界值[28]。这与本研究结果相同。而各藻粉处理组小麦根和叶片中Na+/K+显著降低。这是因为藻粉处理改善了盐胁迫条件下的土壤微环境,使小麦根际Na+含量降低[29]。本研究说明在盐胁迫条件下添加一定浓度的衣藻藻液能有效维持小麦内部离子平衡,进而促进其生长。
4 结论
综上所述,微藻能够合成丰富的生物活性成分,为作物提供丰富的矿物质营养,促进农作物代谢生长[30]。本研究得出以下结论:藻粉处理能够促进盐胁迫下小麦植株的生长、促进其离子平衡的稳定并维持其渗透调节能力,一定程度上增加其抗氧化酶活性,使其抗盐胁迫能力增强。

