血液辐照对悬浮红细胞中红细胞微粒释放及创伤患者深静脉血栓形成的影响*
武丽芳,陆 华,许桂平△
(重庆医科大学附属第二医院:1.检验科;2.输血科,重庆 400010)
红细胞(red blood cell,RBC)在保存过程中会发生储存损伤,其主要表现在腺苷三磷酸(adenosine triphosphate,ATP)先升高后降低、2,3-二磷酸甘油酸(2,3-DPG)下降、S-亚硝基血红蛋白(SNO-Hb)下降、乳酸增加与pH值降低、结合珠蛋白下降、K+浓度增加、生物活性分子堆积(如细胞因子、组胺等)、RBC形态球形棘状改变、磷脂酰丝氨酸外翻等[1-3]。此外,在RBC保存过程中,其细胞膜可向细胞外释放大小为0.1~1.0 μm的囊泡,这些囊泡称为红细胞微粒(red blood cell-derived microparticles,RMP),RMP数量随着RBC保存时间延长而增加[4]。目前研究发现,Ca2+升高、ATP缺失、K+升高、GPCR等信号通路的激活是促进RMP产生的重要因素[4-6]。进一步研究发现RMP具有促进凝血、促进炎性反应、加速一氧化氮清除、促进内皮细胞黏附等功能[6]。由于RMP功能的多样性,RMP被认为与地中海贫血、阵发性睡眠性血红蛋白尿症等血栓并发症有关[7],也可能是输血后血栓并发症的主要因素[8]。
血液辐照(通常为γ射线)可以减灭淋巴细胞的免疫活性,辐照后的血液多用于器官移植患者,达到预防输血相关性移植物抗宿主病的目的[9]。γ射线直接使淋巴细胞核DNA变性,使其停止增殖,但也会损伤其他细胞。有研究报道,当受到辐照时,RBC脂质过氧化、细胞膜受损、血浆K+升高、乳酸脱氢酶和血红蛋白浓度升高、细胞弹性和变形能力降低[10-11]。由于K+是RMP产生的重要原因之一,所以悬浮红细胞(suspended red blood cells,SRBC)经辐照后RMP含量有可能会增加。在临床使用过程中,富余的辐照SRBC也常用于其他非移植患者。鉴于RMP的促凝血功能及其与输血后血栓形成的关系[6,12],因此将辐照SRBC输注给非移植患者,尤其是好发深静脉血栓(deep vein thrombosis,DVT)的创伤患者[13],可能会增加其DVT的发生率。本研究旨在探讨血液辐照后SRBC中RMP的变化特点,分析辐照SRBC输血与创伤患者DVT形成之间的关系,现报道如下。
1 资料与方法
1.1 一般资料
1.1.1献血员资料
收集2022年本院输血科献血员未辐照SRBC和辐照SRBC血辫各105例,辐照由重庆市血液中心采用德国Biobeam GM8000辐照仪25 Gy γ射线照射10 min。按保存时间分成3、7、14、21、28、35、42 d共7组,取血辫血液1.5 mL经1 550 g×5 min离心,留取上层血浆于-80 ℃保存备用。
1.1.2创伤患者资料
收集2018年1月至2023年4月本院急救部297例创伤患者,纳入标准:(1)主要诊断为骨折、多发伤、高坠伤、挤压伤、摔伤;(2)行动受限,需要卧床治疗;(3)住院超过3 d。排除标准:(1)入院前已卧床超过3 d;(2)入院前使用雌激素治疗;(3)合并肿瘤;(4) 合并炎症性肠病、系统性红斑狼疮等静脉血栓栓塞风险增加的疾病;(5)入院时已有DVT;(6)拒绝签订知情同意书。其中未输血患者148例(未输血组),入院至确诊DVT之间有SRBC输血的患者149例(RBC输血组),其中未辐照SRBC输血的患者76例(未辐照组),含有辐照SRBC输血的患者73例(辐照组),对患者年龄、性别、创伤类型、是否长骨骨折、是否脊髓损伤、入院时(血压、心率、体温、Hb)、住院时间、住院期间死亡率、SRBC总输血量(入院至确诊DVT期间)、RBC储存时间、DVT发生率进行统计分析。DVT诊断标准[14]:患肢出现胀痛、压痛、皮肤呈暗红色、浅表静脉怒张等症状,经血管超声或造影确诊存在DVT(管腔内探及实性回声,充盈缺损,管腔不能完全压闭,非期相性血流,连续探测血管腔、管径)。本研究经医院伦理委员会批准[2020年科伦审第(178)号]。
1.2 方法
1.2.1流式细胞术检测RMP
取5管ABO、RhD均同型且储存时间相同的冻存标本,经冰上缓慢解冻后取1 mL离心20 000 g×90 min沉淀RMP,弃掉上层900 μL,留取底部包含红色沉淀液体100 μL。5个标本混合后再加入1 mL 磷酸盐缓冲液(phosphate buffer saline,PBS)混匀,20 000 g×90 min洗涤1次,留取底部100 μL制成RMP悬液。取1 mL健康体检者新鲜全血用2 mL PBS 1 000 g×2 min洗涤2次,重悬至总体积1 mL。30 μL标本中加入265 μL PBS和5 μL荧光抗体,抗体异硫氰酸荧光素(fluoresce in isothiocyante,FITC) anti-235a(559943)、PE膜联蛋白Ⅴ(Annexin Ⅴ,560930)、FITC鼠IgG2b(556655)和Annexin Ⅴ结合缓冲液(556454)均购自美国BD Biosciences公司,1.0~1.4 μm 质控微球(Beads)(FH-1056-2)购自美国Spherotech公司,混匀后暗室孵育15 min,1 h内上机检测(CytoFLEX流式分析仪,美国Beckmancoulter公司)。检测速度10 μL/min,连续记数1 min。取储存时间相同的3个富集标本的平均值作为最终结果。
1.2.2血浆电解质测定
血辫血液1.5 mL经1 550 g×5 min离心,留取上层血浆,用美国Beckmancoulter AU5800全自动生化分析仪检测K+、Na+、Cl-的浓度,取储存时间相同的3个不同标本的平均值作为最终结果。
1.3 统计学处理
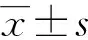
2 结 果
2.1 RMP的分离鉴定
采用流式细胞术通过颗粒的大小和形态区分RBC和RMP颗粒群。红细胞群比Beads直径大,且96.8%表达红细胞系标志物CD235a,4.7%表达膜损伤标志物Annexin Ⅴ。而RMP群比Beads直径小,且97.4%表达红细胞系标志物CD235a,98.1%表达膜损伤标志物Annexin Ⅴ(图1)。无论是颗粒大小还是表面标志物表达特点均符合RMP的特征,说明通过流式细胞术分离的这群较小颗粒属于RMP。
A:根据大小和形态区分三个颗粒群的门;B、C:分别为RBC群细胞膜表面CD235a、Annexin Ⅴ的表达水平;D、E:分别为RMP群膜表面CD235a、Annexin Ⅴ的表达水平。
2.2 辐照对SRBC血辫中RMP释放的影响
在所有相同储存时间点,辐照SRBC的RMP均明显高于未辐照SRBC(P<0.01),见表1。
表1 不同储存时间SRBC血辫血液中RMP数量个/μL)
2.3 辐照对SRBC血辫中其他电解质的影响
无论是否辐照,随储存时间延长,SRBC血辫中的Cl-含量没有明显的变化(P>0.05),Na+含量随储存时间延长而降低,且辐照SRBC血辫中的Na+含量略低于未辐照SRBC(除28 d外)。SRBC血辫中的K+含量随储存时间延长而升高,第28天达峰后略有下降;与未辐照SRBC血辫相比,除了第28天和35天,每个检测点辐照SRBC血辫中的K+含量更高(P<0.05),见表2。
表2 辐照前后SRBC血辫血液中部分电解质随储存时间的变化
2.4 辐照SRBC输注对创伤患者DVT形成的影响
RBC输血组(45/149,30.2%)比未输血组(17/148,11.5%)的DVT发生率更高(P<0.001),同时也有更高的长骨骨折率、入院心率、住院时间、住院死亡率。在RBC输血组患者中,未辐照组和辐照组的年龄、性别、损伤类型、入院时基本指标、住院时间、住院死亡率均没有明显差异(P>0.05),辐照组的DVT发生率高于未辐照组(P<0.05)。辐照组中的平均储存天数低于未辐照组(P<0.001)。此外辐照组的RBC输血量明显高于未辐照组(P<0.001),见表3。
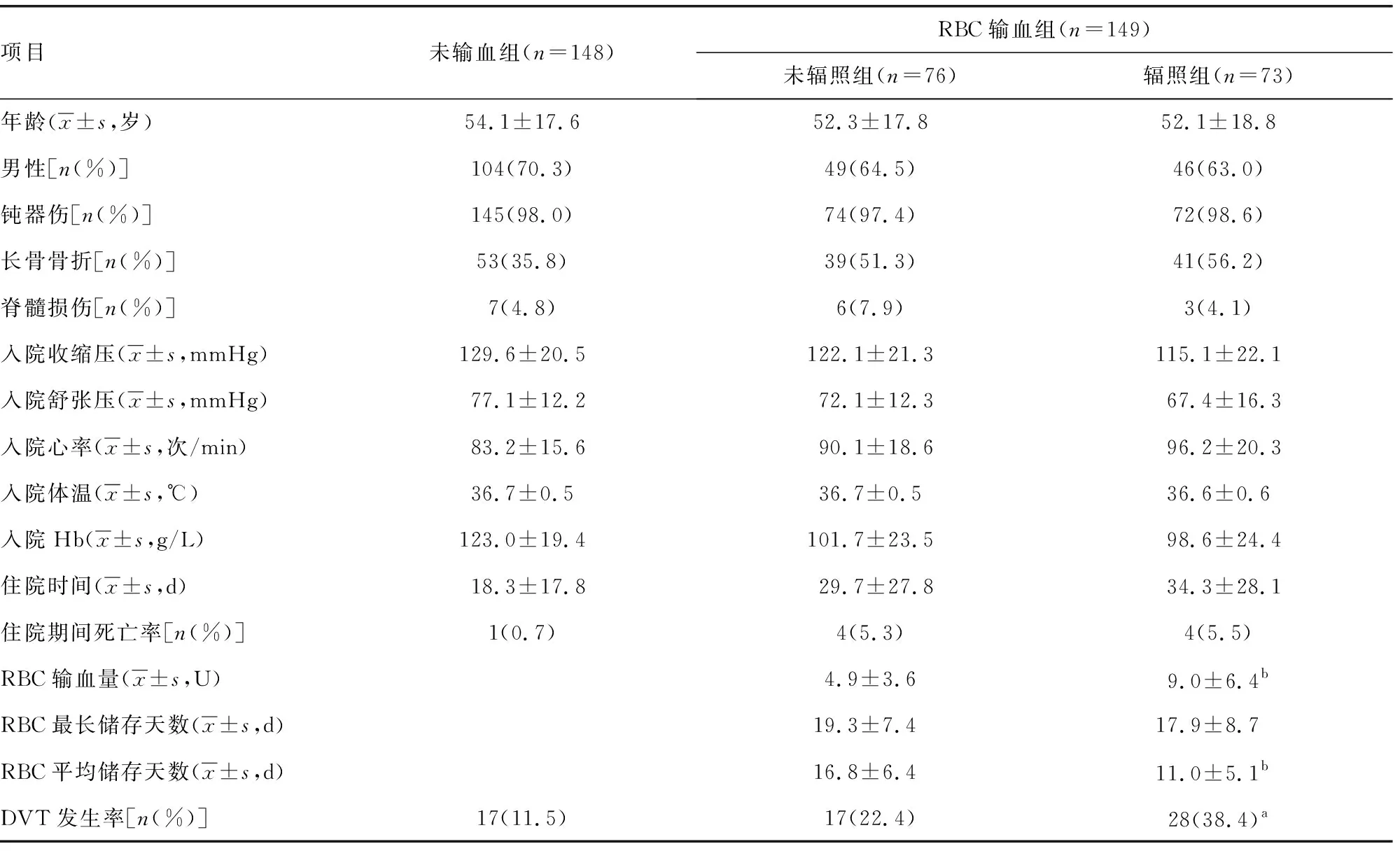
表3 不同输血组的病例特点及DVT发生率
为了阐明RBC输血量、RBC储存时间、辐照SRBC输血等与DVT发生的关系,进一步进行多因素逻辑回归分析,结果显示:辐照SRBC输血是DVT的风险因素(OR=2.16,P<0.05),而且DVT发生率随着所输注辐照SRBC的含量增加而升高,含量超过50%时有显著差异(P<0.05),见图2。

A:对RBC输血组DVT发生率进行多因素逻辑回归分析;B:总输入RBC含量辐照SRBC与DVT发生率的关系;a:P<0.05,与辐照SRBC含量为0比较。
3 讨 论
1933年AUER首次报道RBC产生丝状物的现象,20世纪70年代人们分离了RBC产生的微粒,并描述了其特点,至此拉开了RMP研究的帷幕[15]。研究表明,健康人外周血RMP约为8.5×108个/L,其生成速度约为RBC生成速度的8 120倍。储存过程中RMP随储存时间逐渐增多,保存20 d以后,RMP产生速度会逐渐加快[5]。由于γ射线在灭活淋巴细胞的同时也加速红细胞K+渗漏[16],而K+升高是RMP产生的原因之一,因此推测辐照可能通过K+变化引起RMP释放加快。本研究检测了辐照前后SRBC中的RMP含量,发现辐照SRBC比相同储存时间未辐照SRBC中的RMP含量更高,且SRBC中的RMP随储存时间延长而增加。进一步检测辐照SRBC中的电解质,辐照后K+在短时间内迅速升高,与其他研究报道相似[16]。推测K+可能是促进RMP释放的重要原因之一。
研究发现,RMP会以组织因子依赖的方式增强体内凝血过程,也可促进蛋白C系统的抗凝反应,具有广泛的止血活性,在自发性高血压大鼠中注射RMP可以控制其颅内出血的程度[17]。RMP也可以作为止血剂抑制患者和大鼠颅内血肿的形成[18-19]。此外,RMP可以调节免疫和抑制一氧化氮引起的血管舒张功能[20-21]。由于SRBC保存过程中RMP的增加及RMP的促凝血活性,一些研究认为RMP与输血后某些不良反应有关。RMP既可以通过结合大量补体和免疫球蛋白活化白细胞,进而可能诱发输血相关性急性肺损伤,也可以与大多数CD40L相结合,进而活化PMC氧化酶,引起肺内皮细胞损伤[22]。此外,有研究发现,创伤患者输注储存时间更长的RBC,DVT发生率更高,说明RBC储存损伤确实与DVT的发生有关,而RMP可能在DVT形成过程中发挥了一定作用[23]。进一步研究发现,RMP可以通过P-选择素促进微血栓的形成[24]。也有研究报道,向小鼠直接输入RMP提取物可以引起血液高凝状态[25],但RMP与DVT直接的相关性尚未见报道。本研究在辐照SRBC中检测到RMP升高,辐照SRBC输血者DVT发生率较高,但RMP与DVT的关系尚需体内和体外实验去验证,RMP在创伤患者DVT形成中的作用和机制也需进一步研究。受限于更早时间的数据缺失及创伤患者使用辐照SRBC次数不多,统计的病例有限,因此下一步将纳入更多的数据进行分析。
综上所述,随着储存时间延长,辐照SRBC中RMP和K+含量会逐渐升高,K+可能是促进RMP释放的因素之一。此外辐照SRBC输血是创伤患者发生DVT的风险因素之一,应严格把控辐照SRBC的输血适应证。

