氯化锂通过PI3K/Akt信号通路调控牙髓干细胞成牙本质向分化的研究*
李 鹏,刘会琴,李东雨,朱小苗,王胜朝,何文喜,王志华△
(1.中国科学院大学成都存济口腔医院,成都 610031;2.新安县人民医院口腔科,河南洛阳 471899;3.口颌系统重建与再生全国重点实验室/国家口腔疾病临床医学研究中心/陕西省口腔医学重点实验室/空军军医大学第三附属医院牙体牙髓病科,西安 710032;4.空军军医大学空军特色医学中心口腔科,北京 100142)
牙髓干细胞(dental pulp stem cells,DPSCs)在牙髓损伤修复过程中发挥着重要作用,但调控 DPSCs成牙本质向分化的信号转导机制仍不完全清楚。Wnt/β-连环素(β-catenin)信号通路在牙胚生长发育、牙齿和牙周组织形态发生、牙上皮的增殖发育及成牙本质细胞的生长分化等过程中都发挥着重要作用[1-3]。氯化锂(LiCl)作为Wnt/β-catenin通路激活剂,可促进成牙骨质细胞增殖及牙周膜干细胞分化[4-6]。然而,氯化锂是否可以促进牙髓损伤修复过程目前尚未见报道。磷脂酰肌醇-3激酶/蛋白激酶B(phosphoinositide-3-kinase/protein kinase B,PI3K/Akt)信号通路在整个机体细胞存活、生长和分化等生物行为的调控中起着核心作用[7-8]。研究发现PI3K/Akt通路可受到Wnt配体的调节,二者之间发生复杂的相互作用,在诱导成骨细胞功能和骨折愈合等方面发挥重要作用[9]。而PI3K/Akt是否可通过Wnt/β-catenin信号通路调控牙髓再生和牙髓损伤修复过程仍未可知。本研究拟观察氯化锂对人DPSCs生物学行为的影响及其相关分子机制,这对阐明牙髓损伤修复的分子机制有重要意义,也可以为将来临床活髓保存治疗和DPSCs组织工程应用提供新思路。
1 材料与方法
1.1 材料
1.1.1人DPSCs培养和鉴定
本研究经空军军医大学第三附属医院伦理委员会审核通过(IRB-REV-2022065),所有受试者均知情同意。参照文献[10-11]报道的方法进行DPSCs培养和鉴定,从新鲜拔除的人(18~20岁)第三磨牙牙冠取新鲜牙髓组织于6孔板,采用胶原酶和Dispase酶联合消化牙髓组织20 min后进行原代培养,用含20%胎牛血清的α-最低必需培养液(α-minimum essential medium,α-MEM,美国Gibco公司)0.7 mL重悬组织,静置培养,3 d后补液至1 mL,每2天更换培养液至细胞呈放射状生长,传代后进行单克隆培养。单克隆筛选获得DPSCs细胞系,进行干细胞鉴定。
1.1.2主要仪器与试剂
主要仪器:超净工作台(苏州安泰空气技术有限公司);ELX808全自动酶标仪(美国BioTek公司);倒置相差显微镜和照相系统(日本Olymous公司);PCR仪及实时定量 PCR系统(美国Applied Biosystems公司);电泳仪、全能型蛋白转印系统、转膜仪及化学发光成像系统(美国Bio-Rad公司)。主要试剂:α-MEM 培养基、胰蛋白酶(美国Gibco公司);胶原酶(德国BioFroxx公司);胎牛血清(杭州四季青生物工程材料有限公司);β-甘油磷酸钠、Western 封闭液、一抗稀释液、二抗稀释液(上海碧云天生物技术有限公司);1%茜素红染色液(北京索莱宝科技有限公司);反转录试剂盒(德国Qiagen公司);SYBR PCR试剂盒(日本TaKaRa公司);PCR仪及ABI Prism 7500 real-time PCR系统(美国Applied Biosystems公司);二喹啉甲酸(BCA)定量试剂盒、RIPA(强)裂解液(西安赫特生物科技有限公司);超敏电化学发光(electrochemiluminescence,ECL)显影液(苏州四正柏生物科技有限公司);LY294002(美国Sigma公司);小鼠抗人3-磷酸甘油醛脱氢酶(GAPDH,武汉三鹰生物技术有限公司)。
1.2 方法
1.2.1茜素红染色检测矿化结节生成
取克隆生长状态好的P5代DPSCs,以2×105个/孔的细胞密度接种于6孔培养板。用含 10%胎牛血清的α-MEM培养基培养细胞达80%以上的汇合率,更换矿化诱导液(10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、10 nmol/L地塞米松、50 mg/L维生素C和含10 mmol/L β-甘油磷酸钠的α-MEM培养基)。用浓度0、1、10 mmol/L的氯化锂加或不加LY294002(25 μmol/L)刺激DPSCs,每3天换液1次,诱导1或2周后终止。磷酸盐缓冲液(phosphate buffer saline,PBS)清洗细胞3次,4%多聚甲醛固定细胞15~30 min;再用PBS清洗细胞3次,清除残余固定液;40 mmol/L pH 4.2的茜素红染色5~10 min,用双蒸水(double distilled water,ddH2O)洗去残留染液,直至洗液变清为止。倒置显微镜下观察并拍照记录矿化结节的形成情况。最后,用10%十六烷基吡啶溶液溶解培养皿里的茜素红,采用ELX808全自动酶标仪检测562 nm波长处的吸光度[A(562)]值并记录。
1.2.2实时荧光定量逆转录PCR(real-time fluorescent quantitative reverse transcription PCR,RT-qPCR)检测成牙本质标志基因的表达
以2×105个/孔的细胞密度将DPSCs接种于6孔培养板,培养至汇和率达80%左右时,用含浓度0、1、10 mmol/L氯化锂加或不加LY294002(25 μmol/L)的矿化诱导液刺激DPSCs,每3天换液1次,诱导2周后终止。用Trizol试剂提取细胞总RNA,用Omniscript RT反转录试剂盒(德国Qiagen公司)合成 cDNA。将cDNA和SYBR PCR试剂混合,使用ABI Prism 7500 real-time PCR系统进行逆转录。PCR循环条件:95 ℃ 10 s,60 ℃ 15 s,72 ℃ 10 s,35个循环。牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)、牙本质基质蛋白1(dentin matrix protein 1,DMP1)、碱性磷酸酶(alkaline phosphatase,ALP)、骨涎蛋白(bone sialoprotein,BSP)、骨钙素(osteocalcin,OCN)基因引物序列见表1。以GAPDH基因为内参基因,将目的基因相对于人GAPDH和对照(未处理细胞)水平的相对倍数变化归一化,采用2-ΔΔCt法表示目的基因相对表达水平。
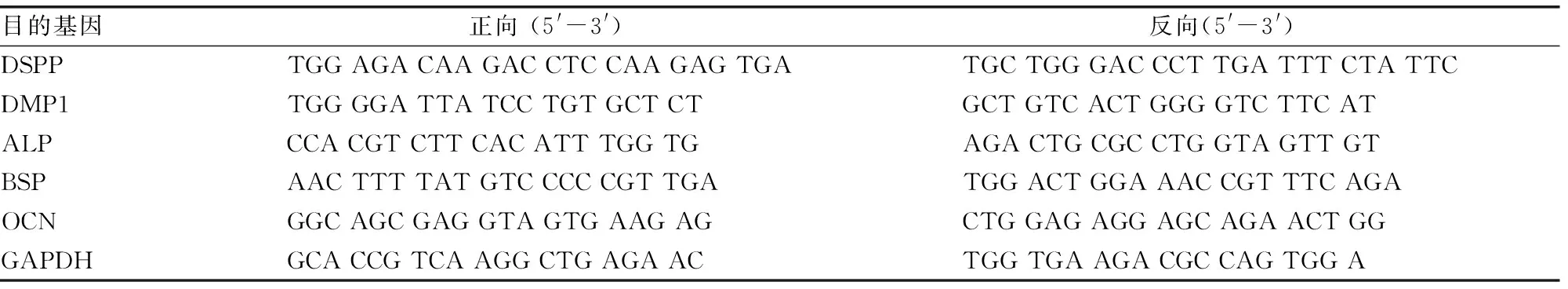
表1 PCR引物序列
1.2.3Western blot检测Akt及磷酸化Akt(phosphorylated Akt,p-Akt)水平
6孔板每孔接种2×105个DPSCs,细胞汇合度达到80%左右加入浓度1 mmol/L氯化锂(加或不加LY294002),用不含血清的α-MEM培养基饥饿培养6、12、24 h后终止培养,以未加入氯化锂和LY294002处理的细胞为对照(0 h)。弃去培养液,加入预冷的PBS,清洗3次;每组加入适量含苯甲基磺酰氟(PMSF)的IP裂解液(PMSF终浓度1 mmol/L),冰上裂解10 min将细胞刮下收集至EP管内,4 ℃、12 000×g离心15 min;然后将上清液转移至新的EP管中进行BCA定量,加入5×十二烷基硫酸钠(SDS)上样缓冲液,煮沸10 min。配制10%分离胶和5%浓缩胶,每条泳道加样20 μg蛋白,220 V恒压电泳30 min分离样品蛋白;聚偏二氟乙烯(PVDF)膜先用甲醇活化,再半干转膜,25 V恒压电泳7 min;转膜完成后,将PVDF膜放入封闭液中封闭 0.5 h。PI3K/Akt各磷酸化蛋白和总蛋白抗体按照1∶1 000稀释于5%胎牛血清中,4 ℃过夜。TBST清洗3次,每次5 min,放入辣根过氧化物酶标记的山羊抗兔IgG二抗(抗体稀释液1∶5 000稀释),37 ℃孵育1 h,TBST清洗3次,每次5 min。ECL液(A、B液以1∶1混合)均匀涂于膜上,使用增强型化学发光成像系统对蛋白质条带进行曝光。ImageJ软件分析面板灰度作图,计算p-Akt/Akt比值。
1.3 统计学处理
2 结 果
2.1 氯化锂对DPSCs牙本质向分化能力的影响
茜素红染色分析发现:矿化诱导1周后,各组均形成很少的矿化结节,见图1A、B;矿化诱导2周后,各组均产生较多的矿化结节,其中1 mmol/L氯化锂刺激可明显促进DPSCs矿化结节的形成(P<0.05),而10 mmol/L氯化锂刺激后矿化结节形成减少(P<0.05),见图1A、C。RT-qPCR结果发现,1 mmol/L氯化锂刺激DPSCs 2周可明显促进成牙本质标志基因DSPP、DMP1、BSP、ALP mRNA的表达(图1D),提示1 mmol/L氯化锂刺激DPSCs能够诱导其牙本质向分化。
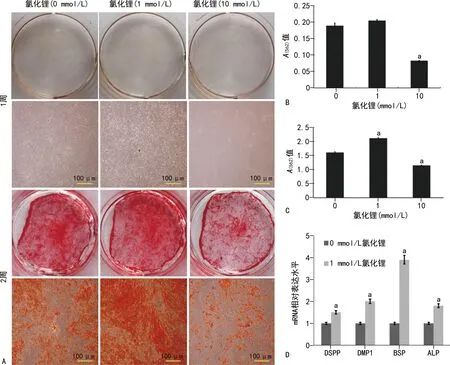
A:茜素红染色;B、C:分别为不同浓度氯化锂刺激DPSCs 1、2周后茜素红染色定量分析;D:不同浓度氯化锂刺激DPSCs 2周后成牙本质标志基因定量分析;a:P<0.05,与0 mmol/L氯化锂比较。
2.2 PI3K/Akt信号通路对氯化锂调控的DPSCs分化过程的影响
为了验证PI3K/Akt信号通路是否参与氯化锂调控的DPSCs成牙本质向分化过程,用PI3K信号通路抑制剂LY294002(25 μmol/L)加或不加氯化锂(1 mmol/L)刺激DPSCs矿化诱导2周,通过茜素红染色分析发现,氯化锂(1 mmol/L)可明显促进DPSCs矿化结节形成(P<0.05),而加入LY294002(25 μmol/L)明显削弱了氯化锂(1 mmol/L)对DPSCs矿化结节形成的作用(P<0.05),见图2A、B。RT-qPCR结果发现,氯化锂(1 mmol/L)明显促进DPSCs牙本质标志基因DSPP、DMP1、ALP mRNA的表达;而加入LY294002(25 μmol/L)后DSPP、DMP1、ALP mRNA表达明显下调(P<0.05),见图2C~F。

A、B:茜素红染色及定量分析;C~F:分别为DSPP、DMP1、ALP、OCN mRNA定量分析;氯化锂浓度:1 mmol/L;a:P<0.05,与氯化锂和LY294002未处理细胞比较;b:P<0.05,与1 mmol/L氯化锂刺激细胞比较。
2.3 PI3K/Akt信号通路对氯化锂诱导的DPSCs内Akt蛋白活化情况的影响
为了进一步验证PI3K/Akt信号通路的作用,用1 mmol/L氯化锂刺激DPSCs 0、6、12、24 h(加或不加LY294002),通过Western blot检验PI3K通路下游Akt活化情况,结果显示:氯化锂刺激DPSCs后p-Akt/Akt比值明显升高(P<0.05),并具有时间依赖性;而加入LY294002共同刺激24 h后,p-Akt/Akt比值明显下降(P<0.05),LY294002明显抑制Akt的磷酸化,见图3。
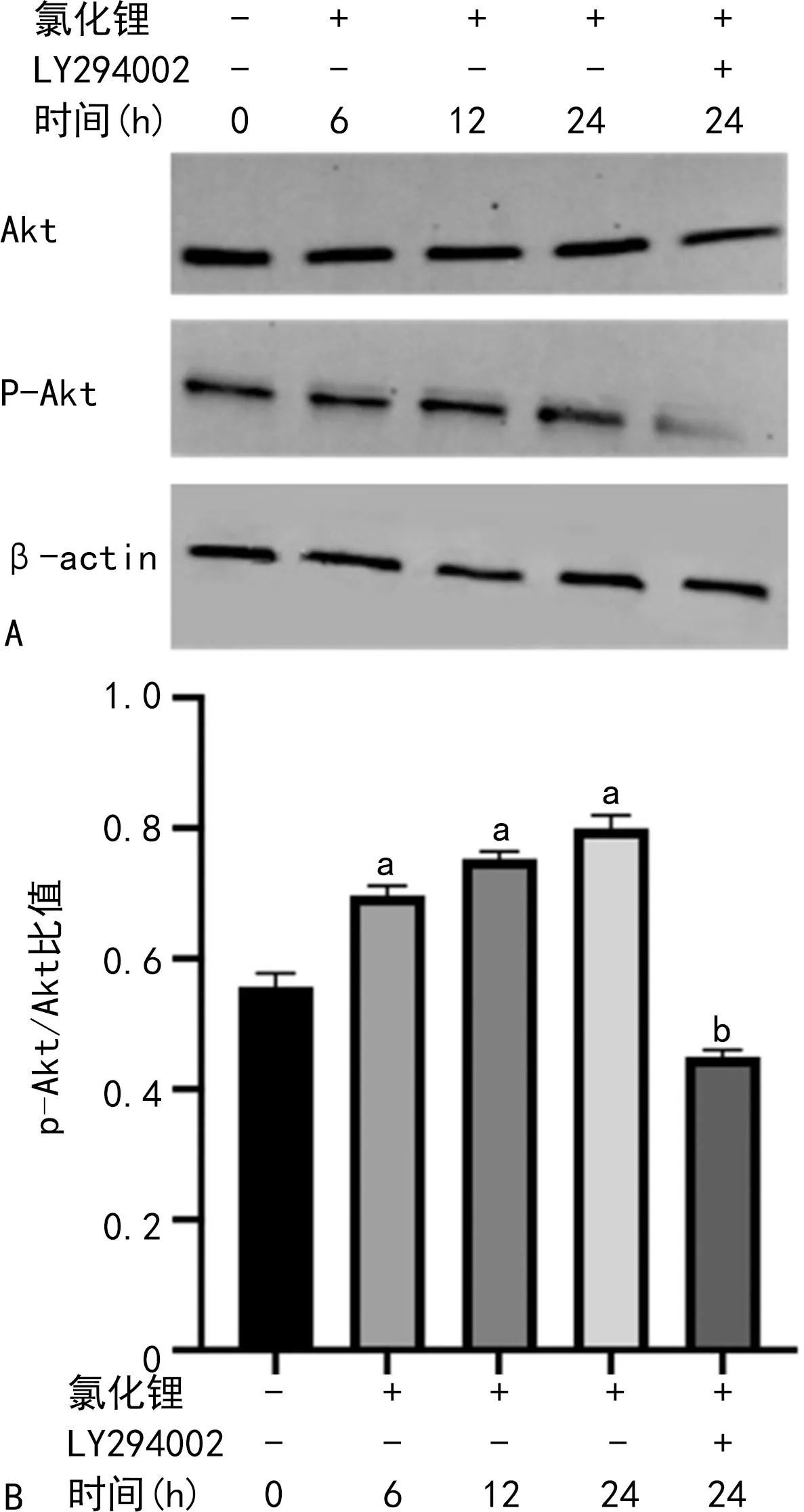
A:Akt及p-Akt蛋白表达变化;B:p-Akt/Akt比值比较;氯化锂浓度:1 mmol/L;a:P<0.05,与0 h比较;b:P<0.05,与1 mmol/L氯化锂刺激24 h比较。
3 讨 论
DPSCs成牙本质向分化对于牙髓损伤修复和牙齿再生,甚至组织再生都起着至关重要的作用,其机制研究一直是牙髓生物学领域的热点研究问题。氯化锂是美国食品药品监督管理局(Food and Drug Administration,FDA)批准的可通过阻止β-catenin磷酸化激活Wnt/β-catenin通路的药物[12]。研究发现,氯化锂可通过抑制糖原合成酶激酶-3β(glycogen synthasc kinase-3β,GSK-3β)而激活Wnt/β-catenin通路促进骨形成[13]。体内研究也发现,氯化锂可促进骨质疏松大鼠的骨再生[14]。此外,氯化锂可明显降低正畸治疗导致的牙根吸收[15],促进成牙骨质细胞增殖及牙周膜干细胞分化[4-6]。本研究结果发现,1 mmol/L氯化锂刺激DPSCs可明显促进矿化结节的形成,而10 mmol/L氯化锂刺激后矿化结节明显减少。进一步通过RT-qPCR检测发现,1 mmol/L氯化锂刺激DPSCs后成牙本质标志基因DSPP、DMP1、BSP及ALP mRNA表达明显上调。以上结果提示,低浓度氯化锂可促进DPSCs成牙本质向分化。
间充质干细胞的分化是一个非常复杂的过程,涉及大量的信号通路、细胞因子和转录因子的调控。其中,Wnt和PI3K/Akt信号通路对干细胞分化过程的调控发挥着重要作用。在典型的Wnt通路中,β-catenin作为关键的转录辅激活因子,将细胞外信号传递到细胞核内,从而激活靶基因的表达[16]。如GSK-3β失活可导致β-catenin在细胞质大量聚集而转位至细胞核,从而作用于下游的靶基因如Runx2和过氧化物酶增殖物活化受体γ(peroxisome proliferator-activated receptorγ,PPARγ)基因,继而调控干细胞成骨或成脂向分化[16-18]。在间充质干细胞则主要通过抑制GSK-3β活化而激活β-catenin,最终促进成骨分化,抑制成脂向分化[19]。体内或体外实验发现,间充质干细胞内β-catenin失活导致成骨分化能力下降[20-21]。由此可见,β-catenin激活有利于间充质干细胞成骨向分化,本研究结果低浓度氯化锂促进DPSCs成牙本质向分化与大部分研究报道一致。Wnt信号在骨再生中的重要作用已经得到了很好的研究[22-23]。有研究发现,Wnt和PI3K/Akt信号转导通路可促进成骨细胞增殖,抑制破骨细胞分化[24-25]。也有报道指出,Wnt蛋白可通过激活Src/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和PI3K/Akt信号级联来延长成骨细胞和成骨祖细胞的存活时间[26]。然而,PI3K/Akt是否通过与Wnt/β-catenin通路的相互作用促进牙本质再生仍未知。本研究发现,PI3K/Akt信号通路抑制剂LY294002明显减弱了氯化锂诱导的DPSCs矿化结节形成和DSPP、DMP1、ALP矿化基因表达水平。由此可见,PI3K/Akt信号通路可能参与氯化锂诱导的DPSCs成牙本质向分化的调控。此外,本研究进一步发现氯化锂能够明显促进Akt的磷酸化,并具有时间依赖性,而LY294002可明显抑制氯化锂刺激导致的Akt磷酸化,证明PI3K/Akt信号通路确实参与调控氯化锂刺激的DPSCs成牙本质向分化过程。
综上所述,本研究发现低浓度氯化锂(1 mmol/L)可明显促进DPSCs成牙本质向分化,PI3K/Akt信号通路在此过程中可能发挥着重要调控作用。针对这些信号通路的研究将为龋源性感染的治疗提供新的靶点。氯化锂也可能用作具有生物活性的下一代活髓保存剂,但尚需进一步的研究。

