PIK/Akt/mTOR信号通路在肺腺癌不同EGFR突变状态中的临床相关研究与预测价值
摆惠芹, 加孜那·托哈依
(新疆医科大学第一附属医院呼吸与呼吸危重症中心, 乌鲁木齐 830054)
近年来,肺腺癌已成为全球范围内最为常见的肿瘤之一[1]。早期诊断和治疗手段的不断改进虽然取得了一定的成效,但仍然存在着一系列挑战,特别是在一些特定亚型肺腺癌的治疗方面。表皮生长因子受体(Epidermal growth factor receptor,EGFR)突变型肺腺癌是其中最为突出的亚型之一,其良好的治疗反应性使其成为靶向治疗的重点[2-4]。部分患者在接受EGFR抑制剂治疗后通常会出现耐药性,而EGFR点突变类型与酪氨酸激酶抑制剂(TKI)的药效密切相关,研究表明EGFR的T790M突变是一、二代EGF-TKI疗效下降的主要原因[5],然而,随着EGFR T790M抑制剂的用量不断增加,疗效下降的现象逐渐出现,研究表明其耐药机制复杂多样[6],这可能与PIK/Akt/mTOR信号通路的激活有关[7]。因此,研究人员正在积极开发联合治疗策略,包括抑制PIK/Akt/mTOR信号通路以克服治疗抵抗[8]。PIK/Akt/mTOR信号通路的异常活化与肿瘤的发生、发展和侵袭能力增强有关[9-10]。然而在EGFR突变型肺腺癌中,PIK/Akt/mTOR信号通路与EGFR基因突变之间的相互作用目前众多学者说法不一。本文旨在探讨PIK/Akt/mTOR信号通路与肺腺癌EGFR不同突变状态之间的相关性以及PIK/Akt/mTOR信号通路与肺腺癌患者临床病理特征的相关性。通过深入研究PIK/Akt/mTOR信号通路与EGFR突变型肺腺癌之间的关系将有助于更好地了解肺腺癌的发展机制以及开发更加精准和有效的治疗策略,为患者提供更好的临床治疗效果并且提高生存质量。
1 资料与方法
1.1 研究对象本研究为回顾性研究,收集2010-2019年在本院接受外科手术且经病理证实的肺腺癌患者的手术组织标本共342例,二代测序(NGS)法进行检测,根据EGFR有无突变分为阳性组与阴性组,其次将磷脂酰肌醇-4,5-双磷酸3-激酶催化亚基α(PIK3CA)、PIK3CB、磷脂酰肌醇3-激酶(PIK3CG)、丝氨酸/苏氨酸蛋白激酶(Akt)、雷帕霉素靶蛋白(mTOR)相关基因表达根据有无突变分为阳性组与阴性组,对其进行EGFR基因检测及PIK/Akt/mTOR相关信号通路相关基因检测。纳入标准:(1)患者知情同意,浏览已故患者的病例资料,需经伦理委员会批准(20190531-03);(2)外科手术标本病理诊断为肺腺癌,且由2名以上病理科医师复核,肺癌诊断及分期标准统一按最新指南;(3)既往未接受任何抗肿瘤治疗(包括手术、放疗、化疗、靶向药物治疗或其他抗肿瘤治疗等)的初治患者;(4)并由NGS基因检测法行EGFR基因检测及PIK/Akt/mTOR相关信号通路相关检测。排除标准:(1)曾患肺癌或其他恶性肿瘤;(2)重复治疗的患者,仅将第一次的就诊病例纳入;(3)缺乏完整临床信息的患者;(4)NGS方法行基因检测失败而未能检测出基因结果。
1.2 方法
1.2.1 样本 石蜡包埋手术切除的样本,使用轮转式切片机行切片处理,之后HE染色,由高年资病理学医师光学显微镜下观察选取肿瘤含量超过80%的癌组织蜡块标本。
1.2.2 制片 使用轮转式切片机进行石蜡样本切片,石蜡切片在40℃水浴缸上展平后,移到载玻片上,同时置入烤箱中烤干。
1.2.3 基因检测 标本均送至诺禾基因公司,由诺禾基因公司实施基因检测,检测流程如下:(1)使用QIAGEN FFPE提取试剂提取福尔马林固定石蜡包埋标本中DNA;(2)DNA电泳检测和定量:DNA质量的提取用1%琼脂糖凝胶电泳法,DNA的浓度检测使用Qubit,DNA总量应不少于150 ng;DNA降解程度≥C级;(3)酶切片段化DNA;(4)末端修复和加A尾后进行接头连接;(5)磁珠纯化连接产物;(6)文库扩增;(7)扩增产物纯化;(8)杂交捕获;(9)上机测序:选用Ⅰllumina测序策略为Paired-End 2X150bp的测序试剂和Nextseq500/50或NovaSeq测序仪,每个样品文库检测数据量不低于13 Gb。
1.2.4 质量控制 严格按照纳入标准及排除标准选择研究对象,收集的数据由2名以上的人员复查核对,统一检测标准及诊断标准。
1.3 统计学处理采用SPSS26.0软件包进行分析,计数资料用频数表示。当总数≥40同时理论频数>5采用χ2检验,当总数<40或理论频数<5采用Fisher精确概率法分析;采用Spearman秩相关分析各驱动基因突变状态关联性,P值均基于双向假设检验,P<0.05为差异有统计学意义。对于EGFR基因突变的影响因素使用多元Logistic回归分析。
2 结果
2.1 EGFR基因突变在肺腺癌患者不同临床病理特征中的分布EGFR阳性组与EGFR阴性组患者在年龄上的分布差异有统计学意义(P<0.05),60岁以下患者较60岁以上患者更易发生EGFR突变;肺腺癌患者不同组织分型及分化程度在EGFR阳性组与阴性组中的分布差异无统计学意义(P均>0.05),见表1。

表1 EGFR突变状态与肺腺癌患者临床病理特征的关系/例(%)
2.2 EGFR不同突变位点突变频率分布情况此次共检测出EGFR突变155例,突变频率为45.3%,其中19exon 60例(38.7%), 21exon 72例(46.5%),20exon 6例(3.9%),其他位点17例(10.9%)。
2.3 PIK/Akt/mTOR信号通路在342例肺腺癌中的分布情况在342例肺腺癌患者中,PIK3CA、PIK3CB、PIK3CG、Akt、mTOR突变分布状况如下,其中PIK3CG的突变比率最高,为49.4%,见表2。

表2 PIK/Akt/mTOR信号通路在342例肺腺癌中的分布情况/例
2.4 PIK/Akt/mTOR信号通路与肺腺癌患者EGFR不同突变状态表达的相关性PIK3CA、PIK3CG与EGFR不同突变状态下的表达具有相关性(P<0.05),即PIK3CA、PIK3CG表达阳性的患者EGFR突变频率更高,见表3。
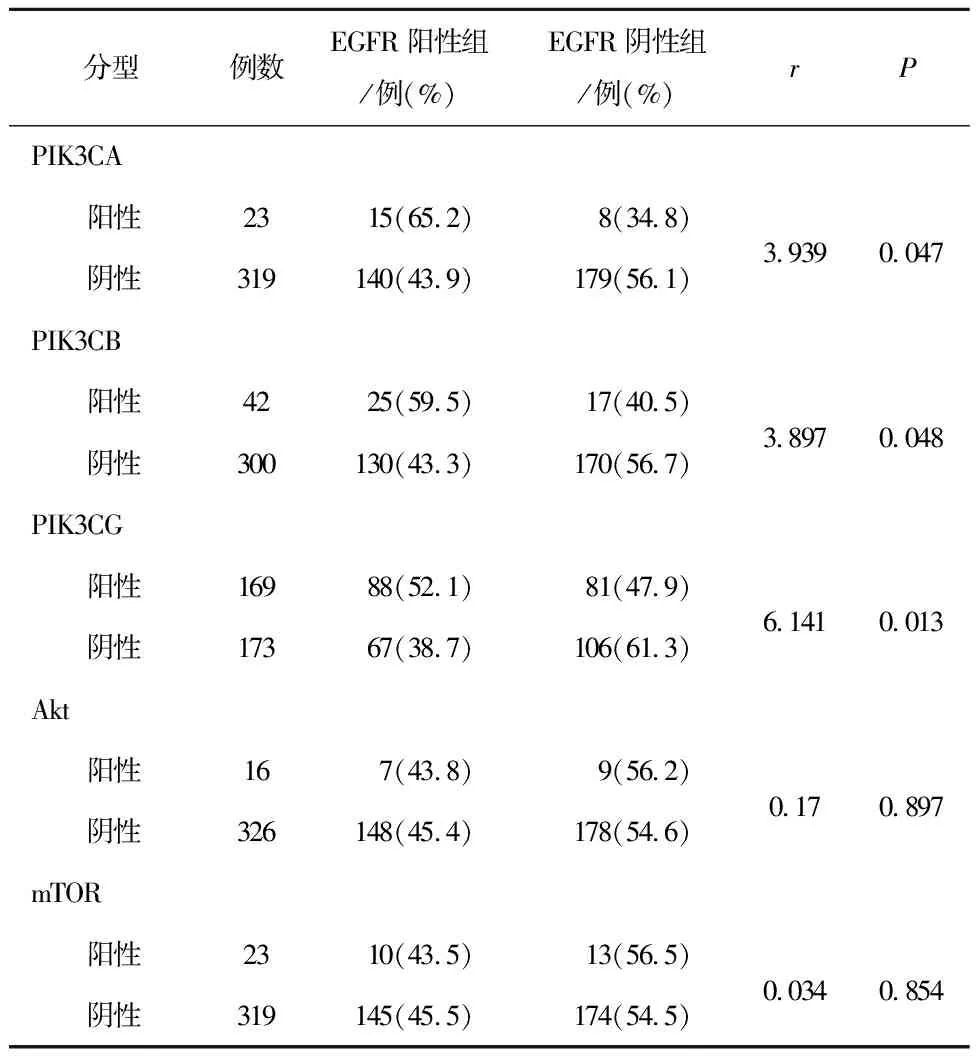
表3 PIK/Akt/mTOR信号通路与肺腺癌患者EGFR不同突变状态的相关性分析
2.5 PIK信号通路在肺腺癌患者EGFR不同突变位点表达的差异性EGFR突变中最常见的位点位于19exon及21exon,PIK3CA、PIK3CB和PIK3CG在肺腺癌患者EGFR不同突变位点的表达差异无统计学意义(P>0.05),见表4。

表4 PIK信号通路在EGFR不同突变位点中的差异性分析/例(%)
2.6 PIK信号通路与T790M不同突变状态表达的相关性PIK3CA表达与T790M突变状态具有相关性(P<0.05),说明PIK3CA表达阳性患者更易诱导T790M耐药突变,见表5。

表5 PIK信号通路与T790M不同突变状态表达的相关性
2.7 PIK/Akt/mTOR信号通路的表达与淋巴结转移的相关性PIK3CB和mTOR在有无淋巴结转移中的表达差异具有统计学意义(P<0.05),PIK3CB、mTOR表达阳性的患者更易发生淋巴结转移,见表6。

表6 PIK/Akt/mTOR信号通路的表达与淋巴结转移的相关性
2.8 EGFR突变预测因素的多因素分析以单因素分析中有差异指标以及目前相关研究中较多提示有意义的指标为自变量,患者EGFR突变状况为因变量,进行多元Logistic回归分析影响EGFR突变状态的影响因素。结果显示年龄(P=0.036,OR=3.680,95%CI:0.398~0.970)、 PIK3CA(P=0.042,OR=4.136, 95%CI:1.034~6.237)、PIK3CG(P=0.012、OR=6.366、95%CI:1.133~2.079)对EGFR突变阳性预测价值较好,年龄、PIK3CA、PIK3CG表达水平是预测EGFR突变的独立危险因素(P<0.05),见表7。

表7 EGFR突变预测因素的多元Logistic回归分析
3 讨论
有研究表明,近50%的亚洲晚期非小细胞肺癌(NSCLC)患者存在EGFR酪氨酸激酶结构域的体细胞激活突变[11]。本研究对342例肺腺癌患者进行二代基因检测,其中共有155例患者发生EGFR突变,突变频率为45.3%。此次研究的342例肺腺癌患者中,60岁以下患者较60岁以上患者更易发生EGFR突变,与相关研究中EGFR突变与年龄无相关性[12]结果不一致,考虑与检测方式的不同有关。有研究显示,EGFR突变率为50.84%,其中21外显子占26.02%,19外显子占20.24%,20外显子占2.17%,18外显子占0.24%,双突变占2.17%,外显子19和21占总突变的92.89%,为最主要的突变位点[13]。在本研究中,exon19号位点突变共有60例(38.7%)、exon21号位点突变共有72例(46.5%)、 exon20号位点突变共有6例(3.9%)。本次研究的342例肺腺癌患者中,PIK3CG突变共有169例(49.4%),PIK3CA突变共有23例(6.7%)。张欣[14]研究显示,PIK3CA占所有纳入肺癌患者的5.88%,在3.3%的肺腺癌患者中检测到PIK3CA突变。
PIK/Akt/mTOR是一条重要的细胞信号传导通路,它在调控细胞生长、增殖、代谢等多种生理过程中发挥着关键作用[15]。本研究结果显示,PIK3CA、PIK3CG阳性患者更易发生EGFR突变(P<0.05)。有研究表明,与其他单独的致癌基因相比,PIK3CA基因突变单独存在时致癌性较弱,通常是与其他致癌基因突变共同存在,其中最常见的是EGFR基因突变[16],这与本文论证观点一致。
多重耐药性(MDR)会阻碍化疗药物及靶向药物的疗效,通常导致肿瘤复发和转移。在耐药患者中,先天性和获得性耐药各占50%左右[17],T790M突变是EGFR最常见的先天性耐药机制[18]。本研究显示,PIK3CA表达阳性患者更易发生T790M耐药突变(P<0.05)。Edgar等[19]证实发生PIK3CA突变的细胞是由过度激活的PI3K/Akt/mTOR信号通路实现的,由此导致对PI3K抑制剂产生耐药性。同时也有研究表明,在接受奥希替尼治疗的患者中也发现PIK3CA的突变,PIK3CA突变可能导致肺癌患者对奥希替尼耐药[4],因此PIK3CA信号通路的突变可能会诱导肺癌患者对EGFR-TKI的耐药[20-21],但具体调控机制仍需进一步进行基础实验进行验证。
本研究结果显示,PIK3CB、mTOR表达阳性的患者更容易发生淋巴结转移(P<0.05),YANG等[22]和唐代[23]提出PIK3CB蛋白表达与淋巴结转移相关,与没有PIK3CB突变的患者相比,发生PIK3CB突变的患者总生存期(OS)时间更短[24]。研究表明,在NSCLC患者中,PIK3CB mRNA的高表达与肿瘤的恶性程度、不良预后相关[25]。也有研究表明mTOR活性的存在也可能是早期非小细胞肺癌的不良预后因素,免疫组织化学检测的mTOR表达增加与低生存率有关[26]。本研究结果显示,年龄、PIK3CA和PIK3CG对EGFR突变状态预测价值好,年龄是EGFR突变状态的危险因素。有研究发现,在肺癌中PIK3CA通常与EGFR突变同时发生,EGFR与PIK3CA同时发生突变的肺腺癌患者的无进展生存时间(PFS)比单个EGFR突变的患者短,PIK3CA突变因此被确定为PFS差和OS较短的预后因素[27]。在Wu等[28]的一项研究中,PIK3CG突变被认为是肺腺癌患者有利的预后因素。存在的局限性和不足:本研究是回顾性研究,存在信息收集的选择性偏倚;由于缺乏对EGFR突变肺腺癌患者后期治疗和复查随访数据,本研究无法对EGFR及PIK基因与预后相关的评估进行具体研究。

