IGFBP7与弥漫大B细胞淋巴瘤临床病理特征及预后的相关性
闫慧芳, 高鸿亮, 张 冉, 郭雅雯, 张小贤, 武璐瑶, 李新霞
(1新疆医科大学附属肿瘤医院病理科, 乌鲁木齐 830011; 2新疆医科大学第一附属医院消化病二科, 乌鲁木齐 830054)
弥漫大B细胞淋巴瘤(Diffuse Large B Cell Lymphoma,DLBCL)在成人非霍奇金淋巴瘤中最常见,该肿瘤具有中-高度侵袭性,生长迅速,在临床表现、组织形态、免疫表型、遗传学特征、疗效和预后等方面具有很大异质性[1-2]。尽管利妥昔单抗+环磷酰胺+多柔比星+长春新碱+泼尼松(Rituximab-Cyclophosphamide+Doxorubicin+Vincristine+Prednisolone,R-CHOP)方案可显著改善大多数患者预后,但仍有高达40%患者在初始治疗后短期内转变为复发/难治型,成为目前临床实践中亟待解决的难点之一[3-4]。
胰岛素样生长因子结合蛋白7(IGFBP7)是胰岛素样生长因子轴的一部分,在细胞增殖、分化、凋亡中起重要作用。IGFBP7与肝癌、结肠癌、胃癌、恶性胶质瘤等癌细胞增殖、血管形成、癌细胞迁移关系密切[5-8]。Zhao等[9]报道,IGFBP7在胃癌中的表达水平与疾病的分期、分级、肿瘤状态、免疫细胞浸润等临床特征有关。
随着研究的深入,IGFBP7正逐渐成为多种肿瘤预测的生物标志物。本研究分析了IGFBP7在DLBCL中的表达,及其与临床病理特征之间的关系,旨在为DLBCL患者的治疗提供新参考。
1 资料和方法
1.1 临床资料收集2016年1月至2023年3月新疆医科大学附属肿瘤医院病理科诊断为DLBCL的165例患者的病历资料,按照2022年第5版WHO淋巴造血组织肿瘤分类标准[10],由两位经验丰富的高年资病理医师阅片复核诊断。通过电子病历收集患者的临床和病理资料,并进行电话随访,包括患者性别、年龄、Ann Arbor分期、乳酸脱氢酶(LDH)水平(120~250 U/L为正常组,≥250 U/L为升高组)、国际预后指数(IPI)评分、体力状态评分(ECOG)、累及部位、B症状、β2微球蛋白水平(正常范围为0.8~2.2 g/L)、外周血淋巴细胞计数(正常范围为1.1~3.2×109/L,<1.1×109/L为降低)、外周血中性粒细胞计数(正常范围为1.8~6.3×109/L,>6.3×109/L为升高)、外周血单核细胞计数 (正常范围为0.1~0.6×109/L,>0.6×109/L为升高)、Ki67阳性指数,以上临床特征的选择参考文献[11]。本研究通过新疆医科大学附属肿瘤医院伦理委员会审核批准(G-2023007)。
1.2 免疫组织化学染色方法使用经正规固定的石蜡包埋组织切片,采用En Vision二步法染色,一抗购自美国Abcam公司:IGFBP7、克隆号EPR11912(B)。
1.3 判读标准IGFBP7染色定位于肿瘤细胞胞质,根据阳性细胞数和着色强度进行评分:(1)按阳性细胞百分比进行评分:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;(2)按细胞着色程度进行评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分,将以上两项分值相乘得出最后评分:0分为(-),1~3分为(+),4~6分为(++),7~9分为(+++),10~12分为(++++),其中++~++++为IGFBP7高表达。对于结果的判读方法参考文献[12],将165例患者按IGFBP7阳性程度分为高表达组、低表达组。
1.4 统计学分析应用SPSS26.0软件进行统计学分析;采用χ2分析IGFBP7表达与各临床病理特征之间的关系;用Kaplan-Meier进行患者生存曲线的绘制;Cox比例风险回归模型进行独立预后危险因素分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 免疫组织化学染色结果IGFBP7高表达患者86例(52.1%),低表达者79例(47.9%)。IGFBP7在DLBCL中的表达及阳性程度见图1。
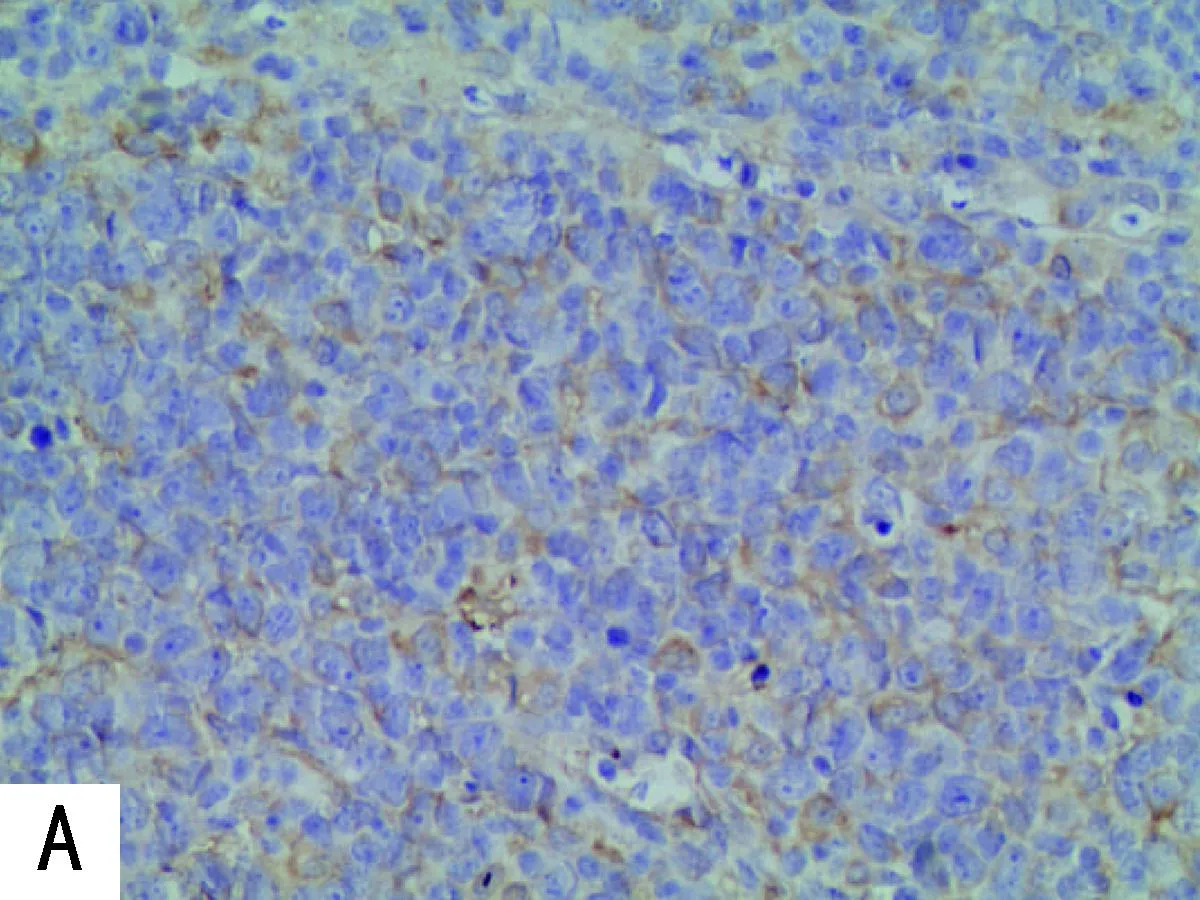
注:A,IGFBP7低表达;B,IGFBP7高表达;C,Ki67表达<70%;D,Ki67表达≥70%。
2.2 IGFBP7表达水平与临床病理特征的相关性DLBCL患者中年龄≥60岁者IGFBP7高表达率为59.1%,远高于<60岁者(43.1%),单核细胞计数升高的患者高表达率(66.0%)高于计数正常者(41.6%),差异均具有统计学意义(P<0.05)。此外,IGFBP表达水平与患者性别、Ann Arbor分期、LDH水平、IPI评分、ECOG评分、累及部位、免疫分型、B症状、β2微球蛋白、淋巴细胞、中性粒细胞均无明显相关性(P>0.05)。见表1。

表1 165例DLBCL患者中IGFBP7表达与临床病理特征的关系/例(%)
2.3 预后因素分析结果165例DLBCL患者中,107例生存,58例死亡。单因素结果显示,年龄≥60岁、Ann Arbor分期Ⅲ~Ⅳ期、LDH水平升高、IPI评分>3分、ECOG评分≥2分、累及部位为淋巴结内、有B症状、β2微球蛋白≥2.2 mg/L及IGFBP7高表达的DLBCL患者生存率较低,差异具有统计学意义(P<0.05);而患者性别、免疫分型、Ki67阳性指数对DLBCL患者生存时间的影响无统计学意义(P>0.05)。将上述有统计学意义的因素纳入Cox回归分析,结果显示患者年龄≥60岁、LDH水平升高、累及部位为淋巴结内、外周血淋巴细胞计数升高和IGFBP7高表达是影响DLBCL患者生存的独立危险因素(P<0.05)(见表2)。年龄≥60岁患者生存期短于<60岁患者,LDH水平升高的患者生存期短于LDH水平正常的患者,累及部位为结内的患者生存期短于结外患者,外周血淋巴细胞计数降低的患者生存期短于计数正常患者,IGFBP7高表达的患者生存期短于低表达患者。见图2。
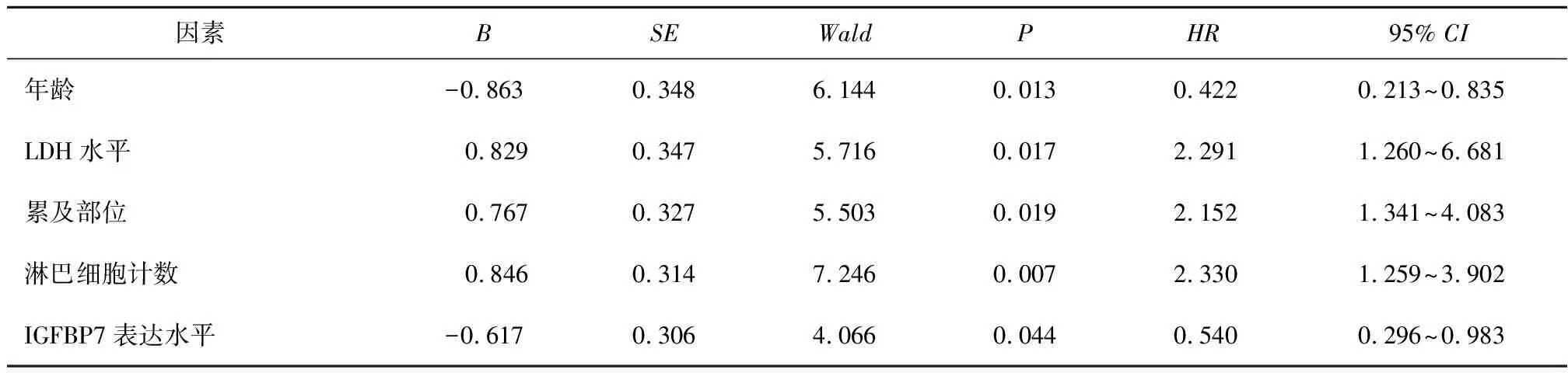
表2 多因素Cox回归分析
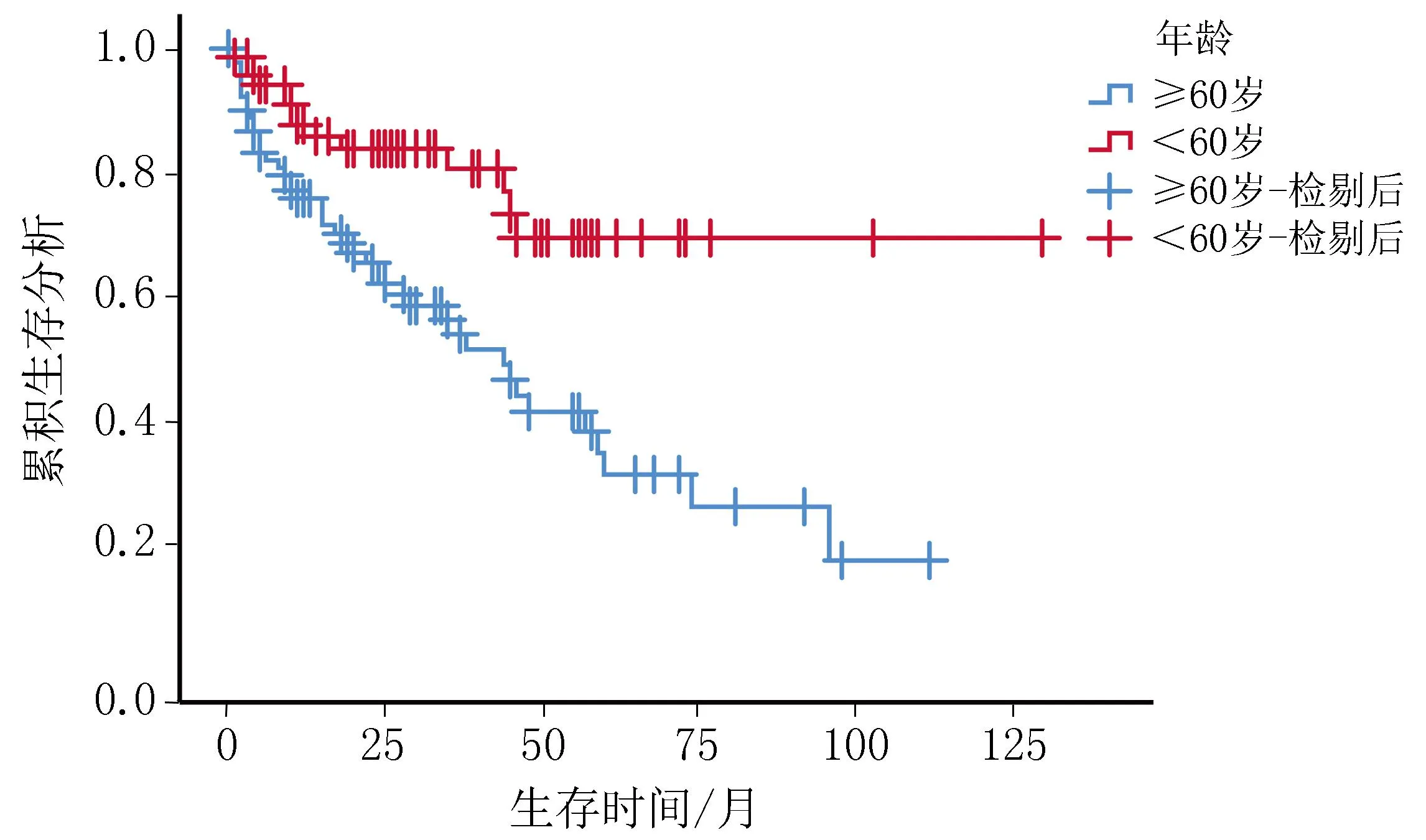
图2 DLBCL生存曲线图
3 讨论
DLBCL是一种异质性很强的疾病,在临床特征、基因表型、对治疗方案的反应性等方面具有很强的差异,影响DLBCL患者预后的因素很多[13]。本研究结果显示,患者年龄、LDH水平、累及部位、外周血淋巴细胞计数和IGFBP7表达水平均是影响患者生存时间的独立危险因素。
Zhang等[14]报道,IGFBP7通过调节AKT活性和细胞周期进展抑制甲状腺癌。Chen等[15]报道IGFBP7是AKT3/mTOR信号转导的上游分子。IGFBP7可能是肿瘤生物学调控过程中的重要分子之一。De Visser等[16]研究发现,IGFBP7通过与CD93结合参与破坏肿瘤血管生成并增强免疫浸润,进而增强CD93单克隆抗体的免疫治疗效果。此外,IGFBP7的表达与巨噬细胞的浸润程度和功能有关,Li等[17]研究证实了IGFBP7可通过FGF2/FGFR1/PI3K/AKT轴促进M2/TAM巨噬细胞的浸润,提示IGFBP7可能是调控肿瘤免疫微环境的重要分子,有可能成为未来免疫治疗的靶点。
Artico等[18]研究表明,IGFBP7与急性淋巴细胞白血病的生物学和临床预后因素有关,参与细胞粘附及维甲酸和皮质醇的代谢,能调节细胞生长,并与白细胞计数有显著相关性。本研究发现,IGFBP7表达水平与外周血单核细胞计数存在相关性,可能参与DLBCL肿瘤生长过程。有研究证明,IGFBP7在胰腺癌、结肠癌、卵巢癌等癌中低表达,被称为抑癌基因[19-21]。Sato等[22]报道IGFBP7高表达与胃癌临床分期及淋巴结转移等临床病理特征相关,且与低存活率相关,可为胃癌预后评估提供一定的依据。但本研究结果显示,IGFBP7表达水平与患者年龄相关,与Ann Arbor分期尚未发现相关性,IGFBP7高表达的患者存活率较低,与DLBCL不良预后有关且为独立危险因素。Carreras等[23]研究发现,IGFBP7影响套细胞淋巴瘤细胞的功能,其高表达与MKi67表达水平相关。本研究结果显示,IGFBP7表达水平与Ki67阳性表达情况有相关性,这与上述研究结果一致。综上所述,IGFBP7可能是DLBCL预后相关的标志物,或可成为临床新的治疗靶点。
本研究存在以下不足之处:(1)此研究是对单中心的临床样本进行验证,样本量较小,研究结果可能有待进一步验证。(2)未详细分析IGFBP7参与DLBCL具体作用机制。以上也将是本课题组今后进一步研究的重点内容。

