高原环境对兔泪液指标及相关解剖结构的影响
钱金梅,胡 彬,张飞娥,杨 奇,朱雯雪,张佳玲,蔡 岩
0引言
干眼(dry eye disease,DED)指泪液分泌异常或者泪膜稳定性下降并伴随组织受损和神经系统功能的变化,从而引起各种眼部不适症状和(或)视功能障碍的眼表疾病[1],严重影响人们的生活质量。我国干眼患病率不同地区差异较大[2],西部地区患病率31.3%,高于其他地区。其中属于高原山地性气候的西藏自治区和青海省玉树县的干眼患病率更是高达52.4%和59.1%。随着高原地区经济和国防的不断发展,越来越多的人由于旅游、经商或驻守等从平原地区进入高原地区,使得对高原环境下干眼分类及防治方法的探讨有着较为重要的意义。
泪液含有多种分子成分,在异常条件下它们的相对浓度可能会发生变化,因此,对泪液成分进行分析可以非侵入地获得有关眼睛健康状况的重要信息。随着仪器和数据处理方法的进步,将各种成分分离方法与高灵敏度的光学技术相结合使泪液成分分析成为可能[3]。拉曼光谱(Raman spectroscopy)技术具有无损、快速、能原位获得“分子指纹”信息等优点,而且检测所需的物质量少,能够很好地对泪液中的分子物质进行检测分析,因此泪液的拉曼光谱信息成为目前研究的热点[4-5]。本研究依托新疆军区总医院西北特殊环境人工实验舱模拟高原环境,旨在探索6 000 m海拔留置不同时长后,泪液相关指标如泪液分泌量、泪河高度(tear meniscus height,TMH)、首次非接触泪膜破裂时间(first non-invasive tear break-up time,NIBUT-first)、平均非接触泪膜破裂时间(average non-invasive tear break-up time,NIBUT-average)及相关组织病理学改变等,并采用拉曼光谱对高原环境干预前后的泪液成分变化进行分析,探讨高原环境所致干眼可能的类型,为临床有针对性地防治高原环境下干眼提供理论依据。
1材料和方法
1.1材料
1.1.1实验动物及分组标准实验用清洁级健康成年新西兰兔18只,体质量2-2.5 kg,均由新疆医科大学动物实验中心提供,按标准动物饲养条件饲养。经裂隙灯显微镜检查排除眼表疾病,适应性饲养7 d后进行实验。本研究通过新疆军区总医院动物伦理委员会正式审查和批准(审批号:DWLL20230410),保证动物福利。
采用随机数字表法将新西兰兔分为高原组和对照组,每组9只,两组雌雄数均等(5雄4雌)。高原组饲养于新疆军区总医院西北特殊环境人工实验舱,以降低舱内气压的方式将模拟舱以5 m/s的上升速率升至海拨6 000 m,放置充足的饲料及清洁饮水供其自由摄取,每天中午12点将模拟舱高度降至当地海拔,进行各项检查并加食、添水及清理卫生,下午1点再将舱内高度升至6 000 m。对照组饲养于舱外清洁动物实验室,其他饲养条件与高原组相同,并与高原组同时段进行各项检查。
1.1.2主要耗材和仪器及试剂泪液分泌检测滤纸(天津晶明)、无菌玻璃毛细管(Kimble),小鼠抗兔黏蛋白5AC(mucin 5AC,MUC5AC)抗体(Thermo)、免疫组织化学染色试剂盒(Elabscience),RHCT-1角膜地形图仪(安达斯)、共聚焦拉曼光谱仪(LabRAM HR Evolution,Gora Raman spectroscopy,ideal optics,China)。10%甲醛溶液、石蜡、二甲苯、乙醇、苏木素、伊红等病理切片用试剂均由本院动物实验科提供。
1.2方法为减少各种操作对检查结果的影响,先用RHCT-1角膜地形图仪干眼综合分析系统进行双眼NIBUT-first、NIBUT-average及TMH检测,然后采集双眼泪液以备后续拉曼光谱分析,最后进行无表面麻醉泪液分泌(Schirmer Ⅰ)试验。
1.2.1泪液指标检测分别于干预前、干预3、7 d,2、4 wk在同时间段、地点、环境下由两名经验丰富的医师完成NIBUT-first、NIBUT-average、TMH检测及Schirmer Ⅰ试验。(1)采用RHCT-1角膜地形图仪干眼综合分析系统评估NIBUT-first、NIBUT-average及TMH,辅助兔完全瞬目后保持固定不动进行双眼非侵入性泪膜破裂时间检测,系统自动识别并记录NIBUT-first和NIBUT-average,观察40 s;再使用内置的红外线照相功能对双眼泪河图像进行拍摄,并用系统内置的测量工具对瞳孔中央正下方的TMH进行测量。重复测量3次取平均值,连续测量之间的时间间隔至少为60 s。(2)采用Schirmer Ⅰ试验评估泪液分泌量,兔固定后将无菌泪液分泌检测试纸条头端弯折后从包装袋内取出,在无表面麻醉的情况下置于兔双眼下结膜囊中外1/3处,静置5 min后取出试纸条,记录试纸条浸润的长度即为泪液分泌量。
1.2.2拉曼光谱分析
1.2.2.1样本采集和参数设定分别于干预前、干预4 wk,将高原组兔固定后,在无眼表面麻醉情况下,采用无菌玻璃毛细管以虹吸方法在兔下睑结膜囊处收集双眼非刺激性泪液。由于可采集泪液量较少,故将双眼泪液置于同一玻璃管中进行后续实验。采用共聚焦拉曼光谱仪在500-2 500/cm范围内测量,半导体激光器激发波长为785 nm,激光功率为160 mW。采用labspec6软件进行光谱采集和分析,使用10倍物镜采集每个光谱数据。每个泪液样本在不同位置记录3次,并获取每个泪液样本的平均拉曼光谱用于后续研究。
1.2.2.2光谱预处理通常实际采集的拉曼光谱数据成分复杂,除了基本的特征变量之外,还有背景基线、噪声等信号,通过分析实际拉曼光谱分析技术发现,检测对象拉曼光谱数据的主要成分来源于采集环境和设备所导致的基线,所以在分析建模之前,需要将背景基线滤除,才能从获得纯光谱数据中选择出分析对象对应的特征数据。本研究使用目前使用最广的基线校正方法——迭代自适应加权惩罚最小二乘法(adaptive iteratively reweighted penalized least squares,airPLS)对数据进行基线校正。此外,本研究还对数据进行了SG(Savitzky-Golay)滤波算法和归一化处理。原始的泪液拉曼光谱含有噪声,SG滤波算法对数据进行平滑和去噪,可有效滤除高频噪声。对光谱数据进行归一化处理则可以处理不同样品的浓度、温度、压力等因素对光谱数据强度值的影响。
1.2.3组织病理学检查于干预4 wk上述检测及泪液收集完毕后,采用戊巴比妥钠沿耳缘静脉过量注射处死两组兔,在实验台上进行常规无菌操作,摘除两组兔右眼泪腺、哈氏腺、角膜、下睑结膜,用生理盐水洗净残留血液后,立即置于10%甲醛溶液中固定,经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片后进行苏木素-伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察,采集图像信息,分析组织病理学变化。
1.2.4MUC5AC在结膜组织中的表达采用免疫组织化学法检测MUC5AC在结膜组织中的表达。将1.2.3获取的结膜组织制备的石蜡切片烘烤后经二甲苯脱蜡、梯度乙醇水化、抗原修复后按照试剂盒说明进行灭活、封闭、孵育及显色。显微镜下观察及时终止显色。经苏木素复染、盐酸乙醇分化后梯度乙醇脱水、二甲苯透明、中性树胶封片。角膜标本作为阴性对照,胃标本作为阳性对照。显微镜下观察结膜组织细胞内MUC5AC的表达,每张切片随机拍摄高倍镜(40×10)下5个不重叠视野照片,以细胞质内棕黄色或深褐色颗粒者为阳性细胞,应用Image J图像分析软件测量每张免疫组织化学图像平均光密度(average optical density, AOD)值,对MUC5AC的表达水平进行定量分析。
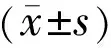
2结果
2.1一般资料对照组和高原组兔性别构成相同。适应性饲养7 d后,对照组兔体质量为2146.44±134.16 g,高原组兔体质量为2209.11±128.16 g,差异无统计学意义(t=1.013,P>0.05)。
2.2泪液指标干预前,两组兔NIBUT-first、NIBUT-average、TMH及泪液分泌量差异均无统计学意义(P>0.05)。

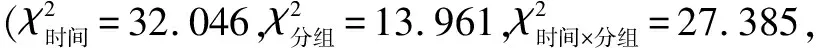
2.2.3泪液分泌量两组兔不同时间泪液分泌量比较,具有时间差异性、组间差异性和交互效应(F时间=6.129,F分组=23.000,F时间×分组=8.516,均P<0.001),见表3。高原组兔干预3、7 d泪液分泌量均较干预前降低,差异均有统计学意义(P<0.05),但干预3、7 d泪液分泌量差异无统计学意义(P>0.05);干预2 wk泪液分泌量有所增加,且与干预3、7 d泪液分泌量差异均有统计学意义(P<0.05);干预4 wk泪液分泌量继续增加,但与干预前及干预2 wk泪液分泌量差异均无统计学意义(P>0.05)。对照组兔不同时间泪液分泌量差异均无统计学意义(P>0.05)。干预3、7 d,2 wk高原组兔泪液分泌量均低于对照组,差异均有统计学意义(P<0.05);干预4 wk两组兔泪液分泌量差异无统计学意义(P>0.05)。
2.3拉曼光谱数据分析干预前、干预4 wk高原组兔泪液光谱表现出相同的峰位置,并显示出相似的光谱图,见图1。然而,两者在某些特定位置存在明显的峰值差异,这些峰值差异是由与样本相对应的生物分子的成分和含量的变化引起的,如干预前、干预4 wk高原组兔泪液样本光谱在777、856、1 195、1 244、1 373、1 857、1 921/cm处存在较为显著差异,通过查找各峰值对应的化学结构或物质,发现磷脂肌醇、脯氨酸、谷氨酸、磷酸盐、酰胺Ⅲ、脂质等较干预前高,碱基含量较干预前低,这与高原环境引起的机体生化和代谢反应有关。
2.4组织病理学检查HE染色结果显示,与对照组相比,高原组兔结膜上皮细胞排列紊乱且层数减少,杯状细胞增多,上皮下组织中毛细血管扩张充血、纤维细胞增生;角膜上皮细胞层厚薄不一,且部分区域细胞脱落,基质层肿胀伴空泡状改变,浅层可见新生血管;泪腺上皮细胞轻度增生,部分腺泡上皮细胞核浓缩,部分结构不清,间质少量毛细血管扩张充血,细胞胞浆萎缩扁平;哈氏腺腺体结构不均一,少量毛细血管轻度扩张充血,见图2。
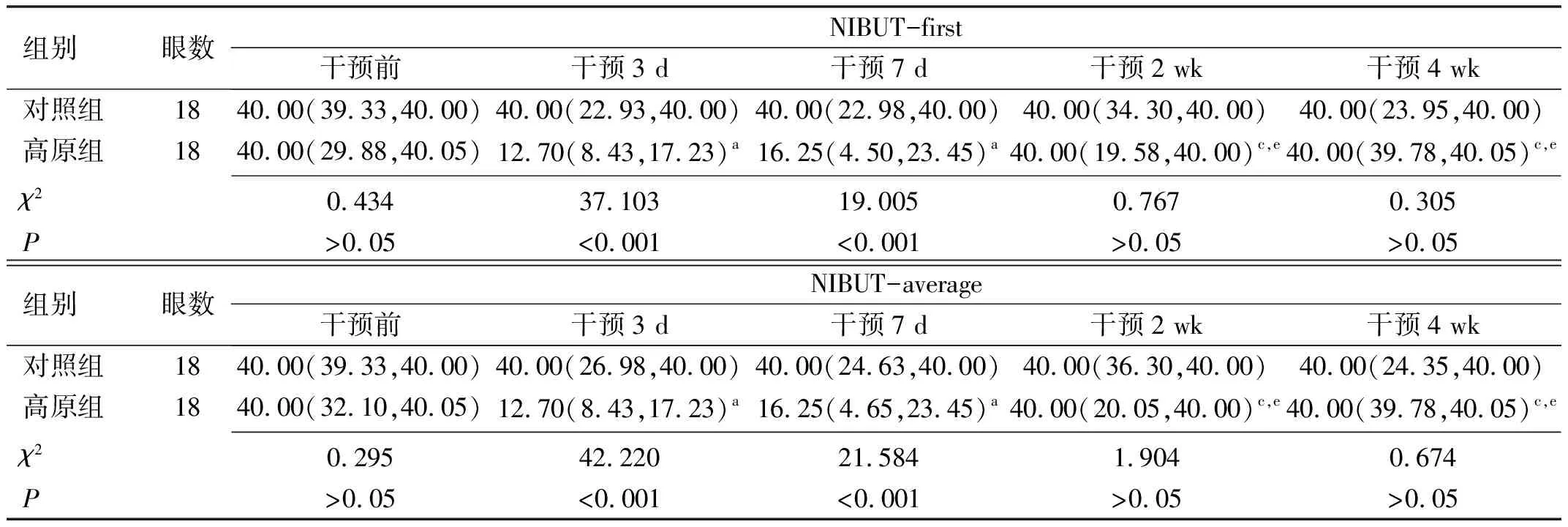
表1 两组兔不同时间NIBUT-first和NIBUT-average比较 [M(P25,P75),s]
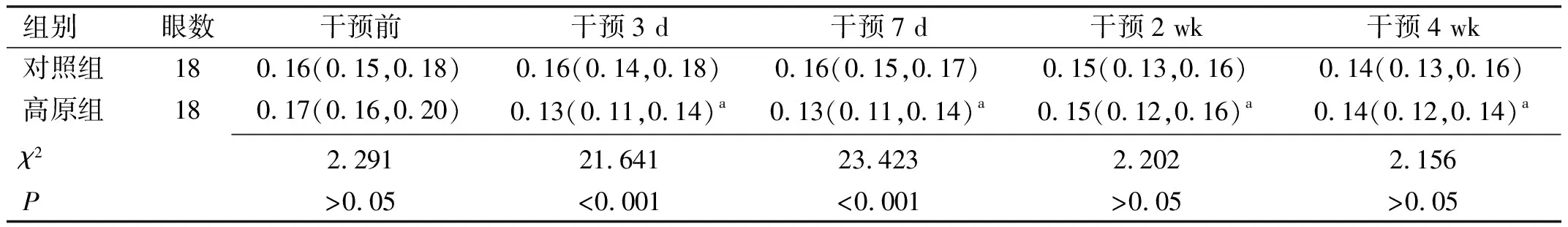
表2 两组兔不同时间TMH比较 [M(P25,P75),mm]
表3 两组兔不同时间泪液分泌量比较
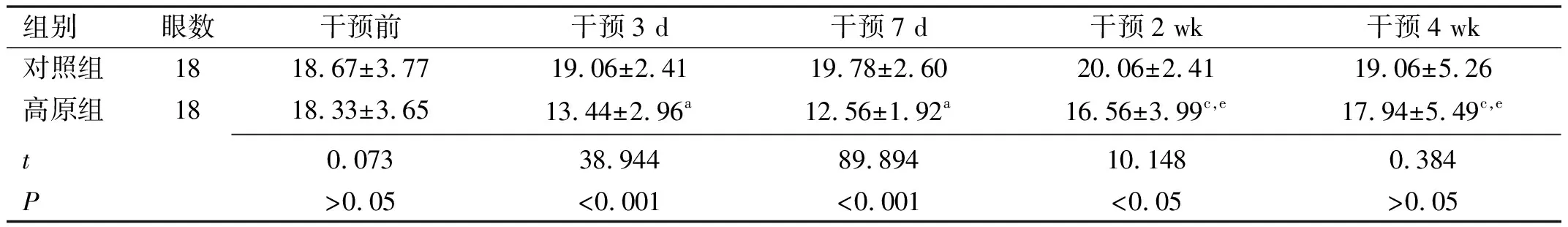
表3 两组兔不同时间泪液分泌量比较
组别眼数干预前干预3 d干预7 d干预2 wk干预4 wk对照组1818.67±3.7719.06±2.4119.78±2.6020.06±2.4119.06±5.26高原组1818.33±3.6513.44±2.96a12.56±1.92a16.56±3.99c,e17.94±5.49c,e t0.07338.94489.89410.1480.384P>0.05<0.001<0.001<0.05>0.05
注:aP<0.05 vs 同组干预前;cP<0.05 vs 同组干预3 d;eP<0.05 vs 同组干预7 d。
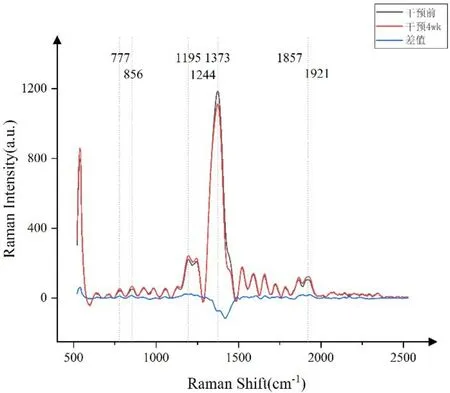
图1 干预前后泪液平均归一化拉曼光谱图。
2.5MUC5AC在结膜组织中的表达免疫组织化学染色结果显示,对照组兔结膜上皮内散在MUC5AC染色阳性细胞,形态饱满,染色浓密(图3A);高原组兔结膜上皮内MUC5AC染色阳性细胞明显增多,染色更强(图3B),且与对照组相比,高原组兔结膜组织中MUC5AC表达显著增加,差异有统计学意义(Z=-2.914,P<0.01,图3C)。
3讨论
泪液主要分布于眼表的两个部位,即穹窿部和眼睑后方、泪河和泪膜[6]。眼表前泪膜主要分为3层,表面为脂质层,中间为水液层,近角膜面为黏蛋白层。生理状态下泪膜可以维持眼表微环境的稳定并起到润滑角膜的作用,从而维持屈光功能。根据泪液的主要变化成分不同及动力学因素,2020年《中国干眼专家共识》将干眼分为水液缺乏型、脂质异常型、黏蛋白异常型、泪液动力学异常型及混合型5种[7],任何泪膜组成成分定量或定性的缺乏或改变均可能导致干眼,包括但不限于泪腺损伤、炎症、感染、系统性自身免疫性疾病和环境因素[8]。高原环境具有氧分压低、紫外线强、气候寒冷、风速高、湿度低等特点。陈晓敏等[9]通过建立可控干燥系统模拟低湿度环境,建立了水液缺乏型干眼模型。耿玉倩等[10]调查发现除了低湿度外,无论温度过高还是过低的环境均容易增加泪液蒸发,导致脂质异常型干眼的发生发展。但考虑到实际上无论是高原久居还是去高原旅游,人们的防护意识越来越强,护目镜的普及减弱了高原地区紫外线辐射、高风速、低湿度的影响,故本研究仅探讨高原低压缺氧条件的影响。
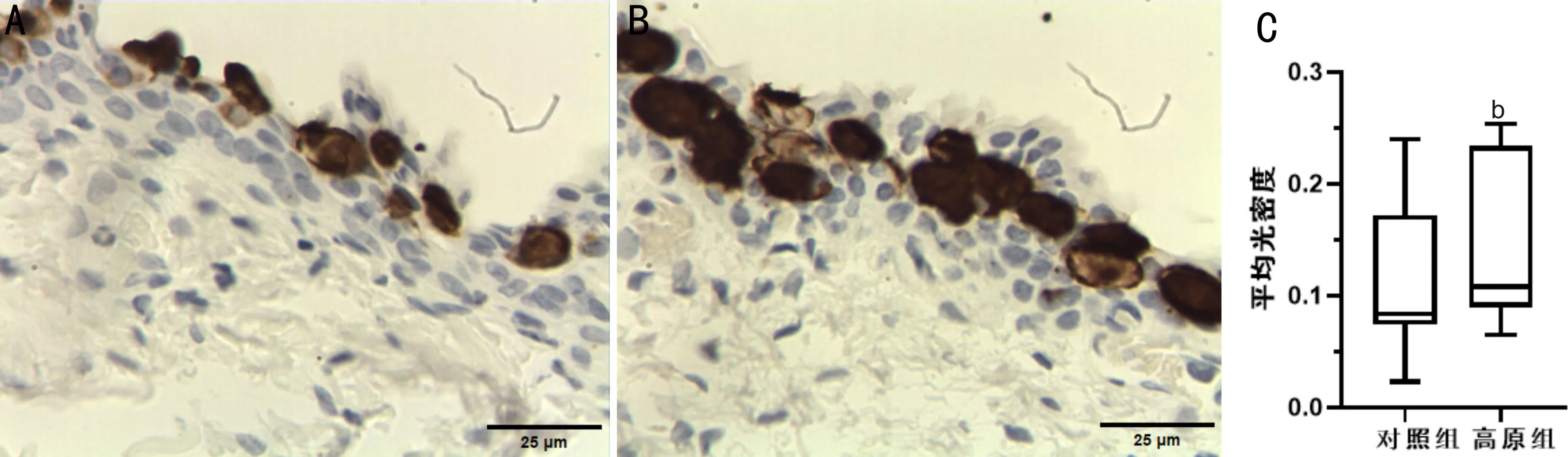
图3 免疫组织化学染色结果 A:对照组;B:高原组;C:免疫组织化学染色平均光密度比较,bP<0.01 vs 对照组。
泪膜脂质层主要由睑板腺产生,防止或减少泪液蒸发,并通过降低表面张力稳定泪膜,故睑板腺功能障碍将引起脂质层异常和泪膜不稳定,导致脂质异常型干眼。本研究结果表明,高原环境暴露3、7 d,NIBUT-first和NIBUT-average均显著降低,这与Willmann等[11]研究发现健康受试者在高海拔(4 559 m)环境暴露第1、2、4 d泪膜破裂时间显著减少的研究结果一致,说明急性高原环境暴露会破坏泪膜的稳定性,可能与脂质异常导致蒸发过强有关。但也有相关研究表明,与平原地区(284 m)相比,高原地区(3 700 m)长期居住者睑板腺缺失程度更严重,却反应性地分泌更多脂质[12]。此外,兔眼具有特殊的解剖结构——哈氏腺,现有研究表明兔哈氏腺和泪液中的脂质不同于人睑板腺和泪液中的脂质[13],这些独特的兔脂质可能对脂质异常型干眼具有保护作用,润滑眼表稳定泪膜,使其泪膜稳定性更高[14]。因此,本研究发现高原环境暴露4 wk对兔哈氏腺影响并不显著,这可能是2、4 wk时NIBUT-first和NIBUT-average逐步恢复的原因。
泪膜水液层主要由泪腺分泌,可以起到保护、冲洗、润湿角膜和结膜的作用。本研究发现,暴露在模拟6 000 m高海拔环境下的新西兰兔,3、7 d泪液分泌量和TMH显著降低。早期对长期居住在高原地区(3 700 m)的藏族居民的调查研究也显示其基础泪液分泌量明显低于内地居民[15]。马建洲等[16]研究发现正常中青年人在高原地区(4 300 m)居住1 mo后与前往高原前相比,泪液分泌量显著增多。这也与本研究观察到2、4 wk高原组兔泪液分泌量有所增加相符,但仍低于对照组,提示可能为适应性增加。然而,由于高原低压缺氧环境增加了泪液成分的蒸发,故虽然泪膜稳定性较高,但仍不能抵消水液蒸发的程度,因此在2、4 wk时,虽然高原组泪膜稳定性提高,NIBUT-first和NIBUT-average延长,甚至与对照组相比无显著差异,但TMH仍较低,这与Li等[12]研究结果相似。实验动物模型发现兔泪腺摘除后将导致水液缺乏型干眼[17],提示泪腺对于维持泪液分泌量具有关键作用。本研究发现,与对照组相比,高原环境暴露4 wk部分新西兰兔泪腺充血较重,泪腺上皮细胞萎缩,腺体结构破坏,腺泡黏液物质减少,将导致泪液的质和量改变及泪膜稳定性降低。
角结膜上皮细胞的正常结构和功能是维持眼表健康的关键。水液中含有的氧和葡萄糖可供角膜新陈代谢。有证据表明,干眼将导致角膜上皮细胞凋亡增加及上皮脱落和更新增加,破坏正常眼表环境稳态[18]。本研究发现,高原组兔角膜上皮细胞层数减少,基质肿胀,周边部基质层新生血管形成,可能由于高原低压缺氧环境限制了角膜与氧气的接触,导致显著的局部角膜缺氧引起的代偿增生[19]。与本研究类似,Willmann等[20]同样发现14名健康成年人在急进到高海拔地区(4 559 m)4 d内,泪膜层和角膜上皮厚度显著减少,而角膜内皮和角膜基质厚度显著增加。故高原低压缺氧使角膜解剖结构改变,破坏其生理作用,使眼表稳定性下降,导致干眼的发生。
眼表黏蛋白的表达水平及其在泪膜中的分布对维持泪膜的稳定和眼表上皮细胞的正常生理功能至关重要[21]。其中,分泌型胶样黏蛋白MUC5AC是最主要的,主要由结膜杯状细胞分泌入泪液,能通过连接水分子并形成胶从而起到保持水分、维持泪膜稳定等作用。与既往研究[22]一致,本研究进行免疫组织化学染色发现MUC5AC在兔结膜杯状细胞中均质表达,表明高原环境暴露4 wk结膜杯状细胞增多,且MUC5AC表达水平较对照组高,泪膜稳定性同样恢复。另有研究表明,在急性手术应激后1 mo时MUC5AC水平增加[23],但与急性干眼状态相关的眼部炎症自发消退,提示MUC5AC的过度表达可能有助于眼表稳态的代偿性恢复。据报道,在慢性干眼条件下,杯状细胞数量和MUC5AC含量也减少[24-25]。由此推测,杯状细胞增多及MUC5AC表达增加可能是由于短期内维持眼表稳态的破坏对黏蛋白需求增加而适应性地增加,但具体机制仍需进一步研究。
拉曼光谱是一种基于分子振动对光的非弹性散射的光学技术,可以提供血清、组织或体液的“分子指纹”,进而可用于以非侵入性、无标记的方式检测内源性大分子、代谢物、细胞外基质、细胞类型等,具有很高的特异性[3]。角膜前泪膜是具有不同结构和功能的蛋白质、脂质、代谢物和电解质的复杂混合物。有研究者利用滴涂沉积拉曼光谱、表面增强拉曼光谱[4]分析泪液,从而提供了完整的人体泪液的溶菌酶、乳铁蛋白、白蛋白等蛋白质信息。眼泪中的蛋白质在抗菌防御和炎症反应的调节中起着重要作用,本研究利用拉曼光谱分析高原组干预前和干预4 wk泪液成分的变化,发现干预4 wk与干预前泪液样本拉曼光谱存在差异的多数区域峰值强度高于干预前,对应的蛋白质、脂质等产物成分含量增多,也与干预4 wk免疫组织化学染色及泪液指标所提示结果相一致。对应的峰值强度低于干预前代表核酸含量减少,可能是由蛋白水解、氧化分解代谢和糖异生的失调引起。
高原环境条件复杂,单一或混杂因素均可造成眼部不适症状,但就本研究结果而言,低压缺氧所导致的干眼仍倾向于脂质异常与水液缺乏共同作用的结果,提示在防治高原环境下干眼时可适当应用护目镜或湿房镜并综合选用人工泪液、局部促进泪液分泌剂、局部糖皮质激素或免疫抑制剂,在出现严重角膜上皮病变时可以联合自体血清进行治疗[26]。
综上所述,本研究通过模拟高原环境探讨低压缺氧对新西兰兔泪液指标及相关解剖结构的影响,证实急性(3-7 d内)低压缺氧引起泪液蒸发增加或破坏泪液分泌而直接或间接导致泪液分泌量下降,破坏泪膜稳定性,而随着暴露时间的延长(2-4 wk内),高原环境所致损伤程度有所降低,甚至功能代偿性增加,这与平原地区人群进入高原后所产生的缺氧习服机制相同。然而,本研究还存在一定的不足:(1)由于未能获取兔睑板腺及脂质层分析的红外图像,没有定量及定性研究泪液脂质及睑板腺的变化,故尚不能确定急性高原暴露导致的泪膜稳定性下降是否由脂质异常导致;(2)未观察干预3、7 d两组兔结膜杯状细胞的数量及MUC5AC的表达,不清楚早期的变化趋势;(3)出于伦理学考虑,本研究利用高原模拟舱未将人列为研究对象,由于兔眼和人眼解剖学类似故选择兔为研究对象,但兔眼仍有其特殊结构,且泪液成分有差异,故研究结果虽然有参考价值,但具有一定局限性,后续可实地收集高原与平原地区居住者的泪液样本进行分析。目前,低压缺氧导致干眼的具体分子生物学机制尚不清楚,后续研究可深入探讨高原与平原地区人群泪液中氧化应激、缺氧相关因子的差异及与拉曼光谱的联系。

