羊肚菌菌丝的紫外诱变及高产多糖菌株筛选
阮永海 许腾龙 钱森和
(1安徽工程大学生物与食品工程学院,安徽 芜湖 241000;2芜湖野树林生物科技有限公司,安徽 芜湖 241111)
羊肚菌(Morchella esculenta)又称羊肚菜、羊肚蘑和编笠菌,在真菌学分类中属于子囊菌亚门、盘菌纲、盘菌目、羊肚菌科和羊肚菌属[1]。羊肚菌是一种珍稀名贵的野生食用菌,具有“菌中之王”“蘑菇皇后”等美誉[2]。作为药食两用菌,羊肚菌富含蛋白质、维生素、矿物质、多糖以及多酚等多种营养物质,具有调节免疫、保护肾脏与肝脏等药理活性[3]。其中,羊肚菌多糖是羊肚菌中一种重要的活性物质,其对羊肚菌的品质具有重要影响。研究表明,羊肚菌多糖具有抗菌、抗病毒和增强免疫力等功效,在保健品和医药领域有着重要的应用价值[4-5]。
目前,生产上种植的羊肚菌菌株主要来源于野生种的人工筛选和驯化,菌种质量有待进一步提升。通过人工育种技术可以获得优良菌株,常见的食用菌育种方法有杂交育种、诱变育种和基因工程育种等。其中,诱变育种是一种简单、高效的育种方法,在食用菌育种过程中发挥了重要作用[6]。紫外诱变是一种使用较早、应用较广的诱变技术,其产生的突变率高,且操作简单安全。实践中已通过紫外诱变技术获得多种植物和微生物等新品种[7]。本研究采用紫外诱变处理羊肚菌菌丝体,通过探究诱变后的菌丝体生长势与多糖含量,筛选菌丝生长速度快、多糖含量高的突变菌株,并对突变菌株的菌丝多糖形貌特征、红外光谱、抗氧化活性以及菌丝的生长温度进行分析,为羊肚菌品种的创新提供参考。
1 材料与方法
1.1 试验材料
羊肚菌由安徽芜湖野树林生物科技有限公司提供。
1.2 试验仪器
SW-CJ-ZFD超净工作台(苏州杰诺净化科技有限公司);RE-2000A 旋转蒸发仪(上海贤德实验仪器有限公司);ZQZY-78BN震荡培养箱(知楚仪器有限公司);DHG-9000 电热恒温鼓风干燥箱(无锡市翼搏凡环境试验设备有限公司);LGJ-12 真空冷冻干燥机(北京松源华兴科技发展有限公司);80 L 立式压力蒸汽灭菌器(上海博讯仪器有限公司);IR Prestige-21傅里叶变换红外光谱仪(日本岛津公司);S-4800扫描电子显微镜(日本日立公司)。
1.3 菌丝体制备
将羊肚菌子实体切小块,取菌盖与菌柄连接处,放入75%乙醇浸泡消毒3 min 后取出,在超净台中用无菌水清洗2~3 遍,放到PDA 固体培养基上,于25 ℃培养箱中培养4~5 d。
1.4 紫外诱变与筛选
1.4.1 菌丝体的紫外诱变在超净工作台中将上述制备的羊肚菌菌丝接入固体培养皿中,每个平板中央接入相同大小的菌丝圆片,于25 ℃培养48 h后在紫外灯正下方30 cm 处进行紫外照射20 s;25 ℃暗培养24 h后再次紫外照射40 s;再次25 ℃暗培养24 h 后紫外照射60 s,并置于25 ℃培养箱中暗培养[8];之后挑取生长较为旺盛的菌落尖端菌丝于斜面培养基中,直至长满斜面。用生理盐水冲洗斜面,制备菌丝悬液,稀释一定倍数后涂布平板,并培养36 h。
1.4.2 突变株的平板培养筛选从上述平皿中挑选长势较好的菌落菌丝接种于PDA 平板中培养48 h,观察每个诱变株的菌落颜色、长势和疏密度,测量菌落的直径,计算菌丝生长速率,并继续培养,记录菌丝生长情况,以此进行初步筛选[9]。菌丝生长速度计算公式如下。
将初步筛选的诱变株菌丝与出发菌株菌丝体接种于同一PDA培养皿中,25 ℃培养4~5 d后,观察相互之间的拮抗情况,进一步筛选发生突变的菌株。
1.4.3 遗传稳定性分析将出发菌株和筛选的诱变株菌丝接种于PDA 培养皿中,共培养6 代,测定第2 代、第3 代和第6 代菌丝的生长速度,分析各菌株的遗传稳定性。
1.5 液体培养筛选
在超净台里将上述筛选的诱变株菌丝分别接种到液体培养基中,放入摇床25 ℃、140 r/min 培养5 d 后取出,用纱布过滤出菌丝球,蒸馏水清洗2~3 次,放入培养皿中计算菌丝球的数量;然后放入烘箱中烘干,称量菌丝球的干重[10],由此分析诱变株在液体培养中的生物量。
1.6 多糖提取及含量测定
参照陈盛宇等[11]的方法提取菌丝多糖。将诱变菌株接入液体培养基中培养4 d,之后以4 000 r/min离心培养液20 min,收集菌丝体,用去离子水清洗,放入烘箱烘干后打碎,即得到羊肚菌菌丝干粉,并采用水提醇沉法得到羊肚菌菌丝多糖。
将羊肚菌干重记为M1,冻干后多糖粉末重量记为M2,多糖含量计算公式如下。
1.7 多糖表征提取
1.7.1 扫描电镜表征采用扫描电子显微镜对菌丝体多糖进行表面形貌的观察。测试前对多糖样品喷金以提高其导电性,电压为5 kV。
1.7.2 红外光谱表征挑取少量冻干的菌丝体多糖与溴化钾固体在玛瑙研钵中进行混合研磨,充分混匀后用压片机压成薄片,采用傅里叶变换红外光谱仪对菌丝体多糖红外光谱扫描,波长范围为500~4 000 cm-1。
1.8 多糖抗氧化活性测定
1.8.1 DPPH 自由基清除率测定DPPH 自由基清除能力测定参照Xiao等[12]的方法并在其基础上适当改进。分别配制浓度为0.5、1.0、1.5、2.0 和2.5 mg/mL 的羊肚菌多糖样品溶液,将100 μL 样品溶液与100 μL 0.4 mg/mL DPPH 乙醇溶液、100 μL样品溶液与100 μL 无水乙醇、100 μL 0.4 mg/mL的DPPH乙醇溶液与100 μL无水乙醇等量混合加入酶标板中,室温下暗处反应30 min 后,在517 nm 下测定吸光值,分别记为A0、A1和A2;同时以相同方法测定Vc的自由基清除率作为阳性对照。DPPH自由基清除率公式如下。
1.8.2 ABTS自由基清除率测定根据景年华等[13]的方法测定ABTS自由基清除活性。分别将100 μL样品与100 μL 提前配好的ABTS 溶液(等体积的7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液)、100 μL 样品与100 μL 无水乙醇、100 μL 提前配好的ABTS溶液与100 μL无水乙醇等量混合加入酶标板中,室温下暗处反应6 min后,在734 nm下测定吸光值,分别记为B0、B1和B2;同时以相同方法测定Vc的自由基清除率作为阳性对照。ABTS 自由基清除率计算公式如下。
1.8.3 羟自由基清除率测定参考Zhang等[14]的方法并略作修改。将50 μL样品与50 μL 0.250 2 mg/mL FeSO4、50 μL 0.124 3 mg/mL 水杨酸乙醇溶液以及50 μL 0.3%的过氧化氢混匀,置于37 ℃恒温避光反应15 min,在510 nm下测定吸光值,记为C1;用蒸馏水代替过氧化氢,在510 nm下测定吸光值,记为C2;用蒸馏水代替样品,在510 nm 下测定吸光值,记为C0;以相同方法测定Vc 的自由基清除率,并作为阳性对照。羟自由基清除率计算公式如下。
1.9 诱变株菌丝体的生长温度筛选
在超净工作台中将每个平板中央接入相同大小的菌丝圆片,设置20、22、24和26 ℃4个温度梯度进行培养试验。置于培养箱中培养4 d,观察菌丝萌发速度、生长速度以及菌丝的颜色变化。
1.10 数据处理与分析
采用Excel 2010软件整理试验数据,使用Origin 2018软件作图,SAS 8.1软件进行差异显著性分析。
2 结果与分析
2.1 紫外诱变平皿培养筛选
从诱变后的菌株中挑选45 株生长较好的菌落于PDA 平板培养基,25 ℃培养4 d 后,根据菌丝生长速率和拮抗分析结果,进一步筛选出6株菌株,并分别命名为YY-1、YY-2、YY-3、YY-4、YY-5 和YY-6。由出发菌株(CK)和6株诱变株菌丝生长情况(表1)可以看出,CK 菌丝较为稀疏,其满皿时间为6 d;YY-1 菌丝生长较出发菌株浓密,菌丝满皿时间为6 d;YY-2 和YY-6 菌丝生长稀疏,满皿时间分别为5 d 和4 d;YY-3、YY-4 和YY-5 菌丝较为浓密,满皿时间均为5 d,其中YY-3和YY-4菌丝颜色为浅黄色。各诱变株与出发菌株均产生了不同程度的拮抗,表明各诱变株与出发菌株相比发生了遗传变异,其中YY-3 菌株与出发菌株之间的拮抗作用如图1所示。

图1 诱变菌株菌丝的平皿生长情况与拮抗作用
2.2 诱变株的遗传稳定性分析
对不同诱变株的遗传稳定性进行分析,其结果如表2 所示。YY-6 的第2 代菌丝体生长速率明显降低,可能是诱变时间过长导致遗传物质发生较大的改变;其他诱变株菌丝在不同代数间的生长速率差异不明显,表明其均有较好的遗传稳定性。
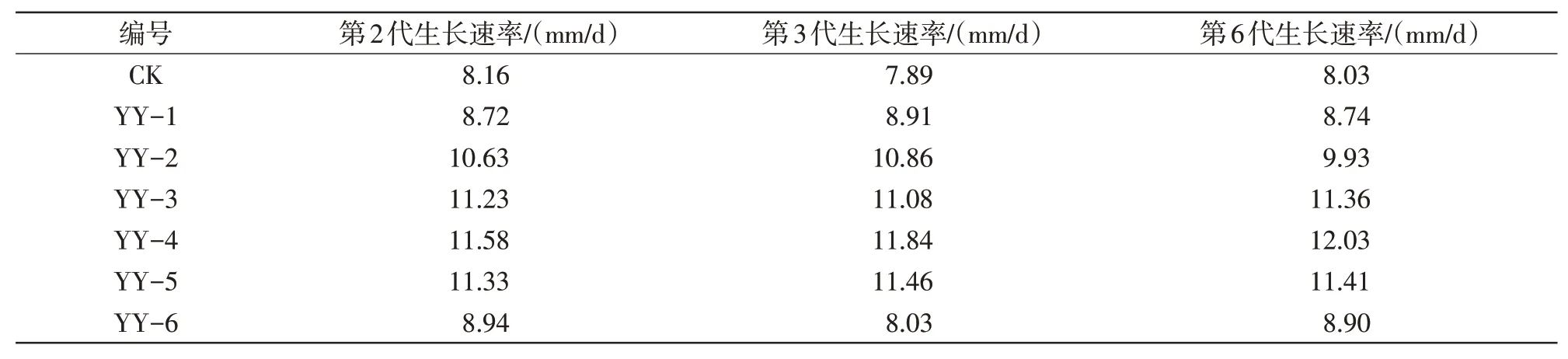
表2 诱变株的遗传稳定性分析
2.3 诱变株在液体培养中的生物量分析
由图2可知,在25 ℃、140 r/min 的培养条件下,YY-1、YY-3、YY-4 和YY-5 的菌丝球个数分别为46.6、49.5、47.4 和46.2 个,多于出发菌株(37.5 个);而YY-2 和YY-6 的菌丝球个数与出发菌株差异不存在统计学意义。YY-2、YY-3、YY-4和YY-5的菌丝球干重分别31.3、37.5、33.8和34.6 mg,高于出发菌株(23.6 mg);而YY-1和YY-6菌丝球干重与出发菌株差异不存在统计学意义。

图2 诱变株在液体培养中的生物量分析
2.4 菌丝体多糖含量分析
多糖是羊肚菌中一种重要的活性成分,对羊肚菌的品质有着重要的影响。不同诱变株菌丝体多糖含量的影响如图3所示。YY-1、YY-2和YY-6菌株菌丝体多糖含量与出发菌株相比,差异不存在统计学意义;YY-3、YY-4 和YY-5 菌株菌丝体多糖含量高于出发菌株。
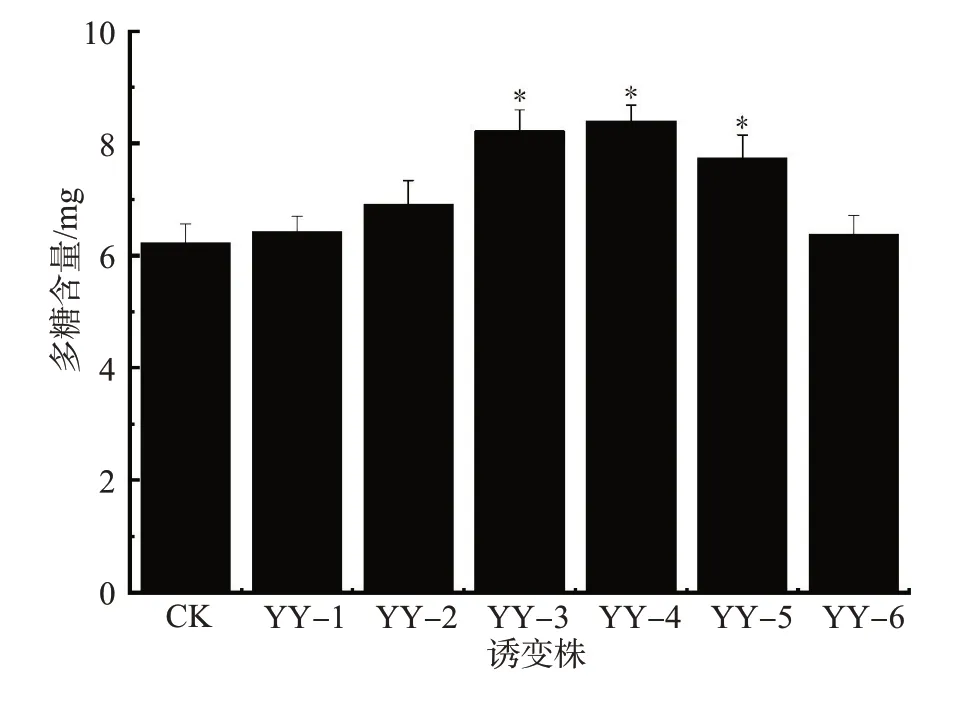
图3 羊肚菌菌丝体多糖含量
2.5 菌丝多糖表征分析
通过上述分析,选取综合性能较好的YY-3 菌株,对其多糖表征进行分析。其菌丝体多糖的扫描电镜和红外表征如图4 所示。从图4(A)可以看出,羊肚菌菌丝体多糖呈扁平状,颗粒大小约为0.5 μm,且颗粒之间结合比较紧密。从图4(B)菌丝体多糖的红外光谱可以看出,羊肚菌菌丝体多糖的红外光谱在3 380 cm-1处出现了一个宽的特征吸收峰,可能是分子间氢键O-H 伸缩振动产生的;在2 950 cm-1处产生的吸收峰,可能是由C-H伸缩振动引起的;1 660 cm-1处产生的吸收峰可能是由于C=C 双键的伸缩振动产生的;在1 420 cm-1处的吸收峰是C-H 弯曲振动或伸缩振动引起;在1 120 cm-1处具有吸收峰,则表明有吡喃糖环的存在。因此,羊肚菌菌丝体多糖具有一般多糖的红外光谱特征。

图4 羊肚菌菌丝体多糖的扫描电镜和红外表征
2.6 菌丝体多糖的抗氧化活性分析
YY-3 菌株菌丝体多糖的抗氧化活性分析结果如图5 所示。从图5(A)可以看出,羊肚菌菌丝体多糖的DPPH 自由基清除率随浓度增大而增大,但增大的趋势较为平缓,当多糖浓度为2.5 mg/mL 时,其清除率为45.5%,低于Vc。由图5(B)可以看出,当多糖浓度在0.5~2.0 mg/mL,随着多糖浓度的增大,ABTS自由基的清除率增加较为明显,之后其清除率增加较少;当多糖浓度为2.5 mg/mL 时,其ABTS 自由基清除率为90.64%。由图5(C)可以看出,多糖的羟自由基清除率随着多糖浓度的增大而明显升高,当多糖浓度为2.5 mg/mL 时,其羟自由基清除率为79.41%。可见,羊肚菌菌丝体多糖对ABTS 自由基和羟自由基具有较好的清除能力。
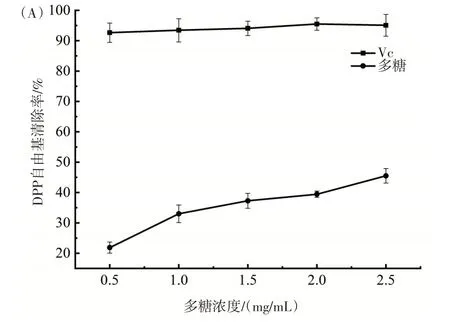
图5 羊肚菌菌丝体多糖抗氧化活性分析
2.7 菌丝体生长的温度分析
温度对羊肚菌菌丝的生长有着重要的影响。由表3 可以看出,随着温度从20 ℃上升到24 ℃,菌丝萌发和生长速度较快,菌丝颜色变化不明显。当温度为24 ℃时,菌丝萌发和生长速度最快;当温度为26 ℃时,其萌发和生长速度明显变慢,且菌丝颜色由微黄变为黄色。
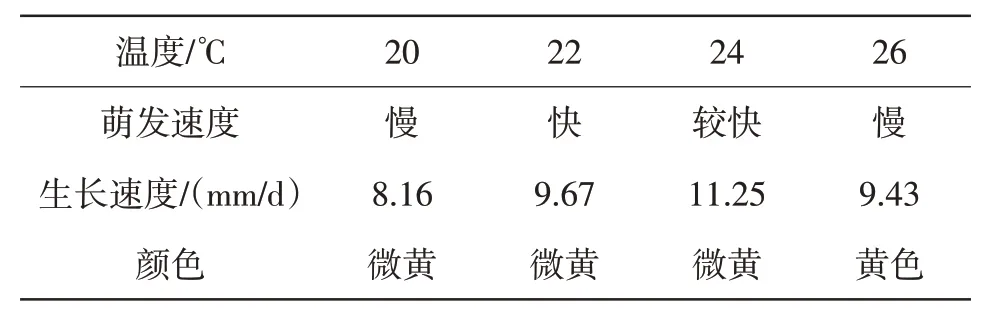
表3 不同温度对YY-3菌株菌丝生长的影响
3 结论与讨论
传统的诱变方法包括化学诱变、物理诱变和生物诱变,其中物理诱变简单易行,且高效安全。紫外诱变是物理诱变中常用的一种方法,在微生物、蔬菜和农作物新品种的选育中发挥重要作用[15]。紫外诱变的主要原理是使DNA能够形成嘧啶二聚体,阻止碱基之间的正常配对,使生物体产生突变[16]。本研究采用紫外线照射处理羊肚菌菌丝体,根据菌丝平皿生长速度及拮抗作用筛选得到了6 株正突变株;其中,YY-1、YY-2、YY-3、YY-4 和YY-5 菌株菌丝具有较好的遗传稳定性,而YY-6 突变株的遗传稳定性较差;另外,YY-3、YY-4和YY-5突变株的菌丝球个数和菌丝干重优于出发菌株;而YY-6 突变株无论是菌丝球个数还是菌丝球干重与出发菌株的差异均不存在统计学意义。
多糖是羊肚菌食药用的主要活性成分之一,具有抗氧化等生物学功能。筛选高产多糖的羊肚菌菌株,对提高羊肚菌的品质具有重要作用[2]。本研究筛选得到的YY-3、YY-4 和YY-5 突变株菌丝体多糖含量高于出发菌株,而YY-1、YY-2 和YY-6 突变株菌丝体多糖含量与出发菌株差异不存在统计学意义。另外,羊肚菌菌丝体多糖具有一般多糖的红外光谱特征,其对DPPH 自由基清除能力稍差,但对ABTS 自由基和羟自由基均具有较好的清除作用。
温度是食用菌菌丝生长的重要影响因素之一,适宜的温度能够促进菌丝快速生长。较低的温度导致菌丝萌发和生长受到限制;同样,超过菌丝生长的最适温度,菌丝颜色发生变化,生长速度会急剧下降,甚至导致菌株死亡[17]。当温度低于或超过24 ℃时,羊肚菌菌丝体的萌发和生长均受到抑制,且在26 ℃时菌丝颜色变成了黄色。
为筛选优良的羊肚菌菌株,采用紫外诱变处理羊肚菌菌丝体,本研究通过探究诱变后的菌丝体生长势与多糖含量,筛选菌丝生长速度快、多糖含量高的突变菌株,并对突变菌株的菌丝多糖形貌特征、红外光谱、抗氧化活性以及菌丝的生长温度进行了分析。结果表明,在挑选的45 株诱变后菌株中,筛选得到6 株生长势较好的菌株,其与出发菌株均有一定的拮抗作用。其中,YY-1、YY-2、YY-3、YY-4 和YY-5菌株菌丝具有较好的遗传稳定性;YY-3、YY-4和YY-5 菌株菌丝体具有较高的生物量和多糖含量。YY-3菌株菌丝体多糖呈扁平状,具有一般多糖的红外光谱特征,且具有较好的ABTS自由基和羟自由基清除能力。YY-3 菌株菌丝的适宜生长温度为24 ℃。综上所述,本研究发现通过紫外诱变可以筛选得到生长势较好、多糖含量较高的羊肚菌菌株,筛选得到的YY-3、YY-4 和YY-5 突变株菌丝具有较好的生长势与多糖含量,这些突变株的出菇性能及其子实体中的多糖含量将有待于进一步研究。

