痤疮毛囊微生物DNA提取方法的优化
赵子馨,魏钰蓉,李晓含,李 伟
(聊城大学东昌学院 化学与生物系,山东 聊城 252000)
0 引言
皮肤是人体最大的器官,作为四大菌库之一,皮肤表面定殖着数以亿计的微生物,称为皮肤正常微生物群,可调节宿主先天性和适应性免疫系统发出的信号,帮助宿主抵御外部病原菌的入侵[1-2]。痤疮是一种最常见的发生于毛囊皮脂腺的慢性炎症性损容性皮肤病,好发于面部,影响容貌,极易反复发生,已成为全球第八大常见病[3]。在痤疮患者中,青少年发病率约为80%,20~30岁成年人患病率高达64%。据我国青春期人群统计,约有95%的男性和85%的女性患过不同程度的寻常痤疮,在某一时间会出现面部、颈部、背部和胸部的少数斑点,部分患者发展为重型痤疮或聚合型痤疮,给患者留下严重的皮肤疤痕,产生严重的生理及心理影响[4-7]。
基于DNA技术的分子生物学方法具有特异性高、灵敏度强的优势,在生物学研究中具有重大意义。在检测方法建立初期,提取高质量、高纯度及结构完整的基因组DNA是后续试验顺利进行的保障[8]。为此寻找了一种不同于棉拭子[9]的采样方法—鼻贴取样,可以更好地将痤疮毛囊内部的微生物提取出来。目前常用的DNA提取方法主要包括各类试剂盒法、CTAB法、SDS法及CTAB NaCl法等[10-11]。而各种方法的简便性、实用性、经济性等各不相同,本研究选取了两种不同的DNA提取方法进行了比较研究。
1 材料与方法
1.1 实验材料
样品来源。取样对象为某大学的学生,年龄18~22岁,面部均患有不同程度的痤疮,信息统计和样本采集已征得本人同意。
试剂。DNeasy Blood&Tissue Kit(QIAGEN)(美国贝克曼仪器有限公司生产);Super GelRed TM核酸染料(苏州优逸兰迪生物科技有限公司生产);2×Taq Master Mix(苏州近岸蛋白质科技有限公司生产);溶菌酶、CTAB缓冲液、TE缓冲液、SDS、蛋白酶K、6×Loading Buffer(北京索莱宝科技有限公司生产);DNA Marker D15000+2000(天根生化科技有限公司生产);苯酚、氯仿、异戊醇(广东翁江化学试剂有限公司生产)。
仪器与设备。PCR仪(伯乐T100)(北京康普源科技有限公司生产);超微量核酸蛋白测定仪(Denovixs DS-11/Ds-11+)(北京倍辉科技有限公司生产);QuickGel 6200凝胶成像系统(莫纳生物科技有限公司生产);优普超纯水仪(UPR-II-10T)(四川优普超纯科技有限公司生产);台式高速离心机(TG16-WS)(长沙湘仪离心机仪器有限公司生产);核酸电泳仪 (JY300C)(北京君意东方电泳设备有限公司生产)。
1.2 方法
1.2.1 样本采集与处理
洗面奶洁面,用无菌干巾擦干面部水分,无菌水喷湿脸颊,再用无菌镊子将鼻贴夹起贴在鼻子上,5~10 min待其完全干燥后用无菌镊子缓慢去除鼻贴,再用微型手术铲刀将鼻贴上的毛囊刮下放入2 mL离心管中。共取样两次。第一次在夏季取样,能明显看到鼻贴上的毛囊样本,粘取效果好,采集了9个志愿者的毛囊样本;第二次在冬季取样,鼻贴上毛囊样本的量明显比夏季的少,粘取效果一般,采集了16个志愿者的毛囊样本。样本的具体处理过程如表1所示。
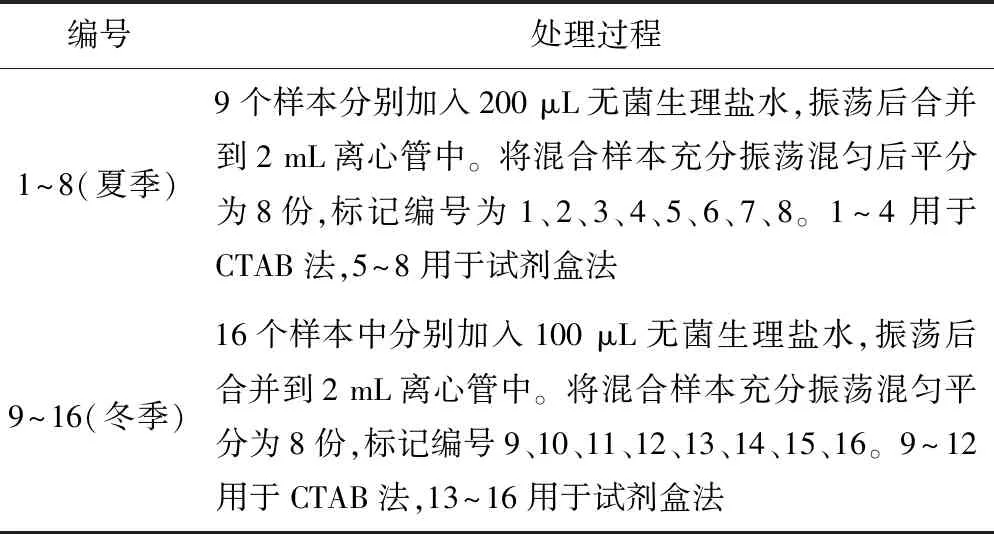
表1 样本处理情况
1.2.2 DNA提取
CTAB提取法:参照刀筱芳等[12]的提取方法进行适当改进。将样本用290 μL TE缓冲液浸洗。在离心管中加入10 μL 100 mg/mL的溶菌酶、30μL 100 g/L的SDS溶液、6 μL 10 mg/mL的蛋白酶K,涡旋振荡器振荡10 s,37 ℃温育1 h。加入100 μL 5 mol/L的NaCl,混匀,再加入80 μL的CTAB/NaCl溶液(100 g/L CTAB /0.7 mol/L NaCl),充分混匀,65 ℃温育10 min。加入等体积的酚/氯仿/异戊醇(25∶24∶1,体积比),盖紧管盖,轻柔地反复颠倒离心管,充分混匀,冰浴10 min。12 000 rpm离心10 min,小心吸取上层水相转移至另一干净的2 mL离心管。加入等体积的氯仿/异戊醇(24∶1,体积比),混匀,12 000 rpm离心5 min,小心吸取上层水相转移至另一干净的2 mL离心管。加入1/10体积的NaAc溶液,混匀,再加入2倍体积无水乙醇,混匀,12 000 rpm离心5 min,弃去上清液,用70%乙醇洗涤DNA沉淀,离心,弃去上清液。用50 μL TE缓冲液轻柔地溶解DNA沉淀,加入10 mg/mL的RNaseA混匀,4 ℃保存。
试剂盒法:将样本置于1.5 mL离心管中,加入150 μL缓冲液ATL和15 μL蛋白酶K,涡旋混合,56 ℃孵育30 min。涡旋15 s,加入150 μL BufferAL,涡旋10 s,加入150 μL 乙醇(96%~100%),涡旋混匀。移入2 mL收集管中的DNeasyMini旋转柱中,8000 rpm离心1 min,丢弃流通液和收集管。将DNeasyMini旋转柱放在一个新的2 mL收集管中,添加300 μL BufferAW1,以8000 rpm的速度离心1 min。丢弃流通和收集管。DNeasyMini旋转柱放在新的2 mL收集管中,添加300 μL BufferAW2,并以14 000 rpm离心3 min。小心移出DNeasyMini旋转柱,避免柱与流通液接触,将其放在干净的2 mL微量离心管中,将150 μL BufferAE直接吸到DNeasy膜上。室温下孵育1 min,以8000 rpm离心1 min以洗脱,得到洗脱液Ⅰ。用新的离心管及100 μL BufferAE重复一次洗脱步骤得到洗脱液Ⅱ,将其合并到洗脱液Ⅰ,得到DNA提取液。
1.2.3 样品DNA浓度测定
超微量测定仪测量DNA含量:使用超微量核酸蛋白测定仪(Denovixs DS-11/Ds-11+)测定样本原液中DNA的浓度和纯度。
PCR扩增和凝胶电泳成像:采用的通用引物序列为338F (5’-ACTCCTACGGGAGGCAGCAG-3’)和806R (5’GGACTACHVGGGTWTCTAAT-3’)。 PCR反应采用20 μL体系,包括2xTaqMasterMix溶液10 μL、上游引物338F 2 μL、下游引物806R 2 μL、DNA提取样本2 μL、灭菌的ddH2O 4 μL。设置扩增条件95 ℃ 5 min、94 ℃ 30 s、54 ℃ 30 s、72 ℃ 60 s共35个循环,最后一个循环的延伸时间为10 min。扩增结束后将PCR管取出,用TAE电泳缓冲液配制10 g/L的琼脂糖胶,待胶完全凝固后,依次上样,记录好上样顺序。设置电压120 V,时间25 min或根据指示剂迁移位置判断是否中止电泳。电泳结束后用Super GelRed染色液浸没,室温孵育30 min,将其取出进行凝胶成像,观察条带明暗程度并保存实验结果。
2 结果与分析
2.1 DNA的纯度
通过超微量测定仪测定两种提取方法的DNA纯度,见表2、表3。A260/A280比值表示蛋白质和酚类的去除情况,纯度较好的比值为1.8左右,比值较低说明受到蛋白质(芳香族)或酚类物质的污染。夏季样本中CTAB法的平均比值为1.56,试剂盒法的平均比值为0.85。冬季样本中CTAB法的平均比值为0.96,试剂盒法的平均比值为 0.42。A260/A230比值表示糖类、盐分等的去除情况,纯度较好的比值为2.0左右,若比值小于2.0,说明样品中糖类或有机溶剂含量较高。夏季样本中CTAB法平均比值为1.86,试剂盒法的平均比值为0.40。冬季样本中CTAB法平均比值为1.44,试剂盒法的平均比值为0.36。总体来看,在夏季用CTAB法提取样本得到的DNA纯度更高。
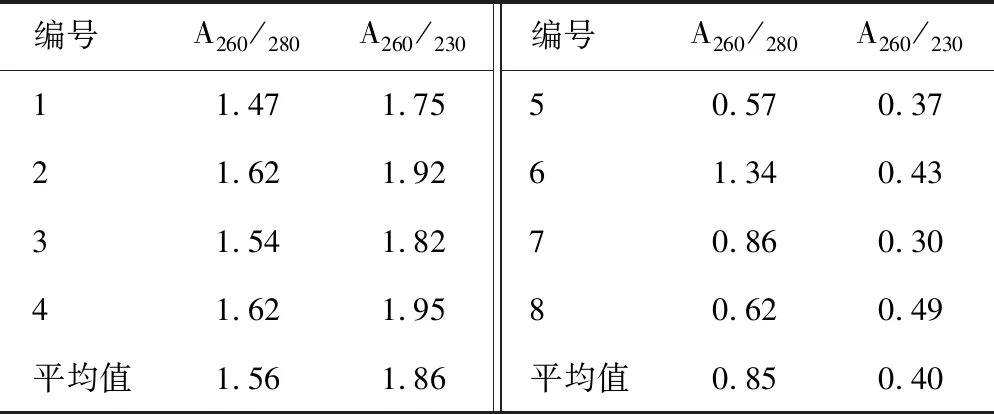
表2 两种方法提取的DNA纯度(夏季批)
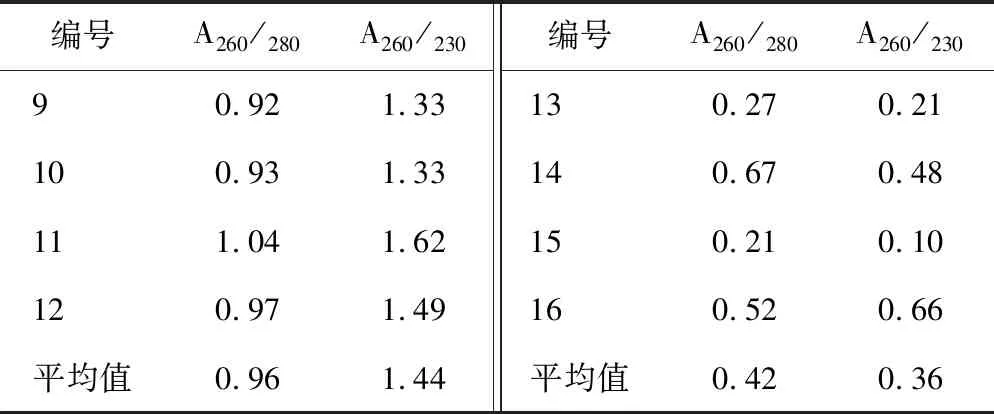
表3 两种方法提取的DNA纯度(冬季批)
2.2 DNA得率
通过超微量测定仪测定两种提取方法的DNA得率见表4、表5。相同季节进行比较都是CTAB法提取的DNA得率远远高于试剂盒法,且在夏季用CTAB法所提取出来的DNA得率最高。导致试剂盒方法得率低的原因可能有两点:①CTAB法相较于试剂盒的实际得率原本就高。②在DNA提取过程中,采用蛋白酶K、洗涤剂和有机萃取的提取步骤,导致DNA得率降低,两种方法都通过加入蛋白酶K来去除蛋白质等大分子物质和杂质,且试剂盒方法加入的蛋白酶K含量是CTAB方法的两倍,故有可能对DNA得率产生较大的影响。从DNA得率来看,在夏季用 CTAB方法提取的DNA质量较好,得率较高。
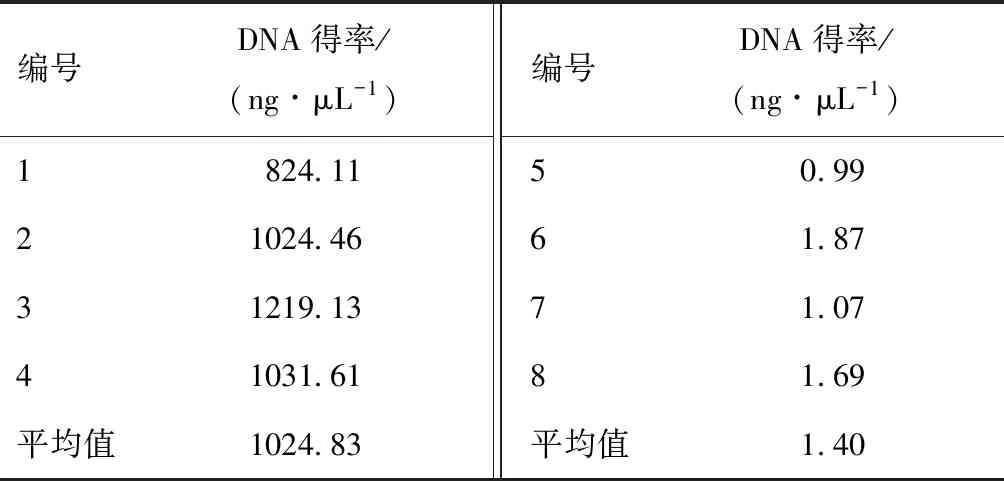
表4 两种方法提取的DNA得率(夏季批)

表5 两种方法提取的DNA得率(冬季批)
2.3 PCR和凝胶电泳成像
PCR扩增对模板DNA的质量要求较高,因此PCR扩增成功率成为判定DNA质量的重要依据之一。以样本DNA作为模板,用上述一对通用引物进行PCR扩增,扩增产物的琼脂糖凝胶电泳如图1所示,均可得到明显的电泳条带,无空白条带。但不同提取方法间条带明暗程度差异较大,5~8和13~16泳道为试剂盒法提取,DNA纯度较好,扩增条带较亮。1~4和9~12泳道为CTAB法提取,DNA纯度较差,扩增条带较暗。
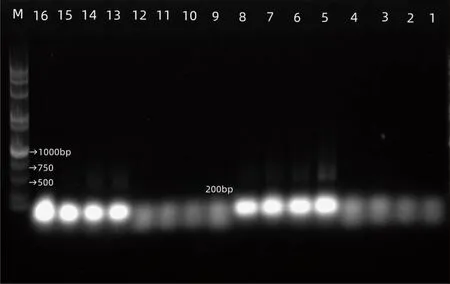
注:M:DL15000+2000分子量标准。
利用成像分析软件GelAnalyzer进一步分析,见图2。其中5~8与13~16泳道DNA得率(Cal. Volume)明显高于1~4和9~12泳道,说明从PCR扩增后的凝胶电泳成像来看,试剂盒法对毛囊微生物的提取效果更好。
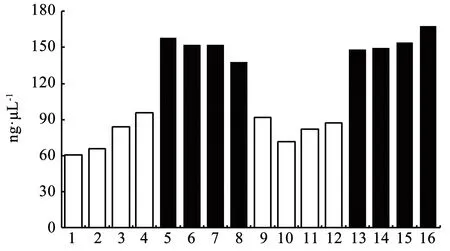
注:白色:CTAB法;黑色:试剂盒法
2.4 结果及分析
由于在取样过程中不可避免会粘取面部表皮细胞,故提取的DNA样本中并不完全是皮肤毛囊微生物的DNA,也会掺杂部分人体皮肤细胞中的DNA。实验中所加引物是针对细菌DNA扩增的引物,由此可推断出CTAB法中DNA得率较高的原因可能是受样本中人体表皮细胞DNA的影响。
关于痤疮毛囊微生物DNA提取的2种方法,根据上述对A260/A280和 A260/A230两个比值与DNA浓度的测定结果,由PCR扩增结果对各DNA提取方法进行综合分析,对提取过程的简易程度等因素进行总结,各方法的优缺点见表6。

表6 两种DNA提取方法的优缺点比较
3 结论
通过DNA纯度、DNA得率、PCR扩增成功率比较了两种用于痤疮毛囊微生物DNA的提取方法。结果表明,CTAB法成本低,DNA纯度及浓度较好,但耗时较长;试剂盒法成本较高,但相对耗时短,操作简单,且PCR扩增后的凝胶电泳成像更清晰。针对痤疮毛囊微生物的研究特点,利用试剂盒法提取更有利于后续实验数据分析。从提取季节来看,夏季更有利于痤疮毛囊微生物的提取,原因可能是夏季气温高,面部毛孔舒张,用鼻贴取样的方法更易把毛囊微生物粘取出来。

