长链非编码RNA IGF2BP2-AS1通过调控miR-375表达对喉癌细胞迁移及增殖的影响
王挺 张杨 郭洁 范崇盛 刘亚芳
1郑州大学附属洛阳中心医院耳鼻咽喉头颈外科,洛阳 471000;2吉林大学第一医院肿瘤科,长春 130061
喉癌是全球常见的咽喉部恶性肿瘤,其发病通常较隐匿,确诊时可能已发生转移[1-2]。喉癌的发生和发展涉及多种基因、多种信号通路的改变,特别是表观遗传基因的表达异常[3]。因此,探究喉癌发生发展的基因调控机制,有助于寻找新的治疗靶点。长链非编码RNA(lncRNA)是一类内源性小分子RNA,参与调控染色质的结构变化、基因转录、基因翻译过程[4-6]。lncRNA 作为一种非编码RNA,被证实在喉癌、前列腺癌、肝癌等恶性肿瘤中异常表达,与肿瘤细胞的分化、放化疗敏感度以及患者预后密切相关[7-10]。胰岛素样生长因子2 mRNA 结合蛋白2(IGF2BP2)-AS1 是新发现的一种lncRNA,其在多种肿瘤(如膀胱癌、口腔鳞状细胞癌等)中高表达,表现为明显的癌基因功能[11-12]。IGF2BP2-AS1在喉癌细胞中的表达及对喉癌细胞的调控机制 并 不 清 楚 。本 研 究 以 IGF2BP2-AS1/微RNA-375(miR-375)轴为切入点,探究IGF2BP2-AS1 对喉癌细胞增殖、迁移的影响及分子机制,以期为喉癌的诊疗提供新策略。
材料与方法
研究时间为2022年1月至2023年11月,研究地点为郑州大学附属洛阳中心医院中心实验室,研究类型为基础研究。
1.细胞系和主要试剂
支气管上皮细胞系16HBE 和喉癌细胞系AMC-NH-8、TU159、TU138、TU686 购自北京索莱宝科技有限公司。胎牛血清和DMEM 培养基购自美国Gibco 公司。阴性对照RNA 和IGF2BP2-AS1 小干扰RNA 购自武汉益普生物科技有限公司。miR-375、miR-NC 购自上海恒斐生物科技有限公司。Lipofectamine 3000、CCK-8 试剂盒购自美国Invitrogen公司。SYBR试剂盒、双荧光素酶活性试剂盒购自深圳晶美生物工程有限公司。双荧光素酶载体购自北京智杰方远科技有限公司。兔源N-钙黏着蛋白(N-Cadherin)、叉头框蛋白C2(FOXC2)、β 肌动蛋白(β-actin)、CDK2、细胞周期蛋白A(Cyclin A)一抗抗体购自美国Sigma公司。
2.细胞培养和分组
恒温箱参数设置为37 ℃、5%CO2,AMC-NH-8、TU159、16HBE、TU138、TU686 均用含12%胎牛血清的DMEM 培养基培养。将对数生长期的TU686 细胞接种在12 孔板,TU686 细胞分为si-NC 组和si-IGF2BP2-AS1 组,分别采用Lipofectamine 3000 转染试剂将阴性对照RNA 和IGF2BP2-AS1 小干扰RNA 转染到TU686 细胞,转染45 h后进行后续实验。
3.实时荧光定量PCR(qPCR)检测细胞中IGF2BP2-AS1、miR-375表达
采用Trizol法提取各细胞系的总RNA,进一步反转录为cRNA。按照SYBR 试剂盒说明书设置qPCR 反应体系,以GAPDH 为内参比较IGF2BP2-AS1 表达量,以U6 为内参比较miR-375 表达量,引物序列见表1。采用2-ΔΔCt法计算IGF2BP2-AS1、miR-375相对表达量。

表1 qPCR引物序列
4.CCK-8 法检测敲降IGF2BP2-AS1 后TU686 细胞的增殖能力
收集转染后的各组TU686 细胞,分别以3×103个/孔接种于96孔板,在恒温箱内持续培养1、2、3、4、5 d。每天固定时间分别向各孔加40 μl的CCK-8试剂,恒温箱内处理2 h。采用全自动酶标仪测量各孔TU686细胞在450 nm处的吸光度(OD)值。
5.划痕愈合实验检测敲降IGF2BP2-AS1后TU686细胞的迁移能力
收集转染后的各组TU686 细胞,用含15%胎牛血清的培养基重悬。调整细胞密度后,分别将TU686 细胞加入24孔板,培养24 h。PBS溶液清洗3次,用10 μl移液枪吸头在24 孔板底划痕,PBS 溶液清洗3 次,加入1 ml 不含胎牛血清的培养基,在光学显微镜下观察、拍照,测量划痕宽度P1。培养24 h 后,PBS 溶液清洗3 次,加入1 ml 不含胎牛血清的培养基,在光学显微镜下观察、拍照,测量划痕宽度P2。TU686细胞划痕愈合率=(P1-P2)/P1×100%。
6.双荧光素酶报告基因实验验证IGF2BP2-AS1 与miR-375的靶向
分别构建IGF2BP2-AS1 野生型质粒IGF2BP2-AS1-Wt和突变型质粒IGF2BP2-AS1-Mut,采用Lipofectamine 3000 试剂分别将IGF2BP2-AS1-Wt、IGF2BP2-AS1-Mut 与miR-NC 或miR-375 转染到TU686 细胞。转染45 h,利用双荧光素酶检测试剂盒检测TU686细胞的海肾荧光素酶活性和萤火虫荧光素酶活性,分析各组TU686 细胞的荧光素酶活性。
7.Western blotting 检测TU686 细胞中N-Cadherin、FOXC2、CDK2、Cyclin A蛋白表达
采用RIPA 裂解液提取转染后TU686 细胞的总蛋白,蛋白变性后经聚丙烯酰胺凝胶电泳,电转到硝酸纤维素膜,经10%牛血清白蛋白封闭50 min。加入一抗N-Cadherin(1∶2 000 稀释)、FOXC2(1∶3 000 稀释)、CDK2(1∶4 000 稀释)、β-actin(1∶4 000 稀释)、Cyclin A(1∶4 000 稀释),在4℃孵育8 h。经TBST 溶液清洗后,加入二抗羊抗鼠免疫球蛋白G(IgG)抗体(1∶7 000稀释),在25 ℃孵育50 min。经TBST 溶液清洗后,采用化学发光法曝光并显影。
8.统计学方法
所有实验均独立重复4 次。用SPSS 22.0 软件统计数据,用GraphPad 7.0软件绘图。呈正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
结果
1.IGF2BP2-AS1在喉癌各细胞系中的表达
qPCR 检测显示(图1),与16HBE 细胞相比,喉癌细胞AMC-NH-8、TU159、TU138、TU686 中IGF2BP2-AS1 呈高表达(F=37.42,P<0.01),其中以TU686细胞中IGF2BP2-AS1表达最高(P<0.01)。因此,后续以TU686细胞为研究。
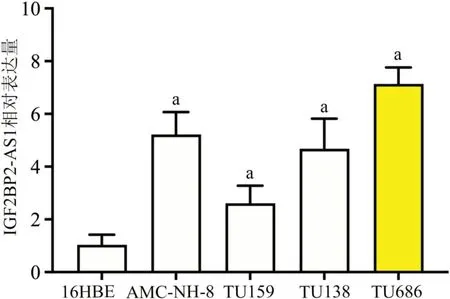
图1 IGF2BP2-AS1在支气管上皮细胞系16HBE和喉癌细胞系AMC-NH-8、TU159、TU138、TU686中的表达量
2.IGF2BP2-AS1小干扰RNA的敲降效率
qPCR检测显示,si-NC组和si-IGF2BP2-AS1组TU686细胞中IGF2BP2-AS1 表达分别为(7.25±0.22)和(1.02±0.30),si-IGF2BP2-AS1 组TU686 细胞中IGF2BP2-AS1 表达低于si-NC组(t=16.79,P<0.01),提示IGF2BP2-AS1 小干扰RNA敲降成功。
3.敲降IGF2BP2-AS1后TU686细胞迁移情况
划痕愈合实验显示,si-NC 组和si-IGF2BP2-AS1 组TU686 细胞划痕愈合率分别为(65.08±3.82)% 和(28.16±6.13)%,si-IGF2BP2-AS1 组细胞划痕愈合率低于si-NC组(t=5.11,P<0.01)。
4.敲降IGF2BP2-AS1后TU686细胞增殖情况
CCK-8 结果显示(图2),在铺板后第2、3、4、5 天si-IGF2BP2-AS1 组TU686 细胞增殖能力均低于si-NC 组(t=3.83、3.17、3.02、6.31,均P<0.01)。
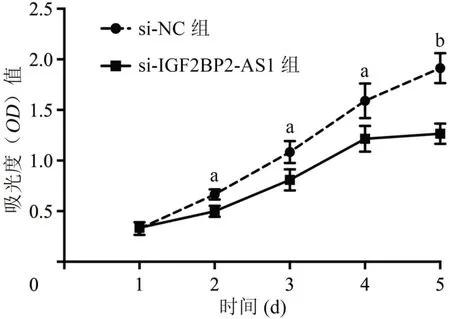
图2 敲降IGF2BP2-AS1对喉癌细胞TU686增殖的影响
5.IGF2BP2-AS1与miR-375的靶向关系
采用LncRNome在线软件预测显示(图3),IGF2BP2-AS1与miR-375存在结合位点,miR-375可能是IGF2BP2-AS1靶基因。双荧光素酶报告基因检测显示(图4),IGF2BP2-AS1-Wt中,miR-375 组相对荧光素酶活性低于miR-NC 组(t=8.95,P<0.01);IGF2BP2-AS1-Mut中,miR-NC组与miR-375组荧光素酶活性比较差异无统计学意义(t=0.74,P>0.05)。
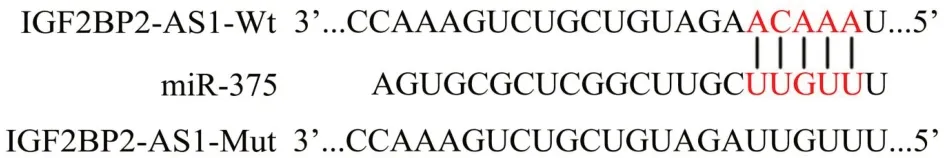
图3 IGF2BP2-AS1与miR-375的靶向结合位点
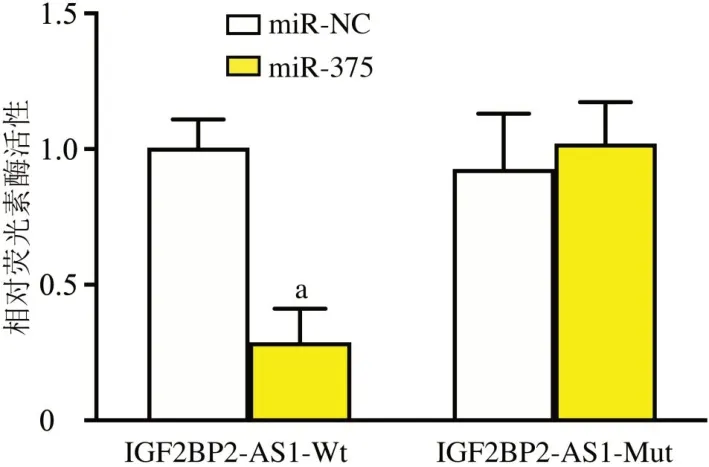
图4 双荧光素酶报告基因实验验证IGF2BP2-AS1 与miR-375的靶向关系
6.敲降IGF2BP2-AS1对miR-375表达的影响
si-NC 组和 si-IGF2BP2-AS1 组 TU686 细胞中miR-375 表达分别为(1.02±0.40)和(4.95±0.49),si-IGF2BP2-AS1 组TU686 细胞中miR-375 表达高于si-NC组(t=6.23,P<0.01)。
7.敲降IGF2BP2-AS1后TU686细胞中迁移及增殖蛋白表达情况
Western blotting 显示(图5),敲降IGF2BP2-AS1 表达后的TU686 细胞中迁移蛋白N-Cadherin、FOXC2 表达与增殖蛋白CDK2、Cyclin A表达均低于si-NC组。
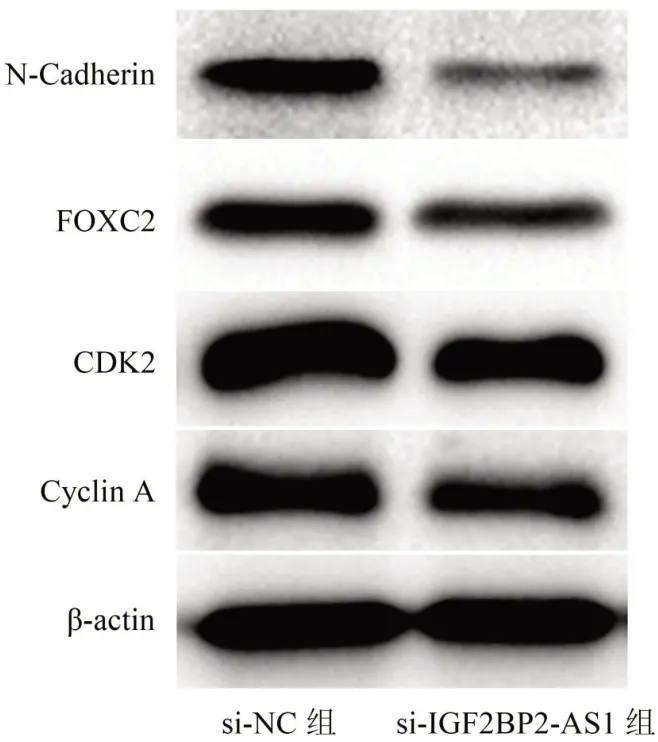
图5 敲降IGF2BP2-AS1 对喉癌细胞TU686 中迁移蛋白和增殖蛋白表达的影响
讨论
研究显示,lncRNA 广泛参与调控细胞的各种生命过程,如凋亡、代谢、迁移[13-16]。喉癌细胞中存在多种lncRNA的异常表达,lncRNA 已成为喉癌诊断的生物标志物以及治疗的分子靶点[17-19]。Lu 等[20]研究显示,喉癌组织和细胞系中lncRNA ZFAS1表达高于癌旁组织和正常鼻咽上皮细胞,高表达的lncRNA ZFAS1 与患者淋巴结转移、临床分期相关,lncRNA ZFAS1 可促进喉癌细胞增殖、侵袭以及N-钙粘蛋白和波形蛋白表达,并抑制E-钙粘蛋白表达。Wan 等[21]研究显示,lncRNA SNHG16 在喉癌组织和细胞系中表达上调,其通过调节miR-140-5p/Wnt/β-catenin 通路轴促进喉癌的发生发展。IGF2BP2-AS1是近年来新发现的一种促癌性lncRNA[11]。Tong 等[12]研究表明,与正常组织样本相比,口腔鳞状细胞癌中IGF2BP2-AS1 表达上调,且IGF2BP 2-AS1 高表达与口腔鳞状细胞癌患者的较差生存率相关;IGF2BP2-AS1 主要定位在细胞质中,其下调能够抑制细胞增殖和迁移,导致细胞周期停滞和细胞凋亡。目前,IGF2BP2-AS1对喉癌细胞调控的功能尚不清楚。
本研究证实,IGF2BP2-AS1在喉癌细胞系中高表达,提示IGF2BP2-AS1 可能参与调控喉癌的发生和进展。沉默IGF2BP2-AS1 表达后,喉癌TU686 细胞增殖和迁移能力均受到限制,说明IGF2BP2-AS1可能是喉癌治疗的潜在靶点。lncRNA 可发挥竞争性RNA 作用,以海绵吸附的方式降低miRNA 的表达,从而影响肿瘤细胞的各种生物过程[22-25]。例如,lncRNA NEAT1 可以通过功能性海绵miR-577 和miR-1224-5p 促进喉癌细胞的增殖,并抑制细胞凋亡[26]。本研究采用生物信息学软件LncRNome 分析显示,IGF2BP2-AS1 的核苷酸序列与miR-375 具有互补位点。miR-375 在结直肠癌、胃癌、膀胱癌等恶性肿瘤中低表达,能抑制肿瘤细胞的细胞周期、转移以及生长[27-29]。Dai等[30]研究显示,miR-375 在喉癌组织和细胞系中表达下调,过表达miR-375 明显抑制喉癌细胞的增殖、细胞周期和迁移能力。本研究通过双荧光素酶报告基因实验证实IGF2BP2-AS1 靶向结合miR-375。在TU686 细胞中,敲降IGF2BP2-AS1 后,miR-375 表达增高,进一步证实miR-375和IGF2BP2-AS1存在负向调控关系。
综上所述,IGF2BP2-AS1 在喉癌细胞系中呈高表达,IGF2BP2-AS1通过海绵吸附miR-375可影响喉癌细胞的迁移及增殖,IGF2BP2-AS1 的研究可为喉癌诊断和靶向治疗提供新的靶点。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明王挺:研究设计与实施、文章撰写;张杨、郭洁:数据采集;范崇盛:研究设计、对文章的知识性内容作批评性审阅;刘亚芳:统计分析、指导

