黄河麦春季制曲过程微生物多样性的分析研究
许 玲,董乔娟,姜明慧,王 洋,白秀彬,赵纪文*
(1.山东扳倒井股份有限公司,山东高青 256300;2.山东好客酒业有限公司,山东成武 274200)
优越的生态环境是中国白酒形成复合性、丰富性风格的自然条件。山东扳倒井股份有限公司地处北纬37°黄金名酒带和黄河“安澜湾”湿地交汇处。北纬37°是北半球暖温带的中位线,这里四季分明,温度适宜,世界上许多著名的酿酒产区都分布在该自然带上。黄河是中华民族的母亲河,万里黄河在高青“安澜”形成了独特的湿地环境,使扳倒井所在地具有温暖湿润、雨热同期的地域环境。
大曲,是酿酒风格形成的关键。国井扳倒井白酒采用黄河流域的冬小麦制曲。这里的小麦历经寒暑,经黄河水的灌溉,颗粒饱满,富含淀粉、蛋白质等营养成分,制备的大曲品质优良,酿酒一酒多味,完善发展了非物质文化遗产“宋代扳倒井白酒酿造技艺”。为进一步解析黄河麦曲的优良性能,本研究对春季制曲过程进行全面跟踪,运用高通量测序技术解析微生物多样性,明确了大曲在不同发酵阶段微生物群落结构和关键微生物种类,为优化操作、提升大曲质量提供了参考依据。
1 材料与方法
1.1 材料、仪器
曲样:黄河麦曲(春季生产过程),取自国井扳倒井制曲车间2#—19#曲房。
仪器设备:Illumina Miseq 2×300 bp 高通量测序平台(生工生物工程上海股份有限公司);大曲酶系测定相关仪器设备均由山东扳倒井股份有限公司提供。
1.2 试验方法
1.2.1 大曲发酵过程取样
根据生产工艺,在入房、不同翻曲时间节点、出房时进行大曲样品采集。采集时,按照四分法采样,从曲房的四角和中间5 个位置各取3 块长势良好的大曲曲块,全部粉碎后混合均匀,-20 ℃冰箱保存备用。
1.2.2 大曲理化指标及酶活力测定
测定大曲的水分、酸度、淀粉含量,糖化酶、液化酶、蛋白酶、酯化酶活力以及发酵力。按照《大曲检测方法》(BDJ/JW-WSW-06)进行。
1.2.3 大曲微生物类群的多样性分析
采用高通量测序技术分别对大曲中细菌类群和真菌类群的多样性进行分析。
细菌的16S rRNA 定制V4 区扩增引物为:515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3'),真菌扩增引物为ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')。
PCR 反应体系:12.5 μL 2×Taq PCRMasterMix,3 μL BSA(2 ng/μL),2Primer(5 μM),2 μL 模板DNA,5 μL ddH2O。反应参数:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸30 s,35 个循环;72 ℃延伸10 min 终止。扩增序列通过Illumina Miseq 2×300 bp 高通量测序平台进行测序,下机数据经过cutadapt(去除接头)、PEAR(序列对拼)、Prinseq(质量剪切),去除得分低于20 分、碱基模糊、引物错配或测序长度小于150 bp 的序列。
经过上述步骤后,将标签分组具有97 %序列相似性的高质量的OTU 序列[14-16],细菌得到的每个OTU 代表序列比对RDP 数据库、silva 数据库和NCBI 16S 数据库,真菌得到的OTU 代表序列比对RDP 数据库和UNITE 数据库。最后再通过人工进行检查以获得物种信息。
2 结果与分析
2.1 大曲发酵过程品温变化
由图1 可知,扳倒井春季制曲时曲房内培养时间在24 d 左右。培养过程经过三次翻曲、一次合房。中挺时间7 d左右,中挺温度60 ℃左右。
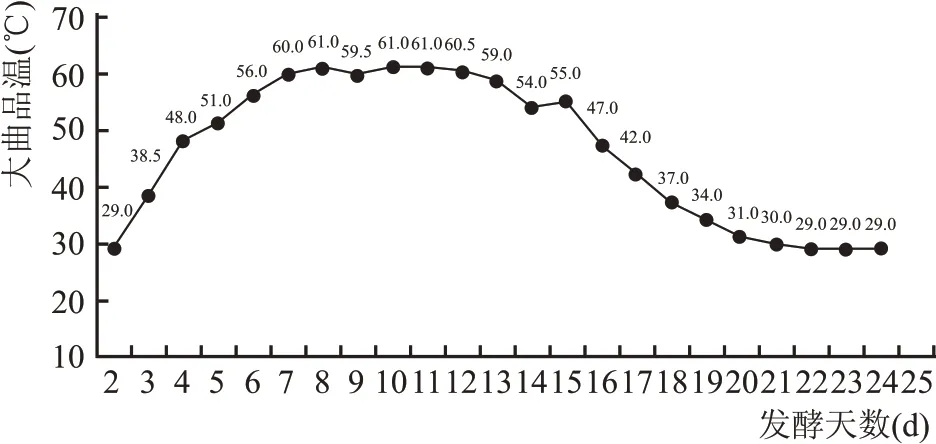
图1 中高温大曲发酵过程品温变化
2.2 大曲理化指标变化
由表1可知,一翻前曲块主要产酸,酸度由0.11上升至1.21,之后随发酵有所降低;三翻时液化酶活力达到最大,二翻和三翻之间是液化酶大量生成阶段,之后有所降低;小麦自身的糖化力较高,入房后糖化力降低,随着发酵进行,由于微生物的作用,糖化力有所起伏,但最终出房糖化力比较高;小麦自身带有发酵力,并且在整个发酵过程处于动态平衡;酯化力在合房到出房时是大量生成阶段;酸性蛋白酶是大曲发酵过程产生的酶类,一翻前就大量生成,随着发酵进行有所起伏。
2.3 微生物多样性
2.3.1 16S高通量分析
由表2 可知,入房时曲块的细菌菌群多样性最小(shannon 值最小),二翻前多样性越来越大,二翻后有所起伏;三翻前细菌菌群的丰富度越来越高,但三翻后逐渐降低。总体来看,二翻前的培养阶段是大曲微生物菌系生长比较活跃的时期。

表2 Alpha多样性指数统计表
由表3和图2可知:

表3 属水平下不同制曲阶段的细菌相对丰度比例(%)

图2 属水平下不同制曲阶段的细菌相对丰度柱状图
①制曲入房时,物料的微生物来源主要是原料和水中的微生物。因此链型植物占据绝对优势(49.12%),其次是泛菌属;
②之后的培养过程,泛菌属(Pantoea)、魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、不动杆菌属(Acinetobacter)、片球菌属(Pediococcus)、芽孢杆菌属(Bacillus)是主要的优势菌属,乳杆菌属相对丰度占到42.5%;
③一翻后至二翻,泛菌属(Pantoea)、魏斯氏菌属(Weissella)和芽孢杆菌属(Bacillus)占据优势;
④三翻操作时,泛菌属(Pantoea)再次占据绝对优势,相对丰度比例高达49.82 %。分析可能与采集样品有关;
⑤合房阶段,不动杆菌属(Acinetobacter)和泛菌属(Pantoea)占据优势,相对丰度分别是41.07 %和24.65%;
⑥出房时,未分类的肠杆菌科(unclassified_Enterobacteriaceae)占据绝对优势,魏斯氏菌属(Weissella)、泛菌属(Pantoea)也属优势菌属。
2.3.2 ITS高通量分析
由表4 可知,入房时真菌的多样性最小(shannon 值最小),随着培养过程出现波动,但变化不大;真菌丰富度的变化与多样性相似,出房时真菌丰富度最小。

表4 Alpha多样性指数统计表
由表5和图3可知:

表5 属水平下不同制曲阶段的真菌相对丰度比例(%)

图3 属水平下不同制曲阶段的真菌相对丰度柱状图
①入房时,物料和水携带的优势真菌为链格孢霉属(Alternaria)和双足囊菌属(Dipodascus);
②一翻时,优势真菌属发生较大变化,生丝毕赤酵母属(Hyphopichia)、威克汉姆酵母属(Wickerhamomyces)、根霉属(Rhizopus)、伊萨酵母属(Issatchenkia)占据优势,尤其生丝毕赤酵母属相对丰度高达39.97%;
③二翻时,威克汉姆酵母属(Wickerhamomyces)、根霉属(Rhizopus)、根毛霉属(Rhizomucor)为优势菌属;
④三翻时,根毛霉属(Rhizomucor)、根霉属(Rhizopus)、伊萨酵母属(Issatchenkia)成为优势菌属;
⑤合房时,根毛霉属(Rhizomucor)、生丝毕赤酵母属(Hyphopichia)、根霉属(Rhizopus)、威克汉姆酵母属(Wickerhamomyces)为优势菌属;
⑥出房时,伊萨酵母属(Issatchenkia)、威克汉姆酵母属(Wickerhamomyces)、根毛霉属(Rhizomucor)为优势菌属。
2.4 综合分析
2.4.1 温度和水分对微生物多样性的影响
①一翻之前,水分损耗较小,芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、生丝毕赤酵母属(Hyphopichia)、根霉属(Rhizopus)在小麦自身糖化的情况下,利用糖类迅速繁殖,占据微生物群落优势,曲块品温由30 ℃上升到48 ℃左右。
②二翻至三翻时曲块品温到达60 ℃左右,并且持续时间较长。这个温度对微生物的生长繁殖已经造成较大影响,但温度的上升是有一个过程的,对大曲微生物形成了温度驯化,因此,此时仍然由泛菌属(Pantoea)、威克汉姆酵母(Wickerhamomyces)、根霉属(Rhizopus)、根毛霉属(Rhizomucor)等耐高温的菌属占据优势。经过这个高温阶段,水分散发也比较快,降到了14.8%。
③三翻后曲块的品温逐步降低,魏斯氏菌属(Weissella)、生丝毕赤酵母属(Hyphopichia)、伊萨酵母属(Issatchenkia)等又开始活跃成为优势菌属,尤其是出房时伊萨酵母属(Issatchenkia)和威克汉姆酵母属(Wickerhamomyces)占据真菌较大优势。
2.4.2 酶系与微生物菌属的关系
①在一翻前乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和片球菌属(Pediococcus)占据绝对优势,推测是造成大曲酸度上升和酸性蛋白酶生成的主要菌属;
②二翻至三翻时的根霉属(Rhizopus)和根毛霉属(Rhizomucor)占据优势,推测是液化力和糖化力的主要贡献者,尤其是液化力,在二翻和三翻时达到顶峰;
③合房后的后熟阶段,酵母菌属占据优势,推测是出房酯化力的主要贡献者。
3 结论
扳倒井黄河麦春季制曲工艺经历三次翻曲,翻曲节点品温控制为48 ℃、61 ℃、61 ℃,中挺时间控制在6~7 d,微生物菌群多样性和酶系丰富,其中乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和片球菌属(Pediococcus)是造成大曲酸度上升和酸性蛋白酶生成的主要菌属,根霉属(Rhizopus)和根毛霉属(Rhizomucor)是液化力和糖化力的主要贡献者,酵母菌属是大曲酯化力的主要贡献者。下一步将进一步挖掘可培养的菌属资源,并进一步探究其和制曲操作的对应关系,提升大曲质量,为白酒品质提升奠定基础。

