蒲公英水煎液对犊牛源多重耐药大肠杆菌耐药性的消除作用
王 琪,张惠玲,刘日蓉,孙 月,李培锋,樊舒婷,宋 晨,郝普国,徐文琦,郭 宇,赵红霞
(1.内蒙古农业大学兽医学院,内蒙古 呼和浩特 010010 ; 2.北京第二外国语学院中东学院,北京 朝阳 100024 ;3.鄂尔多斯生态环境职业学院生物技术系,内蒙古 鄂尔多斯 017000 ; 4.内蒙古动物疾病预防控制中心 ,内蒙古 呼和浩特 010010)
犊牛腹泻是养牛业常见疾病,发病率高达90%,死亡率高达50%以上,对犊牛的生长、发育和成活等有重大的影响[1-3]。大肠杆菌(Escherichiacoli,E.coli)是引起犊牛腹泻的主要病原菌之一,且随着养殖业规模化和现代化的发展,使用抗菌药物防控由大肠杆菌引起的犊牛腹泻已成为主流[4]。但抗菌药物的不合理使用不仅引发了很多公共卫生问题,同时也造成了巨大的经济损失。
蒲公英(TaraxacummongolicumHand. -Mazz.)属菊科,是由蒲公英属植物的全草炮制而成,临床研究发现其具有较强的抑菌抗炎[5]、利胆保肝、降血糖、降血脂、抗氧化和抗肿瘤等作用[6-7]。因此,本试验以蒲公英为对象,通过对内蒙古地区引起犊牛腹泻的大肠杆菌进行分离、鉴定和药敏试验,对其所携带的耐药基因进行分析,并筛选出耐药菌株,研究蒲公英对其耐药性的消除作用,以期为兽医临床治疗由大肠杆菌引起的犊牛腹泻提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 样品来源 犊牛源口腔病料、鼻腔病料和粪便病料共107份,来源于内蒙古地区大型牧场;标准菌株 ATCC 25922,由内蒙古农业大学兽医药理学与毒理学实验室保存。
1.1.2 主要试剂 普通琼脂培养基、伊红美蓝琼脂培养基、普通肉汤培养基和肠杆菌生化鉴定管,均购自青岛高科园海博生物技术有限公司;细菌基因组 DNA 提取试剂盒,购自上海捷瑞生物工程有限公司;氨苄西林(Ampicillin,Amp)、美罗培南(Meropenem,Mer)、头孢噻吩(Cephalothin,Cel)、头孢吡肟(Cefepime,Cep)、头孢噻肟(Cefotaxime,Cet)、头孢西丁(Cefoxitin,Cex)、多西环素(Doxycycline,Dox)、四环素(Tetracycline,Tet)、米诺环素(Minocycline,Min)、环丙沙星(Ciprofloxacin,Cip)、左氧氟沙星(Levofloxacin,Lev)、加替沙星(Gatifloxacin,Gat)、氧氟沙星(Ofloxacin,Ofl)、阿米卡星(Amikacin,Ami)、卡那霉素(Kanamycin,Kan)、庆大霉素(Gentamycin,Gen)、妥布霉素(Tobramycin,Tob)和多黏菌素B(Polymyxin B,PMB)18种抗菌标准药物,均购自中国兽医药品监察所;中药蒲公英,购自呼和浩特市国大药房。
1.1.3 主要仪器 智能生化培养箱(SPX-160),购自宁波江南仪器厂;紫外可见分光光度计,购自北京普析通用仪器有限责任公司;恒温振荡培养箱(HZC-250),购自太仓市实验设备厂;超净工作台(S.SW-CJ-1F),购自上海跃进医疗器械有限公司;PCR 仪(2720 Thermal cycler),购自 Thermofisher 公司。
1.2 试验方法
1.2.1 犊牛源大肠杆菌的分离和鉴定 将病料划线接种于伊红美蓝琼脂培养基,对纯化培养后的大肠杆菌进行革兰染色涂片镜检,结合生化试验和分子生物学方法对所分离菌株进行鉴定。
1.2.2 药物敏感试验 选用18种抗菌药物对大肠杆菌分离菌株进行药敏试验,按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) 推荐的K-B法进行,结果依据 CLSI 2019年推荐的药敏试验执行标准进行判定[8]。
1.2.3 犊牛源大肠杆菌耐药基因的检测 采用PCR方法检测β-内酰胺类耐药基因(blaTEM、blaCTX-M)、喹诺酮类耐药基因[qnr(A)、qnr(S)]、四环素类耐药基因[tet(A)、tet(D)]和氨基糖苷类耐药基因[aad(B)、aac(C)],引物序列见表1。

表1 引物信息
1.2.4 蒲公英水煎液最小抑菌浓度(Minimum inhibitory concentration,MIC)的测定
1.2.4.1 菌液的制备 将分离菌株划线接种于普通琼脂培养基,培养24 h后,挑取单菌落接种于普通肉汤培养基中,于37 ℃、150 r/min培养16 h进行活化,将活化后菌液的含菌量调整至0.5麦氏单位(约含 1×108CFU/mL),即紫外可见分光光度计测定菌液在625 nm处的吸光度值为0.08~0.13。将调整好浓度的菌液再稀释1 000倍,使其含菌量变为1×105CFU/mL。
1.2.4.2 蒲公英水提物的制备 称取 50 g 蒲公英,浸泡于蒸馏水中2 h,先用武火煎煮,沸腾后改用文火煮 30 min,纱布过滤,药渣再加蒸馏水煮30 min,合并2次滤液,浓缩至25 mL,110 ℃、20 min 高压灭菌后,置于 4 ℃冰箱备用。
1.2.4.3 琼脂稀释法测定MIC 取8支灭菌试管依次进行编号,1号试管加入2 mL蒲公英水煎液(2 g/mL),除1号试管外其余试管各加入2 mL生理盐水,2号试管加入2 g/mL蒲公英水煎液2 mL,吹打混匀后吸取2 mL加入3号试管,依次按二倍倍比稀释至8号试管后弃去2 mL。取8个无菌平板均加入18 mL灭菌普通琼脂培养基并依次编号,分别吸取上述1~8号试管中的药液2 mL于对应平板中。将稀释好的菌液分别划线接种于平板上,37 ℃恒温培养18~24 h,抑制细菌生长的最低药物浓度即为MIC。
1.2.5 蒲公英水煎液耐药消除作用的检测 以耐药菌株(根据耐药表型选取1株多重耐药菌株)的亚抑菌浓度(即1/2MIC)进行蒲公英水煎液耐药消除试验。在无菌试管中用普通肉汤培养基把蒲公英水煎液浓度稀释至 1/2 MIC,同时设立不加药液的普通肉汤培养基作为空白对照组,将在37 ℃恒温培养箱摇菌培养好的耐药株和标准菌株稀释至1×106CFU/mL,取菌液100 μL 分别接种于各试管中,37 ℃ 恒温振荡培养,间隔24 h 传代接种;传代3次后,分别取培养24、48和72 h的菌液与药液培养物,用 K-B 法检测耐药菌株对氧氟沙星和妥布霉素的耐药表型变化情况。
2 结果
2.1 犊牛源大肠杆菌的分离和鉴定 本试验共分离鉴定得到44株犊牛源大肠杆菌,分离率为41%,其中从口腔病料中分离到5株(11%),从鼻腔病料中分离到7株(16%),从粪便病料中分离到32株(73%)。
2.2 药物敏感试验 犊牛源大肠杆菌分离株对18种抗菌药物体外药物敏感性测定结果如表2所示,犊牛源大肠杆菌分离株对β-内酰胺类抗菌药物耐药严重,其中对氨苄西林的耐药率达到了100%,对头孢噻吩和头孢噻肟耐药率相同,为 66%,对头孢西丁的耐药率为32%,对头孢吡肟相对敏感,耐药率为18%;对四环素类抗菌药物中的多西环素和米诺环素较敏感,耐药率为16%,而对四环素相对耐药,耐药率达到了43%;对喹诺酮类抗菌药物耐药情况相对严重,其中对环丙沙星的耐药率达到了75%,对左氧氟沙星和氧氟沙星的耐药率分别为55%和45%;对氨基糖苷类抗菌药物相对耐药,其中对卡那霉素和庆大霉素的耐药率分别达到了45%和39%,对阿米卡星和妥布霉素的耐药率分别为 27%和 23%;几乎所有的犊牛源大肠杆菌分离株都对碳青霉烯类的美罗培南和多肽类的多黏菌素B敏感,耐药率均为2%。
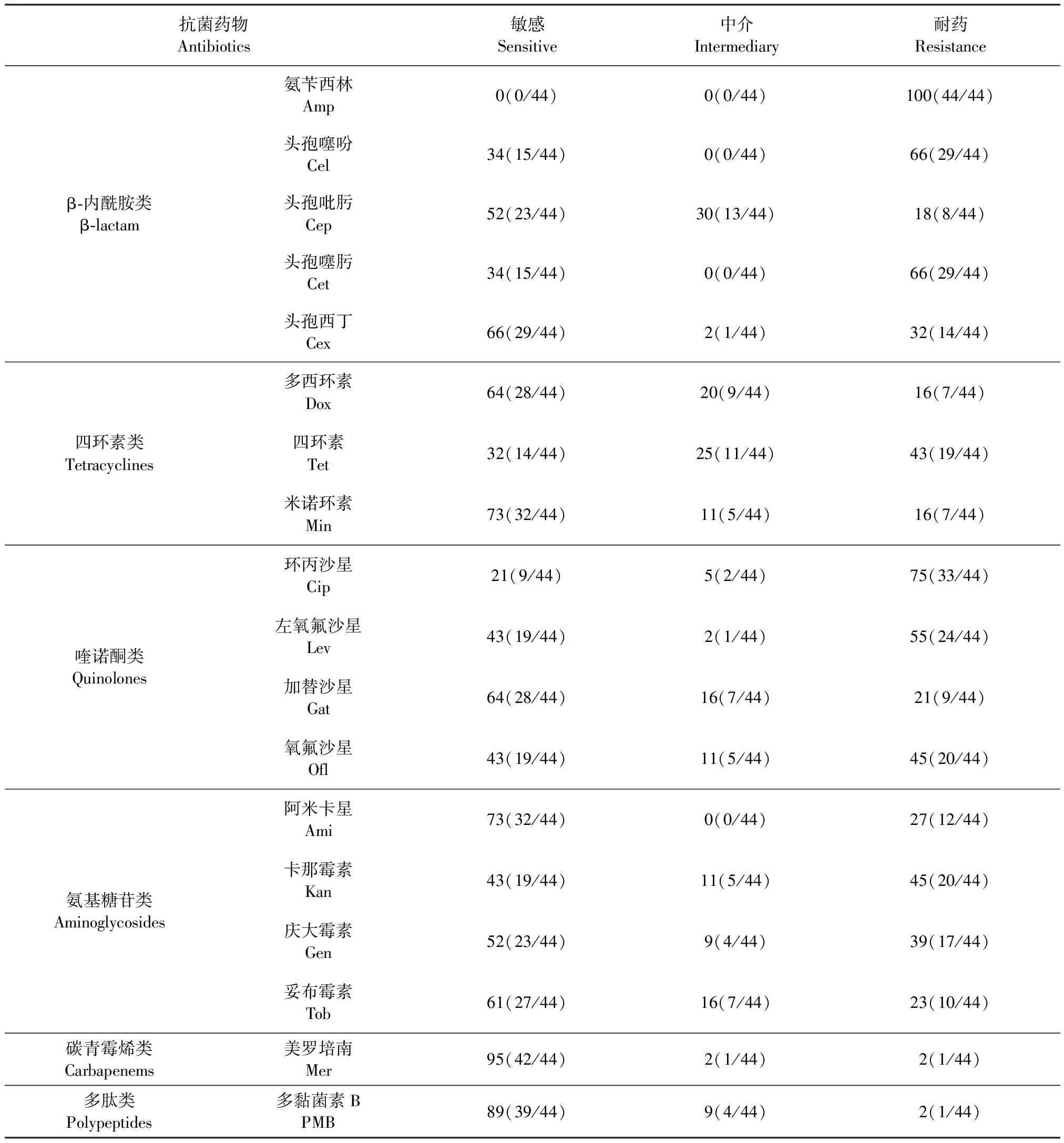
表2 44株犊牛源大肠杆菌分离株药物敏感性测定结果
2.3 犊牛源大肠杆菌耐药基因的检测 β-内酰胺类耐药基因的检出率最高,其中blaCTX-M基因检出数最多,共38株分离株可检出该基因(86%)(部分结果见图1),27株分离株可检出blaTEM基因(61%);对氨基糖苷类耐药的犊牛源大肠杆菌中,aac(C)基因检出数最多,共16株分离株可检出该基因(36%),2株分离株可检出aad(B)基因(5%);对四环素类耐药的大肠杆菌中,分别有23株(52%)和6株(14%)分离株可检出tet(A)基因和tet(D)基因;对喹诺酮类耐药的大肠杆菌中,2株分离株可检测到qnr(A)基因(5%),14株分离株可检测到qnr(S)基因(32%)。
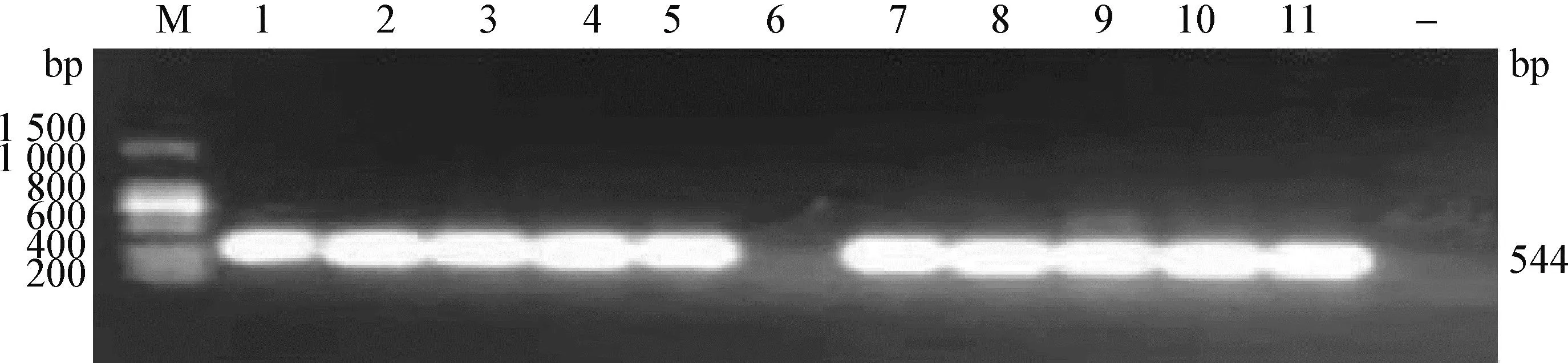
图1 blaCTX-M基因的PCR检测
2.4 蒲公英水煎液MIC的测定 经琼脂稀释法测定,蒲公英水煎液的MIC为200 mg/mL。
2.5 蒲公英水煎液耐药消除作用的检测 选取44株犊牛源大肠杆菌中耐14种抗菌药物的39号分离株作为进行耐药消除试验的耐药菌株,将蒲公英水煎液消除组与空白对照组药敏试验结果进行比较。如表3所示,通过蒲公英水煎液处理的犊牛源大肠杆菌耐药菌株在培养48和72 h后抑菌圈直径明显增加;如表4所示,其对氧氟沙星和妥布霉素均可以达到一定的敏感程度。
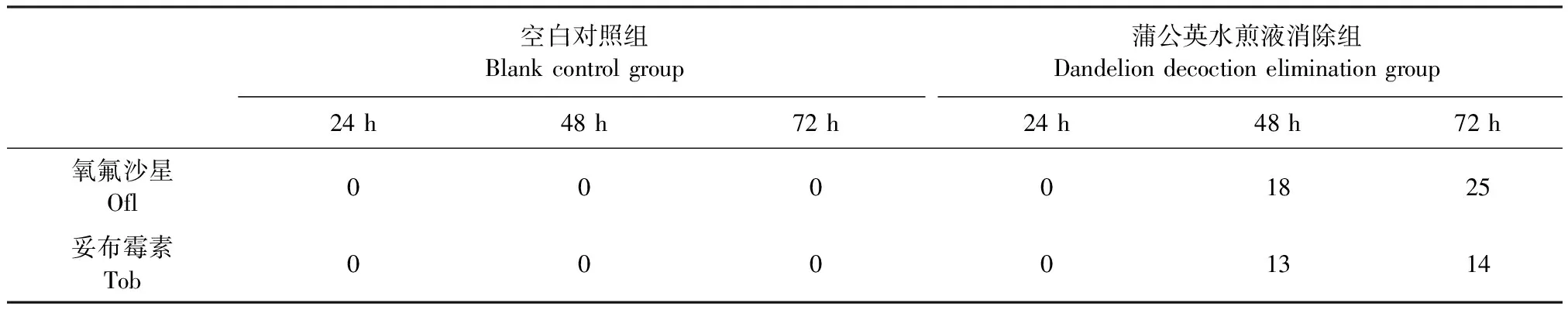
表3 蒲公英水煎液对抗菌药物抑菌圈直径的影响
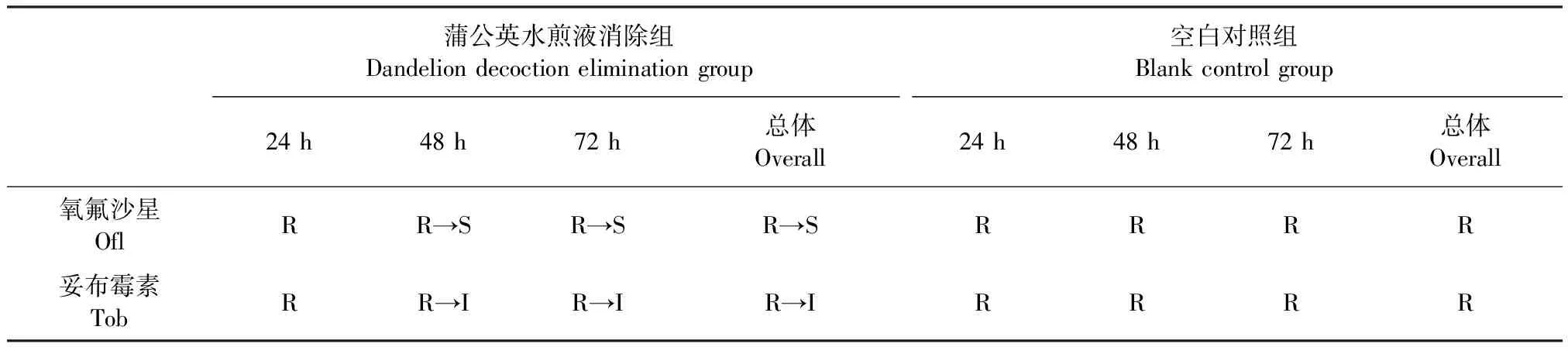
表4 蒲公英水煎液对犊牛源大肠杆菌耐药表型的影响
3 讨论
本试验从来源于内蒙古地区大型牧场的107份病料中分离鉴定出44株犊牛源大肠杆菌,分离率为41%;李慧等[9]研究中对石河子地区53份犊牛腹泻粪便样品进行分离,得到的29株大肠杆菌,分离率达到55%;在王姣姣等[10]研究中对吉林省部分地区犊牛腹泻的64份直肠拭子进行分离,得到39株致病性大肠杆菌,分离率达到60%;而在高海慧等[11]研究中,从35份犊牛腹泻样本中分离鉴定得到26株大肠杆菌,其分离率高达74%,上述研究中大肠杆菌分离率均高于本试验。本试验选取18种抗菌药物进行药物敏感试验,结果显示,44株犊牛源大肠杆菌对氨苄西林、头孢噻吩、头孢噻肟、环丙沙星和左氧氟沙星5种抗菌药物的耐药率均高于50%;陈虹豆等[12]分离到的腹泻犊牛源大肠杆菌对环丙沙星有较好的敏感性,对米诺环素也有一定的敏感性;吴同垒等[13]研究表明,秦皇岛地区的腹泻犊牛源大肠杆菌对庆大霉素和阿米卡星的耐药率均为83%,对氧氟沙星最敏感,而本试验分离菌株对环丙沙星高度耐药,达75%,而对米诺环素敏感性较高,对庆大霉素和阿米卡星也表现出一定程度的耐药性,但对氧氟沙星的耐药率却达到了45%。本试验对44株犊牛源大肠杆菌进行8种耐药基因的检测,结果显示,分离菌株均呈现不同程度的耐药基因携带情况,尤其对β-内酰胺类耐药基因的检出率最高,同药敏试验中对β-内酰胺类抗菌药物的耐药率最高一致,表明耐药基因的检出率与药物的敏感性也有一定程度的关联。杨艳丽等[14]报道显示,新疆地区牛源大肠杆菌喹诺酮类耐药基因主要是qnr(A)基因,而本试验中主要为qnr(S)基因;张陆等[15]通过对哈尔滨地区腹泻犊牛大肠杆菌耐药基因进行检测发现,blaCTX-M耐药基因检出率为19.2%,而本试验中blaCTX-M检出率达到了86%;刘勃兴等[16]研究结果显示,河北省腹泻犊牛大肠杆菌四环素类耐药基因tet(C)检出率高达100%,tet(D)基因检出率为0,与本试验所得的四环素类耐药基因主要为tet(A)和tet(D),且检出率分别为52%和14%有一定的差异;以上数据说明,不同地区分离株对药物的敏感程度存在一定差异,但结果表现的不同可能与细菌中存在多种耐药机制有关系,需要进一步对其进行探究。
中药能够逆转细菌对抗菌药物的耐药性,在蒲公英的作用下,耐药菌株对氧氟沙星和头孢霉素的敏感性提高,由原来的耐药菌株转变为敏感菌株。本试验初步证明了蒲公英具有一定的耐药消除作用,通过将犊牛源大肠杆菌与蒲公英水煎液相互作用,对比消除后抑菌圈直径的大小,结果显示,蒲公英水煎液对不同种类的抗菌药物恢复了一定的敏感性;王永芬等[17]用石榴皮、黄芩和黄连作用于猪致病性大肠杆菌的研究结果显示,3种中药对大肠杆菌都有逆转耐药性的作用;赵秋云[18]使用4组中药对15株致病性大肠杆菌进行耐药消除试验,发现经中药培养后各组菌株对抗菌药物的敏感性均增强;刘金平等[19]使用中药提取物恢复耐药大肠杆菌对氨基糖苷类药物敏感性的研究证明,中药可以从一定程度上恢复大肠杆菌对抗菌药物的敏感性。以上研究证实,中药可以增加细菌对抗菌药物的敏感性,降低耐药性,而且耐药性的消除与中药的作用时间密切相关,在一定时间内,中药作用时间越长,耐药性的消除效果越好[20]。
内蒙古地区犊牛源大肠杆菌的耐药情况比较严重,抗菌药物的滥用可能会增加细菌获得耐药基因的潜力,应尽量减少抗菌药物的使用,并逐渐通过中药来缓解耐药性,本试验可为临床合理用药提供参考依据。

